 Seite drucken
Seite drucken
 Entscheidung als PDF runterladen
Entscheidung als PDF runterladen
 Seite drucken
Seite drucken
 Entscheidung als PDF runterladen
Entscheidung als PDF runterladen

tateinheitlich zusammentreffenden Fällen (uneigentliches Organisationsdelikt), davo
Der Angeklagte ist strafbar wegen
21 (a) des vorsätzlichen Verstoßes gegen das Arzneimittelgesetz in 14.537
3tateinheitlich zusammentreffenden Fällen (uneigentliches Organisationsdelikt), davon
4in 14.498 Fällen durch das Herstellen und Inverkehrbringen von Arzneimitteln, die durch Abweichung von den anerkannten pharmazeutischen Regeln in ihrer Qualität nicht unerheblich gemindert und die gefälscht waren, und
5in 39 Fällen durch das Herstellen von Arzneimitteln, die durch Abweichung von den anerkannten pharmazeutischen Regeln in ihrer Qualität nicht unerheblich gemindert und die gefälscht waren,
6(b) des vorsätzlichen Verstoßes gegen das Arzneimittelgesetz in 27 weiteren (tatmehrheitlichen) Fällen durch das Herstellen von Arzneimitteln, die durch Abweichung von den anerkannten pharmazeutischen Regeln in ihrer Qualität nicht unerheblich gemindert und die gefälscht waren, sowie
72. wegen Betruges in 59 Fällen, wobei es in einem Fall beim Versuch blieb.
8Er wird zu einer Gesamtfreiheitsstrafe von
9zwölf Jahren
10verurteilt.
11Im Übrigen wird der Angeklagte freigesprochen.
12IV.
13Dem Angeklagten wird für immer verboten, den Beruf des Apothekers auszuüben.
14V.
15Gegen den Angeklagten wird die Einziehung eines Wertersatzbetrages in Höhe von
1617.000.000,00 Euro angeordnet.
17VI.
18Von einer Entscheidung über die Adhäsionsanträge der Adhäsionsklägerinnen
19wird abgesehen.
20VII.
21Der Angeklagte trägt die Kosten des Verfahrens, soweit er verurteilt wurde. Soweit der Angeklagte freigesprochen wurde, trägt die Staatskasse die Kosten des Verfahrens und die notwendigen Auslagen des Angeklagten.
22Der Angeklagte trägt die notwendigen Auslagen der Nebenkläger XXX
23Die Kosten des Adhäsionsverfahrens und die insoweit entstandenen notwendigen Auslagen des Angeklagten werden den Adhäsionsklägern auferlegt.
24Angewandte Vorschriften:
25§§ 95 Abs. 1 Nr. 3a, Abs. 3 S. 1, 2 Nr. 1c), Nr. 2 (in der seit dem 18.12.2015 gültigen Fassung, vormals Nr. 3 i.d.F. vom 31.05.2011, unverändert gültig bis zum 17.12.2015), 8 Abs. 1 Nr. 1, Abs. 2 (i.d. seit dem 26.10.2012 gültigen Fassung, vormals Abs. 1 Nr. 1a) i.d.F. vom 17.07.2009, gültig bis zum 25.10.2012) AMG, § 263 Abs. 1, Abs. 2, Abs. 3 S. 1, 2 Nr. 1, §§ 22, 23, 52, 53, 70 Abs. 1, 73 Abs. 1, 73c S. 1, 73d Abs. 2 StGB
26Gründe:
27Dem Urteil ist keine Verständigung vorausgegangen. Eine Gliederung des Urteils ist als Anlage beigefügt.
28Überblick:
29Der Angeklagte versorgte als Apotheker fünf Jahre lang Krebskranke mit unterdosierten Arzneimitteln, um sich selbst ein Luxusleben zu finanzieren und sich in seiner Heimatstadt als Gönner und Wohltäter aufzuspielen.
30Der Angeklagte war im Tatzeitraum vom 01.01.2012 bis zum 29.11.2016 als selbständiger Apotheker Alleininhaber und Betreiber einer öffentlichen Apotheke in Bottrop, der XXX Apotheke“. Neben dem gewöhnlichen Apothekenbetrieb hatte er sich auf das Herstellen patientenindividueller parenteraler Arzneimittelzubereitungen für die Krebstherapie spezialisiert, die er an onkologische Arztpraxen und Krankenhäuser lieferte. Diese Zubereitungen wurden teils vom Angeklagten, teils von bestimmten Mitarbeitern in einem speziellen Reinraumlabor hergestellt. Mit zuletzt rund 90 Beschäftigten erzielte der Angeklagte einen Jahresumsatz von rund 40 Mio. Euro.
31Tatkomplex I:
32Herstellen und Ausliefern unterdosierter und/oder mikrobiell kontaminierter Zu-
33bereitungen
34Die Anklage der Staatsanwaltschaft wirft dem Angeklagten vor, im Tatzeitraum insgesamt 61.980 konkret nach Herstellungsdatum, Herstellungskennziffer, Patientenname, Wirkstoff und vorgesehener Dosis bezeichnete Arzneimittelzubereitungen hergestellt zu haben, die nicht den deklarierten Wirkstoff in der ärztlich verschriebenen Menge enthalten hätten und/oder durch unhygienische Herstellungsbedingungen mikrobiell kontaminiert gewesen seien. Die Zubereitungen habe er entweder eigenhändig hergestellt oder durch entsprechend angewiesene Mitarbeiter herstellen lassen. Von den 61.980 Zubereitungen habe er bis einschließlich zum 28.11.2016 eine Anzahl von 61.863 an behandelnde Ärzte ausgeliefert, während die weiteren 117 Zubereitungen
359
36am 29.11.2016 kurz vor der vorgesehenen Auslieferung von der Polizei sichergestellt worden seien.
37Zu diesem Tatkomplex hat die Kammer folgende Feststellungen getroffen:
38Die Gesamtzahl der unterdosierten Zubereitungen im Tatzeitraum beläuft sich auf (mindestens) 14.564 Stück.
39Von den 117 Zubereitungen, die am frühen Morgen des 29.11.2016 vor ihrer Auslieferung sichergestellt wurden, enthielten 66 nicht den deklarierten Wirkstoff in der ärztlich verschriebenen Menge, wobei die Kammer eine Toleranz von 10 % der Wirk-stoffmenge zugrunde gelegt hat:
40- In 27 dieser Fälle stellt die Kammer eine eigenhändige Zubereitung des Angeklagten fest [Tenor zu I. 1. (b)], jedoch keine mikrobielle Kontamination.
41- In 39 weiteren Fällen stellt die Kammer teils eine eigenhändige Zubereitung durch identifizierte andere Mitarbeiter der Apotheke des Angeklagten auf dessen Veranlassung hin fest, teils bleibt offen, wer die Zubereitung eigenhändig hergestellt hat [Tenor zu I. 1. (a), 2. Spiegelstrich]. Eine mikorbielle Kontamination stellt die Kammer nicht fest.
42- In den übrigen 51 Fällen stellt die Kammer weder eine Unterdosierung außerhalb der genannten Toleranz noch eine mikrobielle Kontamination fest. [Tenor zu III. – Freispruch und Ausführungen unter VIII. 2.]
43Von den 61.863 Zubereitungen, die bis einschließlich 28.11.2016 hergestellt und ausgeliefert wurden,
44- enthielten 14.498 nicht den deklarierten Wirkstoff in der ärztlich verschriebenen Menge, wobei die Kammer eine Toleranz von 20 % der Wirkstoffmenge zugrunde gelegt hat [Tenor zu I. 1. (a), 1. Spiegelstrich], die Kammer stellt jedoch keine mikrobielle Kontamination fest.
45- Bei den weiteren 47.365 Zubereitungen stellt die Kammer weder eine Unterdosierung außerhalb der genannten Toleranz noch eine mikrobielle Kontamination fest. [Tenor zu III. - Freispruch].
46Hinsichtlich dieser 61.863 Zubereitungen gilt weiter Folgendes:
4710
48- Bei Zubereitungen mit einem Teil der Wirkstoffe hat die Kammer insgesamt oder für einzelne Jahre keine Unterdosierungen und keine mikrobielle Kontamination festgestellt und den Angeklagten in diesen individualisierbaren Fällen aus tatsächlichen Gründen freigesprochen. Dies betrifft die Wirkstoffe Azacitidine, Af-libercept, Bendamustin, Cabazitaxel, Carfilzomib, Cyclophosphamid, Decitabin (nur 2013), Doxorubicin, Myocet, Fluorouracil, Folinsäure, Temsirolimus (nur 2012), Topotecan, Vinflunin (nur 2012) und Vinorelbin. Betroffen sind insoweit 30.282 Taten. [Tenor zu III. – Freispruch und Ausführungen unter VIII. 4.]
49- Bei Zubereitungen mit dem Wirkstoff Bevacizumab hat die Kammer in 2.317 individualisierbaren Fällen eine Verwendung zur Herstellung so genannter „Augenspritzen“ festgestellt. In diesen Fällen hat die Kammer keine Unterdosierungen und keine mikrobielle Kontamination festgestellt und den Angeklagten aus tatsächlichen Gründen freigesprochen. [Tenor zu III. – Freispruch und Ausführungen unter VIII. 5.]
50- Bei 970 Zubereitungen mit bestimmten weiteren Wirkstoffen hat die Kammer individualisierbare Fälle von Zubereitungen festgestellt, die mit so genannter „Studienware“ hergestellt wurden. In diesen Fällen hat die Kammer keine Unterdosierungen und keine mikrobielle Kontamination festgestellt und den Angeklagten aus tatsächlichen Gründen freigesprochen. Dies betrifft die Wirkstoffe Eribulin (7 Fälle), Nab-Paclitaxel (255 Fälle), Panitumumab (44 Fälle), Pertuzu-mab (292 Fälle), Trastuzumab (213 Fälle) und Trastuzumab Emtansine (159 Fälle). [Tenor zu III. – Freispruch und Ausführungen unten VIII. 3.]
51- Bei den nach diesen „Abzügen“ verbleibenden Zubereitungen mit den übrigen Wirkstoffen, nämlich
52Bevacizumab ohne „Augenspritzen“, Bortezomib, Brentuximab, Cetuxi-mab, Daratumumab, Decitabin (2014 - 2016), Denosumab, Eribulin ohne „Studienware“, Nab-Paclitaxel ohne „Studienware“, Nivolumab, Obinutu-zumab, Ofatumumab, Panitumumab ohne „Studienware“, Pembrolizu-mab, Pemetrexed, Pertuzumab ohne „Studienware“, Ramucirumab, Ri-tuximab, Temsirolimus, Trabectedin, Trastuzumab ohne „Studienware“, Trastuzumab Emtansine ohne „Studienware“, Treosulfan, Vinblastin und Vinflunin
5311
54hat die Kammer zwar Unterdosierungen festgestellt, jedoch bei keinem dieser Wirkstoffe für sämtliche verbleibenden Taten der Anklage. Insoweit steht nur fest, dass und wie viele Unterdosierungen es bei den Zubereitungen mit dem jeweiligen Wirkstoff (mindestens) gegeben hat, während es offen bleibt, in welchen der in der Anklageschrift aufgeführten Fällen genau unterdosiert wurde. Rechtlich hat die Kammer diesen Befund nach den Regeln der gleichartigen Wahlfeststellung behandelt und den Angeklagten in den bereits vorstehend genannten 14.498 Fällen verurteilt [Tenor zu I. 1. (a), 1. Spiegelstrich], hinsichtlich der übrigen 13.787 Fälle freigesprochen [Tenor zu III. - Freispruch]
55- Die Kammer stellt weiter fest, dass die überwiegende Anzahl der unterdosierten 14.498 Zubereitungen durch den Angeklagten eigenhändig hergestellt wurde. In einigen Fällen wurden die Unterdosierungen durch entsprechend angewiesene Mitarbeiter mit Wissen und Billigung des Angeklagten hergestellt; dabei ist (im Gegensatz zu einem Teil der am 29.11.2016 sichergestellten Zubereitungen) nicht feststellbar, in welchen Fällen der Angeklagte und in welchen Fällen Mitarbeiter handelten. Rechtlich hat die Kammer dem Angeklagten sämtliche Fälle nach den Regeln des uneigentlichen Organisationsdelikts zugerechnet.
56- Die Kammer konnte nicht feststellen, dass ein konkreter Patient, dem eine unterdosierte Zubereitung verabreicht wurde, aufgrund der Unterdosierung verstarb oder sich aufgrund der Unterdosierung sein Leben verkürzte oder er in Lebensgefahr geriet.
57Der Angeklagte handelte bei allen (mindestens) 14.564 Unterdosierungen absichtlich in dem Sinne, dass er sie entweder selbst eigenhändig absichtlich unterdosierte oder die Mitarbeiter absichtlich anwies, sie unterzudosieren; in den letztgenannten Fällen handelten auch die angewiesenen Mitarbeiter absichtlich.
58Die Kammer konnte nicht feststellen, dass der Angeklagte damit rechnete und es in Kauf nahm, dass aufgrund der Unterdosierung ein konkreter Patient sterben oder sich sein Leben verkürzen oder er in Lebensgefahr geraten würde.
59Zum Beweis der Feststellungen: Der Angeklagte hat sich in der Hauptverhandlung nicht eingelassen. Gegenüber den psychiatrischen Sachverständigen hat er im Rahmen der Exploration einige Angaben vorwiegend zu seinem Lebenslauf und allgemein
6012
61zu seiner Tätigkeit in der Apotheke gemacht, nicht jedoch zum eigentlichen Tat-
62geschehen. Den Beweis der Unterdosierungen stützt die Kammer daher für die Zubereitungen, die am 29.11.2016 sichergestellt worden sind, im Wesentlichen auf sachverständige pharmakologische Analysen. Für die Zubereitungen, die bis einschließlich 28.11.2016 ausgeliefert worden sind, stützt die Kammer den Beweis der Unterdosierungen im Wesentlichen auf einen Vergleich der vom Angeklagten eingekauften Wirk-stoffmenge mit der (vermeintlich) verarbeiteten und ausgegebenen Menge.
63Rechtlich hat die Kammer die 14.498 Fälle der unterdosierten Zubereitungen, die bis einschließlich 28.11.2016 hergestellt und ausgeliefert wurden, gewürdigt als
64- vorsätzlichen Verstoß gegen das Arzneimittelgesetz durch Herstellen und In-
65verkehrbringen von Arzneimitteln, die durch Abweichung von den anerkannten pharmazeutischen Regeln in ihrer Qualität nicht unerheblich gemindert und die gefälscht waren.
66Die 66 (27 + 39) Fälle der am 29.11.2016 sichergestellten unterdosierten Zubereitungen hat die Kammer rechtlich gewürdigt als
67- vorsätzlichen Verstoß gegen das Arzneimittelgesetz durch Herstellen von Arz-
68neimitteln, die durch Abweichung von den anerkannten pharmazeutischen Regeln in ihrer Qualität nicht unerheblich gemindert und die gefälscht waren.
69Konkurrenzrechtlich hat die Kammer die erstgenannten 14.498 Fälle einschließlich derjenigen 39 Fälle vom 29.11.2016, in denen nicht der Angeklagte eigenhändig die Zubereitungen hergestellt hatte, als tateinheitliches uneigentliches Organisationsdelikt gewürdigt. Die weiteren 27 Fälle vom 29.11.2016, in denen der Angeklagte die Zubereitungen eigenhändig herstellte, hat die Kammer als tatmehrheitlich begangen angesehen.
70Tatkomplex II:
71Abrechnen unterdosierter Zubereitungen gegenüber gesetzlichen Krankenkas-
72sen
73Im Tatzeitraum rechnete der Angeklagte die unterdosierten und damit wirtschaftlich wertlosen Zubereitungen gegenüber den gesetzlichen Krankenkassen - vermittelt
7413
75durch einen Abrechnungsdienstleister - und anderen öffentlich-rechtlichen Kostenträgern monatsweise ab. Bei den dort zuständigen Mitarbeitern erzeugte er die unzutreffende Vorstellung, ordnungsgemäße Leistungen erbracht zu haben und erhielt daher entsprechende Vergütungen. Ihm kam es gerade darauf an, sich einen Vermögensvorteil zu verschaffen, von dem er wusste, dass er darauf keinen Anspruch hatte.
76Der Angeklagte hat sich auch insoweit nicht näher eingelassen. Die Feststellungen beruhen auf der Beweisaufnahme im Übrigen.
77Rechtlich hat die Kammer den Angeklagten insoweit wegen Betruges in 59 Fällen (59 monatliche Abrechnungen Januar 2012 bis November 2016) verurteilt. Da es bei der Abrechnung für November aufgrund des eingeleiteten Ermittlungsverfahrens nicht mehr zu einer Auszahlung kam, verblieb es insoweit beim Versuch.
7814
79I. Feststellungen zum Lebenslauf und zu den persönlichen und wirtschaft-
80
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() lichen Verhältnissen
lichen Verhältnissen
18
82
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() Der Angeklagte ist nicht vorbestraft. Im Jahr 2013 führte die Staatsanwaltschaft Essen gegen ihn ein Strafverfahren wegen des Verdachts, er habe Arzneimittelzubereitungen unterdosiert. Das Verfahren wurde gemäß § 170 Abs. 2 StPO eingestellt.
Der Angeklagte ist nicht vorbestraft. Im Jahr 2013 führte die Staatsanwaltschaft Essen gegen ihn ein Strafverfahren wegen des Verdachts, er habe Arzneimittelzubereitungen unterdosiert. Das Verfahren wurde gemäß § 170 Abs. 2 StPO eingestellt.
19
84II. Feststellungen zum Tatgeschehen
851. Der Laborbetrieb der Apotheke in Bottrop
86Der Angeklagte war seit dem Jahr 2000 durchgängig als Apotheker in der Apo-
87theke in Bottrop tätig, zunächst als angestellter Apotheker, ab dem Beginn des Pachtvertrages zum 01.11.2009 auch als verantwortlicher Leiter der Apotheke. Der Angeklagte hatte damit zwei Aufgaben- und Arbeitsbereiche: Er leitete den herkömmlichen Betrieb der Apotheke. Dies umfasste namentlich den Handverkauf von Fertigarzneimitteln im Verkaufsraum im Erdgeschoss, die Lieferung von Arzneimitteln und medizinischem Bedarf etwa an Altenheime, die Herstellung nicht-parenteraler Arzneimittel, z. B. Salben und Crèmes sowie eine Abteilung zum Verkauf und zur Anwendung von Kosmetika. Der zweite Bereich bestand in der Leitung des Reinraumlabors; hier war der Angeklagte auch eigenhändig mit der Herstellung von Arzneimittelzubereitungen befasst.
88a) Reguläre Abläufe des Apotheken- und Reinraumlaborbetriebs
89Der Angeklagte hatte im Jahr 2001 in der Apotheke ein Reinraumlabor eingerichtet und seit diesem Zeitpunkt betrieben, das zum Herstellen patientenindividueller paren-teraler Arzneimittelzubereitungen für die Krebstherapie diente. Dieses Reinraumlabor wurde im Sprachgebrauch der Apothekenmitarbeiter „Zytostatika-Labor“ oder abgekürzt „Zyto-Labor“ genannt, obwohl dort nicht ausschließlich so genannte Zytostatika im streng pharmazeutischen Sinne hergestellt wurden (siehe dazu näher sogleich).
90(1) Begriff der parenteralen Arzneimittelzubereitungen
91Parenterale Arzneimittel, wie sie in der Apotheke hergestellt wurden, sind sterile
92Zubereitungen, die unter Umgehung des Verdauungstraktes in den menschlichen Körper eingebracht werden, namentlich durch Injektion oder Infusion. In der Krebstherapie werden sie oftmals patientenindividuell hergestellt. Die Verordnung des behandelnden Arztes orientiert sich für jeden einzelnen Patienten u. a. an dessen Körpervolumen, die Wirkstoffmenge berechnet sich dabei nach der Größe und dem Gewicht des Patienten.
9320
94Anhand der Angaben in der ärztlichen Verordnung stellt ein Apotheker die Arzneimittelzubereitung für den jeweiligen Patienten individuell her, typischerweise indem der Wirkstoff in eine Trägersubstanz (z. B. eine NaCl- oder Glucose-Lösung) eingebracht wird.
95Die verfahrensgegenständlichen parenteralen Arzneimittelzubereitungen für die Krebstherapie betreffen die Wirkstoffgruppen der Zytostatika und der monoklonalen Antikörper: Zytostatika sind natürliche oder synthetische Wirkstoffe, die das Zellwachs-tum oder die Zellteilung hemmen. Monoklonale Antikörper sind Wirkstoffe, die sich spezifisch an eine molekulare Zielstruktur im Organismus binden; sie sind erkennbar an ihrer Namensendung „-mab“ (für „monoclonal antibody“).
96Soweit nicht ausdrücklich anders angegeben, verwendet die Kammer in diesem Urteil nicht die von den Arzneimittelherstellern verwendeten Handelsnamen der Wirkstoffe, sondern die so genannten internationalen Freinamen, die von der Weltgesundheitsorganisation vergeben werden.
97Für Zytostatika-Zubereitungen verwendete der Angeklagte insbesondere folgende Wirkstoffe:
98- Azacitidine
99- Aflibercept
100- Bendamustin
101- Bortezomib
102- Cabazitaxel
103- Carfilzomib
104- Cyclophosphamid
105- Decitabin
106- Doxorubicin
107- Eribulin
108- Fluorouracil
109- Myocet
110- Nab-Paclitaxel
11121
112- Pemetrexed
113- Temsirolimus
114- Topotecan
115- Trabectedin
116- Treosulfan
117- Vinblastin
118- Vinflunin
119- Vinorelbin
120Bei der Herstellung von Zubereitungen mit monoklonalen Antikörpern verwandte der
121Angeklagte folgende Wirkstoffe:
122- Bevacizumab
123- Brentuximab
124- Cetuximab
125- Daratumumab
126- Denosumab
127- Nivolumab
128- Obinutuzumab
129- Ofatumumab
130- Panitumumab
131- Pembrolizumab
132- Pertuzumab
133- Ramucirumab
134- Rituximab
135- Trastuzumab
136- Trastuzumab Emtansine
13722
138Die ärztliche Behandlung mit den in der Apotheke verarbeiteten onkologischen
139Wirkstoffen konnte verschiedene Ziele verfolgen: Erstens die vollständige Heilung der Krebserkrankung und - nach Ausheilung - die Senkung des Rückfallrisikos. Insoweit spricht man von einem kurativen Behandlungsziel. In Fällen, in denen keine realistische Aussicht auf Ausheilung bestand, diente - zweitens - die onkologische Behandlung dazu, Beschwerden zu lindern, namentlich die Lebensqualität zu verbessern und die verbleibende Lebenszeit zu verlängern. Hier spricht man vom palliativen Behandlungsziel.
140Sowohl zytostatische Wirkstoffe als auch monoklonale Antikörper werden je nach Wirkstoff und Art der Erkrankung kurativ und palliativ eingesetzt. Sehr häufig verschrieben Ärzte zudem eine Kombination verschiedener Wirkstoffe. Eine Zubereitung enthielt aber stets nur einen Wirkstoff; im Falle einer Kombination wurden dem Patienten dann entsprechend mehrere Zubereitungen verabreicht.
141Die verschriebenen Wirkstoffe sind teilweise mit starken, teils irreversiblen Nebenwirkungen verbunden, etwa mit Haarausfall, starker Übelkeit, Durchfall, Schäden der inneren Organe oder Lähmungen durch Nervenschäden. Um diese Nebenwirkungen zu unterdrücken oder zu lindern, war die Verabreichung der Zubereitungen teils mit so genannter Begleitmedikation verbunden.
142Die onkologische Behandlung mit den Zubereitungen aus der Apotheke des Angeklagten erfolgte in aller Regel zyklisch. Damit ist gemeint, dass ein Patient über einen gewissen Zeitraum in regelmäßigen Abständen (z. B. wöchentlich) eine Arzneimittelgabe erhält.
143Insbesondere bei monoklonalen Antikörpern handelt es sich teils um sehr hochpreisige Arzneimittel. Eine einzige Zubereitung kann durchaus mehrere tausend Euro kosten.
144(2) Herstellungsprozess in der Apotheke
145![]() Die Herstellung der parenteralen Arzneimittelzubereitungen lief im Reinraumlabor der Apotheke während des gesamten Tatzeitraums wie folgt ab:
Die Herstellung der parenteralen Arzneimittelzubereitungen lief im Reinraumlabor der Apotheke während des gesamten Tatzeitraums wie folgt ab:
Ärztliche Therapieprotokolle
14723
148Für jeden Patienten, für den Zubereitungen herzustellen waren, erhielt die Apo-
149theke vor Beginn des Behandlungszyklus vom behandelnden Arzt eine entsprechende schriftliche Anforderung, nämlich ein so genanntes Therapieprotokoll, meist übersandt per Telefax. In diesem Protokoll waren die einzelnen Zubereitungen über den Zyklus der Behandlung nach vorgesehenen Behandlungsdaten, jeweils vorgesehener Wirkstoffmenge und Form der Medikation niedergelegt. Außerdem enthielt das Therapieprotokoll Informationen über den Patienten. Die zugehörigen ärztlichen Arzneimittelverordnungen („Rezepte“) gingen entwe-
150der mit dem Therapieprotokoll oder zu einem späteren Zeitpunkt in der Apothe-ke ein.
151Verarbeitung in der EDV der Apotheke
152Mitarbeiter des Reinraumlabors erfassten die angeforderten Zubereitungen anhand der Therapieprotokolle sodann in dem EDV-Programm "Zenzy", einer Spezial-Software zur Organisation und Dokumentation der Zubereitungsherstellung. Bei dieser Gelegenheit überprüften die Mitarbeiter die Angaben in den Therapieprotokollen auf Plau-sibilität.
153Das EDV-Programm Zenzy diente in der Apotheke somit der
154Erfassung jeder einzelnen parenteralen Arzneimittelzubereitung, die hergestellt, dokumentiert und ausgeliefert wurde. Dabei generierte das Programm für jede
155Zubereitung eine individuelle elfstellige Herstellungskennziffer. DieHerstellungskennziffer folgte dem Muster „Jahr - Monat - Tag“ und einer dreistelligen fortlaufenden Nummerierung, beginnend mit 001. Das Datum bezog sich auf den Tag der Eintragung, der nicht notwendig mit dem (späteren) Tag der Herstellung identisch war. So lautete beispielsweise die Herstellungs-
156![]() kennziffer für die Zubereitung aus Tat 61.864 der Anklage (Patientin"20161125157". Diese Zubereitung wurde am 25.11.2016 in das EDV-Programm Zenzy eingetragen.
kennziffer für die Zubereitung aus Tat 61.864 der Anklage (Patientin"20161125157". Diese Zubereitung wurde am 25.11.2016 in das EDV-Programm Zenzy eingetragen.
Auf Grundlage der Eintragungen im EDV-Programm Zenzy druckten die Mitarbeiter des Reinraumlabors täglich Etiketten mit selbstklebender Rückseite für die aktuell herzustellenden Zubereitungen aus. Aus dem einzelnen Etikett ergaben sich jeweils der Name des Patienten mit Geburtsdatum, die Herstellungskennziffer, der zu verwendende Wirkstoff, die einzubringende Wirkstoffmenge, die zu ver-
15824
159wendende Trägerlösung, der Name des verschreibenden Arztes sowie Angaben zur Haltbarkeit und Lagerung. Aus den Angaben der Etiketten war hingegen nicht ersichtlich, an welcher Erkrankung der Patient litt, für den die Zubereitung erstellt wurde, und in welchem Stadium sich die Erkrankung befand.
160Für jede Zubereitung wurden zwei identische Etiketten ausgedruckt: Während das eine Etikett mit den Therapie- und Herstellungsprotokollen dauerhaft in den Büroräumen
161der Apotheke und später in einem Archiv auf dem Dachboden verblieb, wurdedas andere Etikett in das Reinraumlabor gebracht. Dort diente es als (einzige) Anweisung für die Herstellung der betreffenden Zubereitung und wurde nach dem Fertigstellen der Zubereitung auf die Hülle bzw. Verpackung der einzelnen Zubereitung (also beispielsweise auf den Infusionsbeutel) aufgeklebt.
162Herstellung der Zubereitungen im Reinraumlabor
163Der Angeklagte und die angestellten Mitarbeiter des Reinraumlabors stellten sodann anhand der bereitliegenden Etiketten die Arzneimittelzubereitungen her. Vor dem Betreten des Reinraumlabors durch eine Schleuse hatten alle Benutzer Schutzkleidung anzulegen, bestehend aus einem Schutzanzug, Mundschutz, Kopfbedeckung, Handschuhen und Überziehern für die Schuhe. Die Schutzkleidung diente einerseits dazu, die erforderliche Sterilität der Zubereitungen zu gewährleisten. Andererseits diente sie auch dem Schutz der Mitarbeiter selbst, da die verwendeten Wirkstoffe hochgiftig waren. Das Herstellen als solches geschah auf einer besonderen Werkbank. Diese Werkbank war - mit Ausnahme einer Arbeitsöffnung an der Vorderseite - rundum verglast und verfügte aus Sicherheitsgründen über einen Abzug, der flüchtige Stoffe ableiten sollte. Während die angestellten Mitarbeiter stets vorschriftsmäßig Schutzkleidung anlegten, betrat der Angeklagte das Reinraumlabor häufig in Straßenkleidung und arbeitete ohne Schutzkleidung.
164Die Mitarbeiter des Reinraumlabors (mit Ausnahme des Angeklagten) hielten sich beim Herstellen der Zubereitungen in der Regel an das so genannte „Vier-Augen-Prinzip“, indem jeweils zwei Personen gemeinsam an einer Zubereitung arbeiteten, und zwar in der Form, dass ein Mitarbeiter den Wirkstoff in der benötigten Menge anreichte und der andere Mitarbeiter den Wirkstoff in die Trägerlösung einbrachte. Auf diese Weise sollte die ordnungsgemäße Beschaffenheit der Zubereitungen sichergestellt werden.
16525
166Der Angeklagte selbst hingegen beachtete dieses „Vier-Augen-Prinzip“ nicht. Weder zog er einen anderen Mitarbeiter für die Herstellung hinzu, noch waren überhaupt andere Mitarbeiter im Reinraumlabor anwesend, wenn er produzierte. Der Angeklagte arbeitete stets völlig allein und unbeobachtet.
167Beim Herstellen waren die Wirkstoffe, die als Pulver oder in flüssiger Form angeliefert wurden, in eine Trägerlösung einzubringen. Teils war der Wirkstoff zuvor in Wasser aufzulösen oder mit anderen Substanzen anzumischen. Behältnisse der hergestellten Zubereitungen waren Infusionsbeutel, Spritzen oder so genannte Elastomer-Pumpen, die über einen Zeitraum von mehreren Stunden oder Tagen den Wirkstoff sukzessive abgeben. Der herstellende Mitarbeiter klebte das Etikett auf das Behältnis der Zube-
168reitung auf. Die Zubereitungen wurden sodann für die Fahrer der Apotheke zumtäglichen Abholen und Ausliefern bereitgestellt. Eine permanente Kühlung war nur bei einem Teil der Zubereitungen erforderlich. Die Herstellung der Zubereitungen erfolgte in manchen Fällen - je nach der chemischen Stabilität des enthaltenen Wirkstoffs - schon mehrere Tage vor dem Datum der Auslieferung.
169Dokumentation der Herstellung
170Die Mitarbeiter des Reinraumlabors erstellten für jede Zubereitung ein Herstellungsprotokoll (zu unterscheiden von den oben genannten Therapieprotokollen). Dabei handelte es sich um schriftliches Dokument, das aus dem EDV-Programm „Zenzy“ mit den dort hinterlegten Daten für die jeweilige Zubereitung generiert wurde. Es enthielt vorgedruckte Elemente und Raum, der für handschriftliche Eintragungen vorgesehen war, die nach dem Ausdruck erfolgten.
171Vorgedruckt waren u. a. die Herstellungskennziffer, der Name und das Geburtsdatum des Patienten und der verwendeten Wirkstoff nebst Mengenangaben und eine Beschreibung des Herstellungsvorgangs, beispielsweise „1. Desinfektion der Stopfen der Medikamente mit Isopropanol, 2. Zuspritzen des Wirkstoffes“ usw.
172Weiter folgte der Punkt „Herstellungsprotokoll auf Richtigkeit und Fehlerfreiheit überprüft“. Hier waren handschriftlich Datum und Namenszeichen des Apothekers einzutragen. Unter dem folgenden vorgedruckten Punkt „Dokumentation der Zubereitung“ war zunächst die Eintragung der Kostenstelle vorgesehen. Weiter folgte der Punkt „hergestellt von“ mit der Angabe von Namenskürzeln, die zu markieren (einzukreisen)
17326
174waren. Zuletzt waren dies die sieben Namenskürzel , `. Das
175Namenskürzel stand für den Angeklagten für
176, • für , für , • für •
177für und. für
178Weiter folgte eine vorgedruckte Rubrik „eingesetzte Medikamente", wo Wirkstoff und Trägerlösung angegeben waren. Hier waren durch Ankreuzen vorgedruckter Auswahlmöglichkeiten ergänzende Angaben möglich. Weiter folgte der Punkt „Endkontrolle" mit acht verschiedenen Kontroll-ltems (beispielsweise „Wahl des richtigen Behältnis-ses") mit der Antwortmöglichkeit „entspricht ja/nein". Hier waren bereits „Häkchen" standardmäßig unter „ja" vorgedruckt. Schließlich folgte die Zeile „Freigabe" mit der Möglichkeit der Angabe des Namenszeichens des Apothekers und des Datums.
179Auf das ausgefüllte Herstellungsprotokollformular klebten die Mitarbeiter des Reinraumlabors schließlich den jeweiligen zweiten Etikett-Ausdruck aus dem EDV-Programm Zenzy.
180Das Programm Zenzy enthielt auch eine Funktion, die für die Herstellung der Zubereitungen verwendeten Wirkstofflieferungen zu erfassen. Diese Funktion wurde von den Mitarbeitern des Reinraumlabors auch genutzt. Jedoch kam es in dem Programm oftmals automatisiert zu Minusbeständen einzelner Wirkstoffe, weil mehr Wirkstoff zur Verwendung ausgebucht wurde, als an Lieferungen einbucht worden war. Neben dem Programm Zenzy gab es das Warenwirtschaftsprogramm Prokas für die gesamte Apotheke, in das alle Arzneimittellieferungen, nicht nur diejenigen für das Reinraumlabor, zu erfassen waren. Eine Schnittstelle zwischen den beiden Programmen existierte nicht, so dass die Wirkstoffe für die Zubereitungen manuell in beiden Programmen erfasst werden mussten.
181Auslieferung der Arzneimittelzubereitungen
182Die im Reinraumlabor hergestellten Arzneimittelzubereitungen wurden von den Labormitarbeitern in einem Vorraum des Labors für die tägliche morgendliche Abholung und den Transport zu den behandelnden Ärzten bereitgestellt. Dabei packten die Mitarbeiter die Zubereitungen in Transportkoffer, geordnet nach den jeweiligen Empfängern. Dies geschah in der Regel am späten Nachmittag des Vortages, wobei die Koffer am
18327
184Morgen der Abholung gegebenenfalls durch kurzfristig hergestellte Zubereitungen er-
185gänzend bestückt wurden. Die bei der Apotheke des Angeklagten angestelltenFahrer holten die Transportkoffer gegen 07:00 Uhr bis 07:30 Uhr aus dem Vorraum des Reinraumlabors ab und transportierten sie sodann mit Lieferwagen zu den behandelnden Ärzten. Belieferte onkologische Arztpraxen und Krankenhäuser befanden sich u. a. in Bottrop, Dorsten, Düsseldorf, Bochum, Wesel und Oberhausen. Die Fahrer waren allerdings nicht berechtigt, die bereitgestellten Koffer auf eigene Veranlassung aus dem Vorraum des Labors mitzunehmen. Vielmehr bedurfte es allmorgendlich einer ausdrücklichen mündlichen Freigabe durch den Angeklagten oder - im Fall seiner gelegentlichen Abwesenheit - durch einen von ihm bestimmten Mitarbeiter, zuletzt , gegenüber den Fahrern. Dieser Freigabe ging eine Prüfung durch den Angeklagten bzw. den Mitarbeiter auf Vollständigkeit der zu liefernden Zubereitungen voraus. Diese Handhabung wurde ausnahmslos eingehalten.
186![]()
![]() Sofern im Laufe des Tages Nachbestellungen noch für denselben Tag erfolgten, wurden diese nach Rückkehr der Fahrer von ihrer ersten Tour ausgeliefert.
Sofern im Laufe des Tages Nachbestellungen noch für denselben Tag erfolgten, wurden diese nach Rückkehr der Fahrer von ihrer ersten Tour ausgeliefert.
(3) Betrieb des Reinraumlabors, Mitarbeiter, Stellung des Angeklagten Räumliche Situation
188Das Reinraumlabor der Apotheke richtete der Angeklagte zunächst im ersten
189Obergeschoss des Apothekengebäudes in der 32 in Bottrop ein. Es han-
190delte sich um einen relativ kleinen Raum, der über eine Schleuse zugänglich war und in dem sich die genannte Werkbank mit Abzug befand. In diesem Reinraumlabor stellten der Angeklagte und seine Mitarbeiter bis etwa Mitte Januar 2016 die Arzneimittelzubereitungen her, die Gegenstand dieses Verfahrens sind.
191![]() Im Jahr 2016 zog das Reinraumlabor in neue Räume im Keller des Hauses 37, das sich auf der anderen Straßenseite gegenüber dem Apothekengebäude befindet. Auch hier war das Labor über eine Schleuse zu betreten; es waren jetzt zwei Werkbänke mit Abluftvorrichtungen vorhanden. Die neuen Räume waren deutlich größer und mit modernster Technik ausgestattet.
Im Jahr 2016 zog das Reinraumlabor in neue Räume im Keller des Hauses 37, das sich auf der anderen Straßenseite gegenüber dem Apothekengebäude befindet. Auch hier war das Labor über eine Schleuse zu betreten; es waren jetzt zwei Werkbänke mit Abluftvorrichtungen vorhanden. Die neuen Räume waren deutlich größer und mit modernster Technik ausgestattet.
Das Haus 37 stand ebenfalls im Eigentum des Angeklagten. Er hatte es
193erworben und sanieren lassen. Neben dem Labor vermietete der Angeklagte Räume
19428
195an Arztpraxen, unter anderem an die onkologische Praxis der Ärzte Dr. und Dr.
196![]() mit der der Angeklagte eng zusammenarbeitete und die einer der Hauptabnehmer der Arzneimittelzubereitungen war.
mit der der Angeklagte eng zusammenarbeitete und die einer der Hauptabnehmer der Arzneimittelzubereitungen war.
Leitung des Reinraumlabors durch den Angeklagten
198Der Angeklagte leitete das Reinraumlabor seit den Anfängen im Jahr 2001 und während des gesamten Tatzeitraums persönlich. Alle wesentlichen Entscheidungen, die das Labor betrafen, lagen in seinem Verantwortungsbereich und wurden auch tatsächlich von ihm getroffen:
199Bereits die Entscheidung, patientenindividuelle Arzneimittelzubereitungen für die Krebstherapie herzustellen und das Reinraumlabor einzurichten, ging allein auf den Angeklagten zurück, der sich in seiner Bundeswehrzeit mit diesem Tätigkeitsfeld vertraut gemacht hatte (siehe oben). Er allein war (damals noch als bei seiner Mutter
200angestellter Apotheker) damit befasst, das Reinraumlabor im Haus 32 zuplanen. Es wurde nach seinen Vorgaben eingerichtet und in Betrieb genommen. Das Gleiche galt für den Umzug des Reinraumlabors im Januar 2016, den der Angeklagte - inzwischen als Alleininhaber der Apotheke - veranlasste und durchführte. Hier war der Angeklagte insbesondere alleiniger Ansprechpartner für Bauunternehmen, Handwerker, sonstige Vertragspartner und die Aufsichtsbehörde.
201Ferner lagen alle wesentlichen Entscheidungen im Zusammenhang mit dem Betrieb des Reinraumlabors im Verantwortungsbereich des Angeklagten und wurden auch tatsächlich von ihm getroffen: So entschied der Angeklagte, welche Mitarbeiter der Apotheke im Reinraumlabor arbeiteten. Er entschied selbständig über die Einstellung neuer Mitarbeiter. Letzteres galt bereits, als er formal noch nicht Inhaber der Apotheke war: So ließ er während seines Krankenhausaufenthalts Ende 2008 den später einge-
202stellten Apotheker E zu einem Bewerbungsgespräch ins Krankenhaus fahren, weiler das Gespräch persönlich führen und die Entscheidung über die Einstellung selbst treffen wollte.
203Der Angeklagte leitete und kontrollierte auch den täglichen Betrieb des Reinraumla-bors. Er machte den übrigen Mitarbeitern Vorgaben zur Arbeitszeit und Arbeitsweise und entschied über ihre Aufgabenbereiche. Durch seine tägliche Anwesenheit im La-
20429
205bor (siehe dazu sogleich) und seine überragende Sachkenntnis als erfahrener onkolo-gischer Fachapotheker mit betriebswirtschaftlicher Ausbildung hatte er stets den Überblick über alle Einzelheiten des Laborbetriebs.
206Tätigkeit des Angeklagten im Alltagsgeschäft des Reinraumlabors
207Der Angeklagte war seit den Anfängen des Reinraumlabors und während des gesamten Tatzeitraums intensiv mit dem Alltagsgeschäft des Labors befasst. Er allein war für die Beschaffung der Wirkstoffe zuständig, die für die im Reinraumlabor hergestellten parenteralen Arzneimittelzubereitungen verarbeitet wurden. Dabei führte er mit den Lieferanten - Großhändlern oder Herstellern - die Verhandlungen über die Bezugspreise. Die regelmäßig erforderlichen Bestellungen nahm er stets selbst vor; in Einzelfällen wies er Mitarbeiter zu Bestellungen für das Reinraumlabor ausdrücklich an. So-
208weit andere Mitarbeiter der Apotheke auf eigene Initiative Arzneimittel bestellten,handelte es sich dabei um Bestellungen von Fertigarzneimitteln für den allgemeinen Handverkauf der Apotheke oder um Wirkstoffe und Zutaten von Arzneimitteln, die im gewöhnlichen Apothekenbetrieb außerhalb des Reinraumlabors hergestellt und verkauft wurden.
209Darüber hinaus stellte der Angeklagte im Reinraumlabor täglich und oft auch am Wochenende eigenhändig Arzneimittelzubereitungen her, wobei er - wie oben näher geschildert - stets allein arbeitete. Welche Zubereitungen er herstellte, entschied er selbst, indem er sich die entsprechenden Etiketten für die Herstellung heraussuchte. Einen Schwerpunkt legte er dabei auf die hochpreisigen monoklonalen Antikörper, die er vorwiegend, wenn auch nicht ausschließlich herstellte.
210Eine derartige tägliche Laborarbeit ist für einen Apothekenleiter sehr ungewöhnlich und wird in vergleichbaren Apotheken in aller Regel vollständig nachgeordneten Mitarbeitern überlassen, meist den pharmazeutisch-technischen Assistenten.
211Der Angeklagte arbeitete werktäglich in den frühen Morgen- und späten Nachmittagsstunden im Reinraumlabor. Während seiner Arbeitszeiten waren keine anderen Mitarbeiter im Labor anwesend. Regelmäßig in der Zeit von morgens 06:00 bis 06:45 Uhr hielt er sich im Reinraumlabor auf und stellte parenterale Arzneimittelzubereitungen her, die zur Auslieferung am Folgetag bestimmt waren, in Einzelfällen auch zur Aus-
21230
213lieferung am gleichen Tag. In dem morgendlichen Zeitraum stellte er etwa 30 Zubereitungen her. Regelmäßig gab er gegenüber den Fahrern die Zubereitungen zur Auslieferung frei (siehe näher vorstehend).
214Nachmittags hielt sich der Angeklagte häufig ab 16:00 Uhr in dem Reinraumlabor auf und produzierte weitere Zubereitungen, je nach Bedarf und seiner zeitlichen Verfügbarkeit. Schließlich war der Angeklagte auch im Wochenende vielfach im Reinraumla-bor tätig und produzierte Zubereitungen.
215Im Tatzeitraum kam es zu keinen längeren Abwesenheiten des Angeklagten. Weder war er krankheitsbedingt abwesend, noch machte er längere Urlaube: Lediglich unter-
216nahm er einmal eine zweiwöchige Kreuzfahrt mit der Angestellten und ihremLebensgefährten (vgl. oben). Seine übrigen urlaubsbedingten Abwesenheiten beschränkten sich auf ganz vereinzelte Kurzreisen, etwa nach München, Sylt oder Dubai.
217![]() Eine längere gemeinsame Reise mit dem Zeugen nach Südafrika lagvor dem Tatzeitraum, im Jahr 2010.
Eine längere gemeinsame Reise mit dem Zeugen nach Südafrika lagvor dem Tatzeitraum, im Jahr 2010.
Weitere Mitarbeiter des Reinraumlabors
219Im Tatzeitraum und in den Vorjahren hatte das Reinraumlabor weitere Mitarbeiter. Sie besaßen keine eigenen Entscheidungsspielräume. Ihre Arbeit beschränkte sich auf das Herstellen von Zubereitungen außerhalb der Arbeitszeiten des Angeklagten, auf die EDV-mäßige Erfassung der Daten (siehe oben) und die Dokumentation der Zubereitungen.
220Von 2009 bis Juni 2012 waren neben dem Angeklagten weitere approbierte Apotheker in dem Reinraumlabor tätig und mit dem Herstellen parenteraler Arzneimittelzuberei-
221tungen befasst, zunächst der Apotheker E von April 2009 bis September 2010,
222später der Apotheker Dr. M von Januar bis Juni 2012. Nach dem Ausscheiden Dr.
223M s war neben dem Angeklagten kein Apotheker mehr in dem Reinraumlabor tätig.
224Zwar beschäftigte der Angeklagte bis zuletzt mehrere angestellte Apotheker (darunter seine Eltern), jedoch lag deren Aufgabenbereich ausschließlich außerhalb des Labors.
225Neben dem Angeklagten arbeiteten mehrere pharmazeutische-technische Assistenten im Reinraumlabor und stellten dort Arzneimittelzubereitungen her:
226Über den gesamten Tatzeitraum hin waren das die langjährigen Mitarbeiterinnen J
22731
228S und W . Beide PTA hatten lediglich eine Stelle mit halber Arbeits-
229kraft. Ebenfalls langjährig tätig in der Apotheke war die PTA C , ge-
230schiedene U . Sie trat 1999 oder 2000 ihren Dienst an. Während des Tatzeit-raums war sie Mitarbeiterin des Reinraumlabors bis zu ihrem Ausscheiden zum
23101.12.2014. Die PTA H arbeitete seit Oktober oder November2011 im Reinraumlabor, bis zu ihrem Ausscheiden ebenfalls zum 01.12.2014.
232Im Laufe des Jahres 2015 wurde der PTA F dem Reinraumlabor
233zugeordnet. Er war schon einige Zeit mit anderen Aufgaben in der Apotheke betraut gewesen. Im Reinraumlabor kümmerte er sich insbesondere um die Dokumentation und die EDV insgesamt. Nur in Einzelfällen stellte er selbst Zubereitungen her.
234Seit März 2015 war die PTA K im Reinraumlabor tätig. Im weiteren Jahres-
235verlauf stellte der Angeklagte außerdem die PTA G und Sein.
236Sowohl F als auch S , W , G und S waren über das
237Ende des Tatzeitraums am 29.11.2016 in der Apotheke beschäftigt. Indes entließ
238der Angeklagte, vertreten durch seinen Vater, die PTA K Anfang Dezember 2016
239unter einem Vorwand, da er - zutreffend - vermutete, sie habe die strafrechtlichen Ermittlungen gegen ihn mitveranlasst.
240b) Entwicklung der Apotheke
241Mit der Übernahme des Apothekenbetriebes durch den Angeklagten im Jahre 2009
242steigerte sich der jährliche Umsatz der Apotheke erheblich. Die Apothekeerzielte jedenfalls zuletzt einen Jahresumsatz von rund 40 Mio. Euro. Von diesem Umsatz entfiel etwa ein Anteil von bis zu 20 Mio. Euro auf den Betrieb des Reinraumla-bors, mithin auf den Verkauf der parenteralen Arzneimittelzubereitungen.
243Auch die Zahl der in der Apotheke tätigen Mitarbeiter wuchs mit der Übernahme durch den Angeklagten: Zwischen 2009 und 2017 verdoppelte sich ihre Zahl auf zuletzt insgesamt rund 90 Mitarbeiter, geringfügig beschäftigte Fahrer und Reinigungskräfte eingerechnet.
244Neben dem Angeklagten und seinen Eltern waren zuletzt mindestens sechs weitere approbierte Apotheker tätig. Im pharmazeutisch-technischen Bereich gab es mehr als
24532
246dreißig Assistenten, im pharmazeutisch-kaufmännischen Bereich mindestens neun weitere Assistenten.
247Die Apotheke beschäftigte zudem mehrere Reinigungskräfte und rund zwanzig
248Fahrer, einige auf Basis einer geringfügigen Beschäftigung, die mit der Auslieferung der Medikamente betraut waren, insbesondere auch der Auslieferung der parenteralen Arzneimittelzubereitungen an die behandelnden Ärzte
249In der Verwaltung der Apotheke war seit November 2012 der spätere Anzeige-
250erstatter P tätig, zunächst neben seiner bisherigen Stelle stundenweise
251auf Basis einer geringfügigen Beschäftigung. P , der ein Schulfreund des Ange-klagten gewesen war, war ausgebildeter Dipl.-Volkswirt und verfügte über umfangreiche Erfahrungen im Management mittelständischer Unternehmen. Seit August 2014 fungierte er in Vollzeit zu einem Bruttojahreseinkommen von 98.000 Euro als kaufmän-
252nischer Leiter der Apotheke. Er war zuständig für die Buchhaltung, für das Per-sonalwesen (Einstellungen, Entlassungen, Dienstpläne), für die Abrechnung von Privatrezepten (etwa 2.000 – 2.500 Stück monatlich) und das Inkasso. Außerdem unterstützte er den Angeklagten bei der Organisation des Marketings. Die Buchhaltung beschränkte sich allerdings auf das Vorbereiten der Belege für den Steuerberater dessen Büro die Finanz- und Personalbuchhaltung versah. Einblick in die buchhalteri-
253![]() schen Konten und die Bilanzen gewährte der Angeklagte P ebenso wenig wie inmonatliche betriebswirtschaftliche Auswertungen. Lediglich in die betrieblichen Bank-
schen Konten und die Bilanzen gewährte der Angeklagte P ebenso wenig wie inmonatliche betriebswirtschaftliche Auswertungen. Lediglich in die betrieblichen Bank-
konten hatte P Einsicht.
255c) Apothekenaufsicht
256Der Vollzug der Vorschriften des Arzneimittelgesetzes und damit die Apothekenaufsicht - gemäß Art. 83 GG grundsätzlich Sache der Länder - ist in Nordrhein-Westfalen den Amtsapothekern als unterer Gesundheitsbehörde übertragen. Für die kreisfreie Stadt Bottrop, die kreisfreie Stadt Gelsenkirchen und den Kreis Recklinghausen war aufgrund einer interkommunalen Vereinbarung ein gemeinsamer Amtsapotheker zuständig. Die Dienstaufsicht führte der Landrat des Kreises Recklinghausen, die Fachaufsicht die Bezirksregierung Münster. Während des Tatzeitraums fungierte die Zeugin
257![]() L als Amtsapothekerin. In der Apotheke führte sie regelmäßigeangemeldete Inspektionen durch. Insbesondere die Eröffnung der Filialapotheke in
L als Amtsapothekerin. In der Apotheke führte sie regelmäßigeangemeldete Inspektionen durch. Insbesondere die Eröffnung der Filialapotheke in
33
259![]() und die Inbetriebnahme des neuen Reinraumlabors im Jahr 2016 wurden von ihr intensiv begleitet. Obwohl nach dem Wortlaut des § 64 Abs. 3 S. 3 AMG die amtliche Untersuchung von Arzneimittelproben vorgeschrieben ist, zog die Amtsapothekerin während des gesamten Tatzeitraums keine Proben und ließ insbesondere
und die Inbetriebnahme des neuen Reinraumlabors im Jahr 2016 wurden von ihr intensiv begleitet. Obwohl nach dem Wortlaut des § 64 Abs. 3 S. 3 AMG die amtliche Untersuchung von Arzneimittelproben vorgeschrieben ist, zog die Amtsapothekerin während des gesamten Tatzeitraums keine Proben und ließ insbesondere
keine parenteralen Arzneimittelzubereitungen der Apotheke auf ihren Wirkstoff-gehalt untersuchen. Da derartige Untersuchungen der Produkte von zytostatikaher-stellenden Apotheken in Nordrhein-Westfalen allgemein unüblich waren, brauchte der Angeklagte entsprechende Kontrollen nicht zu fürchten.
2612. Die Taten des Angeklagten im Einzelnen
262![]()
![]() Spätestens dem 01.01.2012 entschloss sich der Angeklagte, den Gewinn der Apotheke durch das verordnungswidrige heimliche Einsparen von Wirkstoff zu steigern. Er beabsichtigte, eine Vielzahl der vorgenannten, im Reinraumlabor der Apotheke hergestellten, patientenindividuellen parenteralen Zubereitungen für die Krebstherapie mit weniger Wirkstoff zu versehen, als von den jeweils behandelnden Ärzten verordnet und auf dem jeweiligen Etikett der Zubereitung ausgewiesen war. Gleichzeitig beabsichtigte er, auch diese unterdosierten und damit fehlerhaften und wertlosen Zubereitungen bei den gesetzlichen Krankenkassen, bei den privat versicherten Patienten, bei den Beihilfeberechtigten, bei Selbstzahlern und bei sonstigen privaten oder öffentlich-rechtlichen Kostenträgern abzurechnen. Dies obwohl ihm bewusst war, dass die jeweiligen Kostenträger in Kenntnis des wahren Sachverhalts keine Zahlung geleistet hätten. Er wollte sich damit zur Befriedigung seines privaten Finanzbedarfs erhebliche Vermögensvorteile sichern, von denen er wusste, dass er auf sie keinen Anspruch hatte.
Spätestens dem 01.01.2012 entschloss sich der Angeklagte, den Gewinn der Apotheke durch das verordnungswidrige heimliche Einsparen von Wirkstoff zu steigern. Er beabsichtigte, eine Vielzahl der vorgenannten, im Reinraumlabor der Apotheke hergestellten, patientenindividuellen parenteralen Zubereitungen für die Krebstherapie mit weniger Wirkstoff zu versehen, als von den jeweils behandelnden Ärzten verordnet und auf dem jeweiligen Etikett der Zubereitung ausgewiesen war. Gleichzeitig beabsichtigte er, auch diese unterdosierten und damit fehlerhaften und wertlosen Zubereitungen bei den gesetzlichen Krankenkassen, bei den privat versicherten Patienten, bei den Beihilfeberechtigten, bei Selbstzahlern und bei sonstigen privaten oder öffentlich-rechtlichen Kostenträgern abzurechnen. Dies obwohl ihm bewusst war, dass die jeweiligen Kostenträger in Kenntnis des wahren Sachverhalts keine Zahlung geleistet hätten. Er wollte sich damit zur Befriedigung seines privaten Finanzbedarfs erhebliche Vermögensvorteile sichern, von denen er wusste, dass er auf sie keinen Anspruch hatte.
Diesen Tatplan setzt der Angeklagte in den folgenden fünf Jahren bis einschließlich zum 29.11.2016, dem Tag seiner Festnahme, systematisch um. In einer Vielzahl von Fällen (siehe sogleich) fügte der Angeklagte den von ihm im Reinraumlabor eigenhändig hergestellten Zubereitungen nicht die erforderliche Wirkstoffmenge zu, versah sie jedoch dennoch mit dem vorgefertigen Etikett und ließ sie zu den behandelnden Ärzten bringen. Dort wurden sie in der ganz überwiegenden Mehrzahl der Fälle appliziert. Nur ganz vereinzelt kam es nicht zur Anwendung, so wenn ein Patient nicht zur Behand-
264![]()
![]()


![]()
![]()
![]()
![]()


![]()
35
267Die Zubereitungen hingegen, die vom 01.01.2012 bis zum 28.11.2016 hergestellt und ausgeliefert wurden, konnten selbstverständlich nicht durch Sachverständige untersucht werden. Die Kammer hat hier die Mindestzahl der unterdosierten Zubereitungen bestimmt anhand eines Vergleichs der Einkaufsmenge des jeweiligen Wirkstoffs mit der (vermeintlich) zur Herstellung verwendeten Menge. Diese Mindestzahl beläuft sich auf 14.498. Die Kammer stellt dazu fest, dass diese 14.498 Zubereitungen weniger als 80 % des ärztlich verordneten und auf dem jeweiligen Etikett ausgewiesenen Wirkstoffs enthielten. Siehe dazu sogleich unter (1).
268Die Kammer hat dabei zugunsten des Angeklagten - erstens - angenommen, dass er (bzw. Mitarbeiter auf seine Veranlassung) mit der real vorhandenen Wirkstoffmenge die größtmögliche Zahl ordnungsgemäß dosierter Zubereitungen erstellt hat. Dabei hat sie zugunsten des Angeklagten - zweitens - (nur) zum Zwecke dieser Berechnung angenommen, dass eine Zubereitung bereits dann ordnungsgemäß dosiert ist, wenn sie mindestens 80 % des verschriebenen Wirkstoffs enthält (tatsächlich liegt der Wert bei 90 %, siehe oben). Die Kammer hat sich also die Frage gestellt, wie viele ordnungsgemäß dosierte Zubereitungen (ordnungsgemäß in dem gerade genannten Sinn) mit dem vorhandenen Wirkstoff maximal hätten hergestellt werden können. Die Differenz zwischen der sich aus dieser Rechnung ergebenden Zahl und der Zahl der mit diesem Wirkstoff tatsächlich (vermeintlich) hergestellten Zubereitungen ist die Zahl derjenigen Zubereitungen, für die rechnerisch gar kein Wirkstoff zur Verfügung stand (etwa gleich beim Wirkstoff Bevacizumab 3.006 Zubereitungen). Die Addition dieser Zahlen für alle Wirkstoffe ergibt die genannte Zahl von 14.498.
269Rein rechnerisch enthalten diese 14.498 Zubereitungen also keinen Wirkstoff; anders gesagt: Der Wirkstoffgehalt beläuft sich auf 0 %. Doch kann die Kammer eine solche klare Feststellung nicht treffen. Denn sie weiß selbstverständlich nicht, ob sich unter den Zubereitungen, die vom 01.01.2012 bis zum 28.11.2016 hergestellt und ausgeliefert wurden, tatsächlich auch solche finden, die keinerlei Wirkstoff aufwiesen. Es ist auch vorstellbar, dass sämtliche Zubereitungen eines Wirkstoffs einen gewissen Wirk-stoffgehalt aufwiesen (was freilich dann die Zahl der Taten erhöhen würde). Daher belässt sie es zugunsten des Angeklagten bei der Feststellung, dass diese 14.498 Zubereitungen weniger als 80 % des ärztlich verordneten und auf dem jeweiligen Etikett ausgewiesenen Wirkstoffs enthielten.
27036
271Die Kammer konnte nicht feststellen, dass ein konkreter Patient, dem eine unterdosierte Zubereitung verabreicht wurde, aufgrund der Unterdosierung verstarb oder sich aufgrund der Unterdosierung sein Leben verkürzte oder er in Lebensgefahr geriet.
272(1) Zubereitungen, die bis einschließlich 28.11.2016 hergestellt und ausgeliefert wurden (Taten 1 - 61.863)
27337
274Bevacizumab
275Der Angeklagte und die Mitarbeiter des Reinraumlabors stellten insgesamt 6.760 Arzneimittelzubereitungen mit dem Wirkstoff Bevacizumab her. Davon entfielen 2.317 Zubereitungen auf so genannte „Augenspritzen". Dabei handelte es sich um sehr niedrig dosierte Zubereitungen für die Applikation im Auge zur Behandlung bestimmter Augenkrankheiten, für die Bevacizumab nicht zugelassen ist („Off-Label-Use"). Soweit Zubereitungen mit Bevacizumab diese „Augenspritzen" betrafen, hat die Kammer den Angeklagten aus tatsächlichen Gründen freigesprochen (siehe dazu VIII. 4.).
276Damit verbleiben 4.443 Zubereitungen mit Bevacizumab für die Krebstherapie, die im Folgenden aufgelistet sind. Von diesen 4.443 Zubereitungen stellten der Angeklagte eigenhändig oder in einzelnen Fällen von ihm entsprechend angewiesene Mitarbeiter des Reinraumlabors (mindestens) 3.006 Zubereitungen her, die unterdosiert waren, indem sie weniger als 80 % des ärztlich verordneten und auf dem jeweiligen Etikett ausgewiesenen Wirkstoffs enthielten. Welche der aufgelisteten Zubereitungen dies exakt waren, konnte die Kammer nicht feststellen.
277

![]()
![]()
![]() Anklage Datum Nachname Vorname Geb.-Datum Menge
Anklage Datum Nachname Vorname Geb.-Datum Menge

![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()

![]()



![]()
![]()

![]()
![]()
![]()
![]()


![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()


![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()

![]()
![]()
![]()
198
283Daratumumab
284Der Angeklagte und die Mitarbeiter des Reinraumlabors stellten insgesamt 32 Arzneimittelzubereitungen mit dem Wirkstoff Daratumumab her, die im Folgenden aufgelistet sind. Von diesen Zubereitungen stellten der Angeklagte eigenhändig oder in einzelnen Fällen von ihm entsprechend angewiesene Mitarbeiter des Reinraumlabors (mindestens) eine Zubereitung her, die unterdosiert war, indem sie weniger als 80 % des ärztlich verordneten und auf dem jeweiligen Etikett ausgewiesenen Wirkstoffs enthielt. Welche der aufgelisteten Zubereitungen dies exakt war, konnte die Kammer nicht feststellen.
285Anklage Datum Nachname Vorname Geb.-Datum Menge
286
MEI |
|||||
|
|||||

![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()



![]()
205
290Denosumab
291Der Angeklagte und die Mitarbeiter des Reinraumlabors stellten insgesamt 5.115 Arzneimittelzubereitungen mit dem Wirkstoff Denosumab her, die im Folgenden aufgelistet sind. Von diesen Zubereitungen stellten der Angeklagte eigenhändig oder in einzelnen Fällen von ihm entsprechend angewiesene Mitarbeiter des Reinraumlabors (mindestens) 2.101 Zubereitungen her, die unterdosiert waren, indem sie weniger als 80 % des ärztlich verordneten und auf dem jeweiligen Etikett ausgewiesenen Wirkstoffs enthielten. Welche der aufgelisteten Zubereitungen dies exakt waren, konnte die Kammer nicht feststellen.
292Anklage |
Datum |
Nachname |
Vorname |
Geb.-Datum |
Menge |
|||||
304
294Eribulin
295Der Angeklagte und die Mitarbeiter des Reinraumlabors stellten insgesamt 602 Arzneimittelzubereitungen mit dem Wirkstoff Eribulin her. Davon entfielen 7 Zubereitungen auf so genannte „Studienware“. Dabei handelte sich um Zubereitungen, die im Rahmen von medizinischen Anwendungsstudien hergestellt wurden. Soweit Zubereitungen mit Studienware erstellt wurden, die Kammer den Angeklagten aus tatsächlichen Gründen freigesprochen (siehe unten).
296Damit verbleiben 595 Zubereitungen mit Eribulin, die im Folgenden aufgelistet sind. Von diesen 595 Zubereitungen stellten der Angeklagte eigenhändig oder in einzelnen Fällen von ihm entsprechend angewiesene Mitarbeiter des Reinraumlabors (mindestens) 258 Zubereitungen her, die unterdosiert waren, indem sie weniger als 80 % des ärztlich verordneten und auf dem jeweiligen Etikett ausgewiesenen Wirkstoffs enthielten. Welche der aufgelisteten Zubereitungen dies exakt waren, konnte die Kammer nicht feststellen.
297Anklage Datum Nachname Vorname Geb.-Datum Menge
298
![]()

![]()
![]()
![]()
![]()



![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
335
302Nivolumab
303Der Angeklagte und die Mitarbeiter des Reinraumlabors stellten insgesamt 364 Arzneimittelzubereitungen mit dem Wirkstoff Nivolumab her, die im Folgenden aufgelistet sind. Von diesen Zubereitungen stellten der Angeklagte eigenhändig oder in einzelnen Fällen von ihm entsprechend angewiesene Mitarbeiter des Reinraumlabors (mindestens) 208 Zubereitungen her, die unterdosiert waren, indem sie weniger als 80 % des ärztlich verordneten und auf dem jeweiligen Etikett ausgewiesenen Wirkstoffs enthielten. Welche der aufgelisteten Zubereitungen dies exakt waren, konnte die Kammer nicht feststellen.
304Anklage Datum |
Nachname Vorname Geb.-Datum Menge |
|||||
|
||||||
|
||||||
ffl |
||||||
|
||||||
|
||||||






![]()

![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()

![]()
![]()
![]()
![]()
![]()

![]()




356
310Pembrolizumab
311Der Angeklagte und die Mitarbeiter des Reinraumlabors stellten insgesamt 19 Arzneimittelzubereitungen mit dem Wirkstoff Pembrolizumab her, die im Folgenden aufgelistet sind. Von diesen Zubereitungen stellten der Angeklagte eigenhändig oder in einzelnen Fällen von ihm entsprechend angewiesene Mitarbeiter des Reinraumlabors (mindestens) zwei Zubereitungen her, die unterdosiert waren, indem sie weniger als 80 % des ärztlich verordneten und auf dem jeweiligen Etikett ausgewiesenen Wirkstoffs enthielten. Welche der aufgelisteten Zubereitungen dies exakt waren, konnte die Kammer nicht feststellen.
312Anklage Datum Nachname Vorname Geb.-Datum Menge
313


![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()



![]()
![]()
366
316Pertuzumab
317Der Angeklagte und die Mitarbeiter des Reinraumlabors stellten insgesamt 1.259 Arzneimittelzubereitungen mit dem Wirkstoff Pertuzumab her. Davon entfielen 292 Zubereitungen auf so genannte „Studienware". Dabei handelte sich um Zubereitungen, die im Rahmen von medizinischen Anwendungsstudien hergestellt wurden. Soweit Zubereitungen mit Studienware erstellt wurden, die Kammer den Angeklagten aus tatsächlichen Gründen freigesprochen (siehe unten).
318Damit verbleiben 967 Zubereitungen mit Pertuzumab, die im Folgenden aufgelistet sind. Von diesen 967 Zubereitungen stellten der Angeklagte eigenhändig oder in einzelnen Fällen von ihm entsprechend angewiesene Mitarbeiter des Reinraumlabors (mindestens) 579 Zubereitungen her, die unterdosiert waren, indem sie weniger als 80 °A des ärztlich verordneten und auf dem jeweiligen Etikett ausgewiesenen Wirkstoffs enthielten. Welche der aufgelisteten Zubereitungen dies exakt waren, konnte die Kammer nicht feststellen.
319Anklage I Datum |
Nachname |
Vorname |
Geb.-Datum |
Menge |
|||
385
321
Ramucirumab
323Der Angeklagte und die Mitarbeiter des Reinraumlabors stellten insgesamt 121 Arzneimittelzubereitungen mit dem Wirkstoff Ramucirumab her, die im Folgenden aufgelistet sind. Von diesen Zubereitungen stellten der Angeklagte eigenhändig oder in einzelnen Fällen von ihm entsprechend angewiesene Mitarbeiter des Reinraumlabors (mindestens) 49 Zubereitungen her, die unterdosiert waren, indem sie weniger als 80 % des ärztlich verordneten und auf dem jeweiligen Etikett ausgewiesenen Wirkstoffs enthielten. Welche der aufgelisteten Zubereitungen dies exakt waren, konnte die Kammer nicht feststellen.
324Anklage Datum Nachname Vorname Geb.-Datum Menge
325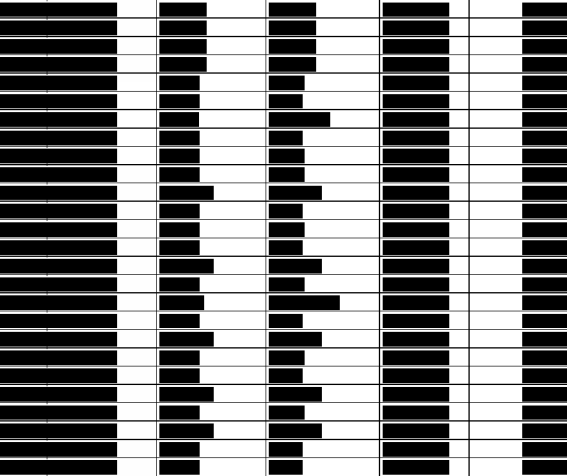

![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()



![]()

![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()



![]()
![]()

![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()


![]()
![]()
![]()
![]()
![]()
![]()

443
330Trastuzumab
331Der Angeklagte und die Mitarbeiter des Reinraumlabors stellten insgesamt 7.536 Arzneimittelzubereitungen mit dem Wirkstoff Trastuzumab her. Davon entfielen 213 Zubereitungen auf so genannte „Studienware“. Dabei handelte sich um Zubereitungen, die im Rahmen von medizinischen Anwendungsstudien hergestellt wurden. Soweit Zubereitungen mit Studienware erstellt wurden, die Kammer den Angeklagten aus tatsächlichen Gründen freigesprochen (siehe unten).
332Damit verbleiben 7.323 Zubereitungen mit Trastuzumab, die im Folgenden aufgelistet sind. Von diesen 7.323 Zubereitungen stellten der Angeklagte eigenhändig oder in einzelnen Fällen von ihm entsprechend angewiesene Mitarbeiter des Reinraumlabors (mindestens) 5.286 Zubereitungen her, die unterdosiert waren, indem sie weniger als 80 % des ärztlich verordneten und auf dem jeweiligen Etikett ausgewiesenen Wirkstoffs enthielten. Welche der aufgelisteten Zubereitungen dies exakt waren, konnte die Kammer nicht feststellen.
333Anklage Datum Nachname Vorname Geb.-Datum Menge
334
![]()
![]()
![]()
![]()
![]()
![]()
![]()

![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()


![]()


![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()

![]()

![]()
![]()


![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()

![]()

![]()
![]()

609
339
Vinflunin
341Für eine Zubereitung mit dem Wirkstoff Vinflunin im Jahr 2012 hat die Kammer keine Unterdosierungen festgestellt (siehe näher unten VIII. 2. k.).
342Der Angeklagte und die Mitarbeiter des Reinraumlabors stellten in den Jahren 2013 bis 2016 insgesamt 59 Arzneimittelzubereitungen mit Vinflunin her, die im Folgenden aufgelistet sind. Von diesen Zubereitungen stellten der Angeklagte eigenhändig oder in einzelnen Fällen von ihm entsprechend angewiesene Mitarbeiter des Reinraumlabors (mindestens) 37 Zubereitungen her, die unterdosiert waren, indem sie weniger als 80 % des ärztlich verordneten und auf dem jeweiligen Etikett ausgewiesenen Wirkstoffs enthielten. Welche der aufgelisteten Zubereitungen dies exakt waren, konnte die Kammer nicht feststellen.
343Anklage Datum Nachname Vorname Geb.-Datum Menge
344
611
346(2) Zubereitungen, die am 29.11.2016 sichergestellt wurden
347Am frühen Morgen des 29.11.2016 stellten Polizeibeamte bei einer Durchsuchung 117 für verschiedene behandelnde Ärzte hergestellte parenterale Arzneimittelzubereitun-
348gen im Vorraum Reinraumlabor in der 37 sicher. Diese 117 Zubereitungenwaren am Vortage (28.11.2016) und/oder zu noch früheren Zeitpunkten hergestellt worden. Ein Teil dieser Zubereitungen befand sich in bereitgestellten Koffern, ein Teil noch in Kühlschränken. Wie üblich waren die Zubereitungen in den Koffern nach den zu beliefernden Ärzten geordnet. Zum Zeitpunkt der Sicherstellung war die übliche Freigabe der Zubereitungen zum Ausliefern durch den Angeklagten oder einen anderen Mitarbeiter des Reinraumlabors noch nicht erfolgt (vgl. näher oben). Die Fahrer waren noch nicht erschienen.
349Von den 117 Zubereitungen waren 66 unterdosiert. Ihre Etiketten wiesen hingegen jeweils unzutreffend die tatsächlich ärztlich verordnete Wirkstoffmenge aus. Bei keiner dieser Zubereitungen konnte die Kammer eine mikrobielle Kontamination feststellen. Die übrigen 51 Zubereitungen [Taten 61.891 sowie 61.931 – 61.980] waren weder unterdosiert noch konnte die Kammer eine mikrobielle Kontamination feststellen; insoweit hat die Kammer den Angeklagten aus tatsächlichen Gründen freigesprochen (siehe unten VIII. 2.).
350Eine Anzahl von 27 unterdosierten Zubereitungen hatte der Angeklagte eigenhändig hergestellt. In den weiteren 39 Fällen der unterdosierten Zubereitungen hatten andere Mitarbeiter des Reinraumlabors die Zubereitung auf Veranlassung des Angeklagten in dieser (unterdosierten) Form hergestellt bzw. konnte nicht geklärt werden, wer die Herstellung vorgenommen hatte.
351Folgende 66 Arzneimittelzubereitungen waren unterdosiert:
352Anklage |
Nr. PEI/ LZG |
Patient |
Wirkstoff |
Mindergehalt |
|
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
613
355 
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Im Einzelnen:
357Tat 61.864 der Anklage
358Der Infusionsbeutel der Patientin mit der Herstellungskennziffer 20161125157, der
359nach der Deklaration des Etiketts einen Gehalt des Wirkstoffs Nivolumab von 282,00 mg in einer 0,9 %-igen NaCl-Trägerlösung aufweisen sollte, enthielt tatsächlich nur 38,0 mg des Wirkstoffs Nivolumab. Dies entspricht einem Wirkstoffmindergehalt von 86,5 %. Der Angeklagte hatte diese Arzneimittelzubereitung eigenhändig hergestellt.
360Tat 61.865 der Anklage
361614
362Der Infusionsbeutel der Patientin mit der Herstellungskennziffer 20161125169,
363der nach der Deklaration des Etiketts einen Gehalt des Wirkstoffs Pertuzumab von 420,00 mg in einer 0,9 %-igen NaCl-Trägerlösung aufweisen sollte, enthielt tatsächlich nur 51,5 mg des Wirkstoffs Pertuzumab, dies entspricht einem Wirkstoffmindergehalt von 87,7 %. Der Angeklagte hatte diese Arzneimittelzubereitung eigenhändig hergestellt.
364Tat 61.866 der Anklage
365Der Infusionsbeutel der Patientin mit der Herstellungskennziffer 20161125178,der nach der Deklaration des Etiketts einen Gehalt des Wirkstoffs Trastuzumab von 370,00 mg in einer 0,9 %-igen NaCl-Trägerlösung aufweisen sollte, enthielt tatsächlich gar keinen Wirkstoff Trastuzumab. Der Infusionsbeutel enthielt stattdessen 45,5 mg des Wirkstoffs Pertuzumab. Der Angeklagte hatte diese Arzneimittelzubereitung eigenhändig hergestellt.
366Tat 61.867 der Anklage
367Der Infusionsbeutel der Patientin mit der Herstellungskennziffer20161125176, der nach der Deklaration des Etiketts einen Gehalt des Wirkstoffs Trastuzumab von 504,00 mg in einer 0,9 %-igen NaCl-Trägerlösung aufweisen sollte, enthielt tatsächlich nur 55,1 mg des Wirkstoffs Trastuzumab, dies entspricht einem Wirkstoffmindergehalt von 89,1 %. Der Angeklagte hatte diese Arzneimittelzubereitung eigenhändig hergestellt.
368Tat 61.868 der Anklage
369Der Infusionsbeutel des Patienten mit der Herstellungskennziffer 20161125138,der nach der Deklaration des Etiketts einen Gehalt des Wirkstoffs Cetuximab von 500,00 mg in einer 0,9 %-igen NaCl-Trägerlösung aufweisen sollte, enthielt tatsächlich 268,1 mg des Wirkstoffs Cetuximab, dies entspricht einem Wirkstoffmindergehalt von 46,4 %. Der Angeklagte hatte diese Arzneimittelzubereitung eigenhändig hergestellt.
370Tat 61.869 der Anklage
371Der Infusionsbeutel der Patientin mit der Herstellungskennziffer20161125177, der nach der Deklaration des Etiketts einen Gehalt des Wirkstoffs Trastuzumab von 456,00 mg in einer 0,9 %-igen NaCl-Trägerlösung aufweisen sollte,
372615
373enthielt tatsächlich 31,6 mg des Wirkstoffs Trastuzumab, dies entspricht einem Wirk-stoffmindergehalt 93,1 %. Der Angeklagte hatte diese Arzneimittelzubereitung eigenhändig hergestellt.
374Tat 61.870 der Anklage
375Der Infusionsbeutel des Patienten mit der Herstellungskennziffer20161128019, der nach der Deklaration des Etiketts einen Gehalt des Wirkstoffs Ni-volumab von 276,00 mg in einer 0,9 %-igen NaCl-Trägerlösung aufweisen sollte, enthielt tatsächlich 44,1 mg des Wirkstoffs Nivolumab, dies entspricht einem Wirkstoff-mindergehalt von 84,0 %. Der Angeklagte hatte diese Arzneimittelzubereitung eigenhändig hergestellt.
376Tat 61.871 der Anklage
377Der Infusionsbeutel des Patienten mit der Herstellungskennziffer20161128023, der nach der Deklaration des Etiketts einen Gehalt des Wirkstoffs Ramucirumab von 600,00 mg in einer 0,9 %-igen NaCl-Trägerlösung aufweisen sollte, enthielt tatsächlich 93,0 mg des Wirkstoffs Ramucirumab, dies entspricht einem Wirk-stoffmindergehalt von 84,5 %. Der Angeklagte hatte diese Arzneimittelzubereitung eigenhändig hergestellt.
378Tat 61.872 der Anklage
379Der Infusionsbeutel der Patientin mit der Herstellungskennziffer20161128004, der nach der Deklaration des Etiketts einen Gehalt des Wirkstoffs Da-ratumumab von 1.025,00 mg in einer 0,9 %-igen NaCl-Trägerlösung aufweisen sollte, enthielt tatsächlich 348,8 mg des Wirkstoffs Daratumumab, dies entspricht einem Wirkstoffmindergehalt von 66,0 %. Der Angeklagte hatte diese Arzneimittelzubereitung eigenhändig hergestellt.
380Tat 61.873 der Anklage
381Der Infusionsbeutel der Patientin mit der Herstellungskennziffer20161128002, der nach der Deklaration des Etiketts einen Gehalt des Wirkstoffs Be-vacizumab von 730,00 mg in einer 0,9 %-igen NaCl-Trägerlösung aufweisen sollte,
382616
383enthielt tatsächlich 25,4 mg des Wirkstoffs Bevacizumab, dies entspricht einem Wirk-stoffmindergehalt von 96,5 %. Der Angeklagte hatte diese Arzneimittelzubereitung eigenhändig hergestellt.
384Tat 61.874 der Anklage
385Der Infusionsbeutel des Patienten mit der Herstellungskennziffer20161128001, der nach der Deklaration des Etiketts einen Gehalt des Wirkstoffs Be-vacizumab von 430,00 mg in einer 0,9 %-igen NaCl-Trägerlösung aufweisen sollte, enthielt tatsächlich 45,3 mg des Wirkstoffs Bevacizumab, dies entspricht einem Wirk-stoffmindergehalt von 89,5 %. Der Angeklagte hatte diese Arzneimittelzubereitung eigenhändig hergestellt.
386Tat 61.875 der Anklage
387Die Injektionsspritze der Patientin mit der Herstellungskennziffer20161125140, die nach der Deklaration des Etiketts einen Gehalt des Wirkstoffs De-nosumab von 120,00 mg aufweisen sollte, enthielt weniger als 0,04 mg des Wirkstoffs Denosumab, dies entspricht einem Wirkstoffmindergehalt von mindestens 99,9 %. Ob die Arzneimittelzubereitung vom Angeklagten eigenhändig oder einem entsprechend angewiesenen Mitarbeiter hergestellt worden war, konnte die Kammer nicht feststellen.
388Tat 61.876 der Anklage
389Der Infusionsbeutel der Patientin mit der Herstellungskennziffer 20161125171,der nach der Deklaration des Etiketts einen Gehalt des Wirkstoffs Trastuzumab von 336,00 mg in einer 0,9 %-igen NaCl-Trägerlösung aufweisen sollte, enthielt tatsächlich keinen Wirkstoff Trastuzumab. Der Infusionsbeutel enthielt stattdessen 95,8 mg des Wirkstoffs Pertuzumab. Der Angeklagte hatte diese Arzneimittelzubereitung eigenhändig hergestellt.
390Tat 61.877 der Anklage
391Der Infusionsbeutel der Patientin mit der Herstellungskennziffer 20161125167,der nach der Deklaration des Etiketts einen Gehalt des Wirkstoffs Pertuzumab von 420,00 mg in einer 0,9 %-igen NaCl-Trägerlösung aufweisen sollte, enthielt tatsächlich
392617
39322,4 mg des Wirkstoffs Pertuzumab, dies entspricht einem Wirkstoffmindergehalt von 94,7 %. Der Angeklagte hatte diese Arzneimittelzubereitung eigenhändig hergestellt.
394Tat 61.878 der Anklage
395Der Infusionsbeutel der Patientin mit der Herstellungskennziffer 20161125133,der nach der Deklaration des Etiketts einen Gehalt des Wirkstoffs Bevacizumab von 1.095,00 mg in einer 0,9 %-igen NaCl-Trägerlösung aufweisen sollte, enthielt tatsächlich 90,1 mg des Wirkstoffs Bevacizumab, dies entspricht einem Wirkstoffmindergehalt von 91,8 %. Der Angeklagte hatte diese Arzneimittelzubereitung eigenhändig hergestellt.
396Tat 61.879 der Anklage
397Der Infusionsbeutel der Patientin mit der Herstellungskennziffer20161125181, der nach der Deklaration des Etiketts einen Gehalt des Wirkstoffs Trastuzumab Emtansine von 201,60 mg in einer 0,9 %-igen NaCl-Trägerlösung aufweisen sollte, enthielt 168,2 mg des Wirkstoffs Trastuzumab Emtansine, dies entspricht einem Wirkstoffmindergehalt von 16,6 %. Der Angeklagte hatte diese Arzneimittelzubereitung eigenhändig hergestellt.
398Tat 61.880 der Anklage
399Der Infusionsbeutel der Patientin mit der Herstellungskennziffer20161125174, der nach der Deklaration des Etiketts einen Gehalt des Wirkstoffs Trastuzumab von 498 mg in einer 0,9 %-igen NaCl-Trägerlösung aufweisen sollte, enthielt 23,2 mg des Wirkstoffs Trastuzumab, dies entspricht einem Wirkstoffmindergehalt von 95,3 %. Der Angeklagte hatte diese Arzneimittelzubereitung eigenhändig hergestellt.
400Tat 61.881 der Anklage
401Der Infusionsbeutel der Patientin mit der Herstellungskennziffer 20161125173,der nach der Deklaration des Etiketts einen Gehalt des Wirkstoffs Trastuzumab von 490 mg in einer 0,9 %-igen NaCl-Trägerlösung aufweisen sollte, enthielt tatsächlich 26,0 mg des Wirkstoffs Trastuzumab, dies entspricht einem Wirkstoffmindergehalt von 94,7 %. Der Angeklagte hatte diese Arzneimittelzubereitung eigenhändig hergestellt.
402618
403Tat 61.882 der Anklage
404Der Infusionsbeutel der Patientin mit der Herstellungskennziffer20161125175, der nach der Deklaration des Etiketts einen Gehalt des Wirkstoffs Trastuzumab von 300,00 mg in einer 0,9 %-igen NaCl-Trägerlösung aufweisen sollte, enthielt tatsächlich gar keinen Wirkstoff Trastuzumab. Der Infusionsbeutel enthielt stattdessen 55,5 mg des Wirkstoffs Pertuzumab. Der Angeklagte hatte diese Arzneimittelzubereitung eigenhändig hergestellt.
405Tat 61.883 der Anklage
406Der Infusionsbeutel der Patientin mit der Herstellungskennziffer20161125168, der nach der Deklaration des Etiketts einen Gehalt des Wirkstoffs Pertuzumab von 420,00 mg in einer 0,9 %-igen NaCl-Trägerlösung aufweisen sollte, enthielt tatsächlich nur 46,0 mg des Wirkstoffs Pertuzumab, dies entspricht einem Wirkstoffmindergehalt von 89,0 %. Der Angeklagte hatte diese Arzneimittelzubereitung eigenhändig hergestellt.
407Tat 61.884 der Anklage
408Der Infusionsbeutel der Patientin mit der Herstellungskennziffer20161128035, der nach der Deklaration des Etiketts einen Gehalt des Wirkstoffs Trastuzumab von 120,00 mg in einer 0,9 %-igen NaCl-Trägerlösung aufweisen sollte, enthielt tatsächlich keinen Wirkstoff Trastuzumab. Der Infusionsbeutel enthält stattdessen 91,0 mg des Wirkstoffs Pertuzumab. Ob die Arzneimittelzubereitung vom Angeklagten eigenhändig oder einem entsprechend angewiesenen Mitarbeiter hergestellt worden war, konnte die Kammer nicht feststellen.
409Tat 61.885 der Anklage
410Der Infusionsbeutel der Patientin mit der Herstellungskennziffer 20161128028,der nach der Deklaration des Etiketts einen Gehalt des Wirkstoffs Bevacizumab von 1.050,00 mg in einer 0,9 %-igen NaCl-Trägerlösung aufweisen sollte, enthielt tatsächlich 302,2 mg des Wirkstoff Bevacizumab, dies entspricht einem Wirkstoffmindergehalt von 71,1 %. Ob die Arzneimittelzubereitung vom Angeklagten eigenhändig oder einem entsprechend angewiesenen Mitarbeiter hergestellt worden war, konnte die Kammer nicht feststellen.
411619
412Tat 61.886 der Anklage
413Der Infusionsbeutel der Patientin mit der Herstellungskennziffer20161128033, der nach der Deklaration des Etiketts einen Gehalt des Wirkstoffs Trastuzumab von 378,00 mg in einer 0,9 %-igen NaCl-Trägerlösung aufweisen sollte, enthielt tatsächlich keinen Wirkstoff Trastuzumab. Der Infusionsbeutel habe stattdessen 289,4 mg des Wirkstoffs Pertuzumab enthalten. Ob die Arzneimittelzubereitung vom Angeklagten eigenhändig oder einem entsprechend angewiesenen Mitarbeiter hergestellt worden war, konnte die Kammer nicht feststellen.
414Tat 61.887 der Anklage
415Der Infusionsbeutel der Patientin mit der Herstellungskennziffer20161128032, der nach der Deklaration des Etiketts einen Gehalt des Wirkstoffs Pertuzumab von 420,00 mg in einer 0,9 %-igen NaCl-Trägerlösung aufweisen sollte, enthielt tatsächlich 36,4 mg des Wirkstoffs Pertuzumab, dies entspricht einem Wirk-stoffmindergehalt von 91,3 %. Ob die Arzneimittelzubereitung vom Angeklagten eigenhändig oder einem entsprechend angewiesenen Mitarbeiter hergestellt worden war, konnte die Kammer nicht feststellen.
416Tat 61.888 der Anklage
417Der Infusionsbeutel der Patientin mit der Herstellungskennziffer20161118104, der nach der Deklaration des Etiketts einen Gehalt des Wirkstoffs Ritu-ximab von 700,00 mg in einer 0,9 %-igen NaCl-Trägerlösung aufweisen sollte, enthielt tatsächlich 495,2 mg, dies entspricht einem Wirkstoffmindergehalt von 29,3 %. Der Angeklagte hatte diese Arzneimittelzubereitung eigenhändig hergestellt.
418Tat 61.889 der Anklage
419Der Infusionsbeutel der Patientin mit der Herstellungskennziffer20161125179, der nach der Deklaration des Etiketts einen Gehalt des Wirkstoffs Trastuzumab von 480,00 mg in einer 0,9 %-igen NaCl-Trägerlösung aufweisen sollte, enthielt tatsächlich keinen Wirkstoff Trastuzumab. Der Infusionsbeutel enthielt nur 41,8 mg des Wirkstoffs Pertuzumab. Der Angeklagte hatte diese Arzneimittelzubereitung eigenhändig hergestellt.
420Tat 61.890 der Anklage
421620
422Der Infusionsbeutel der Patientin mit der Herstellungskennziffer
42320161125170, der nach der Deklaration des Etiketts einen Gehalt des Wirkstoffs Pertuzumab von 420,00 mg in einer 0,9 %-igen NaCl-Trägerlösung aufweisen sollte, enthielt tatsächlich 64,3 mg des Wirkstoffs Pertuzumab, dies entspricht einem Wirk-stoffmindergehalt von 84,7 %. Der Angeklagte hatte diese Arzneimittelzubereitung eigenhändig hergestellt.
424Tat 61.892 der Anklage
425Der Infusionsbeutel der Patientin mit der Herstellungskennziffer20161125172, der nach der Deklaration des Etiketts einen Gehalt des Wirkstoffs Trastuzumab von 414,00 mg in einer 0,9 %-igen NaCl-Trägerlösung aufweisen sollte, enthielt tatsächlich 17,1 mg des Wirkstoffs Trastuzumab, dies entspricht einem Wirk-stoffmindergehalt 95,9 %. Der Angeklagte hatte diese Arzneimittelzubereitung eigenhändig hergestellt.
426Tat 61.893 der Anklage
427Der Infusionsbeutel der Patientin mit der Herstellungskennziffer 20161125159,der nach der Deklaration auf dem Etikett eine Befüllung mit 158 mg des Wirkstoffs Oxaliplatin in einer 5 %-Glucose-Trägerlösung aufweisen sollte, enthielt tatsächlich 96,4 mg des Wirkstoffs Oxaliplatin, dies entspricht einem Wirkstoffmindergehalt von 39,0 %. Der Angeklagte hatte diese Arzneimittelzubereitung eigenhändig hergestellt.
428Tat 61.894 der Anklage
429Der Infusionsbeutel des Patienten M mit der Herstellungskennziffer 20161125158,der nach der Deklaration auf dem Etikett eine Befüllung mit 166 mg des Wirkstoffs Oxaliplatin in einer 5 %-Glucose-Trägerlösung aufweisen sollte, enthielt tatsächlich 48,4 mg des Wirkstoffs Oxaliplatin, dies entspricht einem Wirkstoffmindergehalt von 70,8 %. Der Angeklagte hatte diese Arzneimittelzubereitung eigenhändig hergestellt.
430Tat 61.895 der Anklage
431Der Infusionsbeutel der Patientin mit der Herstellungskennziffer 20161125160,der nach der Deklaration auf dem Etikett eine Befüllung mit 71 mg des Wirkstoffs O-xaliplatin in einer 5 %-Glucose-Trägerlösung aufweisen sollte, enthielt tatsächlich 28,3
432621
433mg des Wirkstoffs Oxaliplatin, dies entspricht einem Wirkstoffmindergehalt von 60,1 %. Der Angeklagte hatte diese Arzneimittelzubereitung eigenhändig hergestellt.
434Tat 61.896 der Anklage
435Der Infusionsbeutel des Patienten mit der Herstellungskennziffer20161125161, der nach der Deklaration auf dem Etikett eine Befüllung mit 98 mg des Wirkstoffs Oxaliplatin in einer 5 %-Glucose-Trägerlösung aufweisen sollte, enthielt tatsächlich 17,9 mg des Wirkstoffs Oxaliplatin, dies entspricht einem Wirkstoffminderge-halt von 81,7 %. Der Angeklagte hatte diese Arzneimittelzubereitung eigenhändig hergestellt.
436Tat 61.897 der Anklage
437Der Infusionsbeutel der Patientin mit der Herstellungskennziffer20161125137, der nach der Deklaration auf dem Etikett eine Befüllung mit 300 mg des Wirkstoffs Carboplatin in einer 5 %-Glucose-Trägerlösung aufweisen sollte, enthielt tatsächlich 143,8 mg des Wirkstoffs Carboplatin, dies entspricht einem Wirkstoffmin-
438dergehalt von 52,1 %. Die Arzneimittelzubereitung war von auf Anwei-sung des Angeklagten hergestellt worden.
439Tat 61.898 der Anklage
440Der Infusionsbeutel des Patienten mit der Herstellungskennziffer 20161125156,der nach der Deklaration des Etiketts 160,00 mg des Wirkstoffs Irinotecan in einer 0,9 %-Glucose-Trägerlösung enthalten sollte, enthielt tatsächlich 42,6 mg des Wirkstoffs Irinotecan, dies entspricht einem Wirkstoffmindergehalt von 73,4 %. Die Arznei-
441mittelzubereitung war von auf Veranlassung des Angeklagten hergestelltworden.
442Tat 61.899 der Anklage
443Der Infusionsbeutel der Patientin mit der Herstellungskennziffer20161128035, der nach der Deklaration auf dem Etikett eine Befüllung mit 4,00 mg des Wirkstoffs Zoledronsäure in einer 0,9 %-igen NaCl-Lösung aufweisen sollte, enthielt tatsächlich keinen Wirkstoff Zoledronsäure. Ob die Arzneimittelzubereitung vom Angeklagten eigenhändig oder einem entsprechend angewiesenen Mitarbeiter hergestellt worden war, konnte die Kammer nicht feststellen.
444622
445Tat 61.900 der Anklage
446Der Infusionsbeutel der Patientin mit der Herstellungskennziffer 20161128036,der nach der Deklaration auf dem Etikett eine Befüllung mit 4,00 mg des Wirkstoffs Zoledronsäure in einer 0,9 %-igen NaCl-Lösung aufweisen sollte, enthielt tatsächlich keinen Wirkstoff Zoledronsäure. Ob die Arzneimittelzubereitung vom Angeklagten eigenhändig oder einem entsprechend angewiesenen Mitarbeiter hergestellt worden war, konnte die Kammer nicht feststellen.
447Tat 61.901 der Anklage
448![]()
 Der Infusionsbeutel des Patienten mit der Herstellungskennziffer20161128024, der nach der Deklaration auf dem Etikett eine Befüllung mit 50,00 mg des Wirkstoffs Vinorelbin in einer 0,9 %-igen NaCl-Lösung aufweisen sollte, enthielt tatsächlich keinen Wirkstoff Vinorelbin. Die Arzneimittelzubereitung war von auf Veranlassung des Angeklagten hergestellt worden.
Der Infusionsbeutel des Patienten mit der Herstellungskennziffer20161128024, der nach der Deklaration auf dem Etikett eine Befüllung mit 50,00 mg des Wirkstoffs Vinorelbin in einer 0,9 %-igen NaCl-Lösung aufweisen sollte, enthielt tatsächlich keinen Wirkstoff Vinorelbin. Die Arzneimittelzubereitung war von auf Veranlassung des Angeklagten hergestellt worden.
Tat 61.902 der Anklage
450Die Spritze der Patientin Buchert mit der Herstellungskennziffer 20161125134, die nach der Deklaration auf dem Etikett eine Befüllung mit 2,10 mg des Wirkstoffs Borte-zomib in einer 0,9 %-igen NaCl-Trägerlösung aufweisen sollte, enthielt 0,32 mg des Wirkstoffs Bortezomib, dies entspricht einem Wirkstoffmindergehalt von 84,9 %. Ob die Arzneimittelzubereitung vom Angeklagten eigenhändig oder einem entsprechend angewiesenen Mitarbeiter hergestellt worden war, konnte die Kammer nicht feststellen.
451Tat 61.903 der Anklage
452Die Spritze der Patientin Sokolowski mit der Herstellungskennziffer 20161125135, die nach der Deklaration auf dem Etikett eine Befüllung mit 2,00 mg des Wirkstoffs Borte-zomib in einer 0,9 %-igen NaCl-Trägerlösung aufweisen sollte, enthielt 1,38 mg des Wirkstoffs Bortezomib, dies entspricht einem Wirkstoffmindergehalt von 31,1 %. Ob die Arzneimittelzubereitung vom Angeklagten eigenhändig oder einem entsprechend angewiesenen Mitarbeiter hergestellt worden war, konnte die Kammer nicht feststellen.
453623
454Tat 61.904 der Anklage
455Der Infusionsbeutel der Patientin mit der Herstellungskennziffer 20161125139,der nach der Deklaration auf dem Etikett eine Befüllung mit 1.020 mg Cyclophospha-mid in einer 0,9 %-igen NaCl-Trägerlösung aufweisen sollte, enthielt tatsächlich 593,7 mg des Wirkstoffs Cyclophosphamid, dies entspricht einem Wirkstoffminderge-
456halt von 41,8 %. Die Arzneimittelzubereitung war von auf Veranlassungdes Angeklagten hergestellt worden.
457Tat 61.905 der Anklage
458![]() Der Infusionsbeutel der Patientin mit der Herstellungskennziffer 20161125142,der nach der Deklaration auf dem Etikett eine Befüllung mit 153 mg des Wirkstoffs Epirubicin in einer Trägerlösung von 5 %-Glucosteril aufweisen sollte, enthielt tatsächlich 94,0 mg des Wirkstoffs Epirubicin, dies entspricht einem Wirkstoffmindergehalt von 38,6 %. Die Arzneimittelzubereitung war von auf Veranlassung desAngeklagten hergestellt worden.
Der Infusionsbeutel der Patientin mit der Herstellungskennziffer 20161125142,der nach der Deklaration auf dem Etikett eine Befüllung mit 153 mg des Wirkstoffs Epirubicin in einer Trägerlösung von 5 %-Glucosteril aufweisen sollte, enthielt tatsächlich 94,0 mg des Wirkstoffs Epirubicin, dies entspricht einem Wirkstoffmindergehalt von 38,6 %. Die Arzneimittelzubereitung war von auf Veranlassung desAngeklagten hergestellt worden.
Tat 61.906 der Anklage
460Der Infusionsbeutel des Patienten mit der Herstellungskennziffer20161128046, der nach der Deklaration auf dem Etikett eine Befüllung mit 2,20 mg Topotecan in 0,9 %-iger NaCl-Trägerlösung aufweisen sollte, enthielt tatsächlich keinen Wirkstoff Topotecan. Ob die Arzneimittelzubereitung vom Angeklagten eigenhändig oder einem entsprechend angewiesenen Mitarbeiter hergestellt worden war, konnte die Kammer nicht feststellen.
461Tat 61.907 der Anklage
462Der Infusionsbeutel des Patienten mit der Herstellungskennziffer 20161128037,der nach der Deklaration auf dem Etikett eine Befüllung mit 115,00 mg des Wirkstoffs Carfilzomib in einer 5 %-Glucose-Trägerlösung aufweisen sollte, enthielt tatsächlich 24,41 mg des Wirkstoffs Carfilzomib, dies entspricht einem Wirkstoffmindergehalt von 79,0 %. Ob die Arzneimittelzubereitung vom Angeklagten eigenhändig oder einem entsprechend angewiesenen Mitarbeiter hergestellt worden war, konnte die Kammer nicht feststellen.
463624
464Tat 61.908 der Anklage
465Der Infusionsbeutel der Patientin mit der Herstellungskennziffer20161128038, der nach der Deklaration auf dem Etikett eine Befüllung mit 45,00 mg des Wirkstoffs Carfilzomib in einer 5 %-Glucose-Trägerlösung aufweisen sollte, enthielt tatsächlich 29,5 mg des Wirkstoffs Carfilzomib, dies entspricht einem Wirkstoff-mindergehalt von 34,4 %. Ob die Arzneimittelzubereitung vom Angeklagten eigenhändig oder einem entsprechend angewiesenen Mitarbeiter hergestellt worden war, konnte die Kammer nicht feststellen.
466Tat 61.909 der Anklage
467Der Infusionsbeutel der Patientin mit der Herstellungskennziffer 20161123101,der nach der Deklaration auf dem Etikett eine Befüllung mit 10,00 mg des Wirkstoffs Vinblastinsulfat in einer 0,9 %-igen NaCl-Lösung aufweisen sollte, enthielt tatsächlich keinen Wirkstoff Vinblastinsulfat. Ob die Arzneimittelzubereitung vom Angeklagten eigenhändig oder einem entsprechend angewiesenen Mitarbeiter hergestellt worden war, konnte die Kammer nicht feststellen.
468Tat 61.910 der Anklage
469Der Infusionsbeutel der Patientin mit der Herstellungskennziffer20161125182, der nach der Deklaration auf dem Etikett eine Befüllung mit 4,00 mg des Wirkstoffs Zoledronsäure in einer 0,9 %-igen NaCl-Lösung aufweisen sollte, enthielt tatsächlich keinen Wirkstoff Zoledronsäure. Ob die Arzneimittelzubereitung vom Angeklagten eigenhändig oder einem entsprechend angewiesenen Mitarbeiter hergestellt worden war, konnte die Kammer nicht feststellen.
470Tat 61.911 der Anklage
471Der Infusionsbeutel der Patientin mit der Herstellungskennziffer20161125115, der nach der Deklaration auf dem Etikett eine Befüllung mit 20,00 mg des Wirkstoffs Dexamethason in einer 0,9 %-igen NaCl--Trägerlösung aufweisen sollte, enthielt tatsächlich 4,08 mg des Wirkstoffs Dexamethason-21-(dihydro-gen)phosphat, dies entspricht einem Wirkstoffmindergehalt von 79,6 %. Ob die Arzneimittelzubereitung vom Angeklagten eigenhändig oder einem entsprechend angewiesenen Mitarbeiter hergestellt worden war, konnte die Kammer nicht feststellen.
472625
473Tat 61.912 der Anklage
474Der Infusionsbeutel der Patientin mit der Herstellungskennziffer20161125141, der nach der Deklaration auf dem Etikett eine Befüllung mit 142,00 mg des Wirkstoffs Doxetacel in einer 0,9 %-igen NaCl--Trägerlösung aufweisen sollte, enthielt tatsächlich 69,3 mg des Wirkstoffs Doxetacel, dies entspricht einem Wirkstoffmin-
475![]() dergehalt von 51,2 %. Die Arzneimittelzubereitung war von auf Veran-lassung des Angeklagten hergestellt worden.
dergehalt von 51,2 %. Die Arzneimittelzubereitung war von auf Veran-lassung des Angeklagten hergestellt worden.
Tat 61.913 der Anklage
477Der Infusionsbeutel der Patientin mit der Herstellungskennziffer20161125166, der nach der Deklaration auf dem Etikett Befüllung mit 136,00 mg des Wirkstoffs Paclitaxel in einer 0,9 %-igen NaCl-Trägerlösung aufweisen sollte, enthielt tatsächlich 96,5 mg des Wirkstoffs Paclitaxel, dies entspricht einem Wirkstoffminder-
478![]() gehalt von 29 %. Die Arzneimittelzubereitung war von auf Veranlassungdes Angeklagten hergestellt worden.
gehalt von 29 %. Die Arzneimittelzubereitung war von auf Veranlassungdes Angeklagten hergestellt worden.
Tat 61.914 der Anklage
480![]() Der Infusionsbeutel der Patientin mit der Herstellungskennziffer 20161125165,der nach der Deklaration auf dem Etikett Befüllung mit 141,00 mg des Wirkstoffs Pacli-taxel in einer 0,9 %-igen NaCl-Trägerlösung aufweisen sollte, enthielt tatsächlich 93,2 mg des Wirkstoffs Paclitaxel, dies entspricht einem Wirkstoffmindergehalt von 33,9 %. Die Arzneimittelzubereitung war von auf Veranlassung des An-geklagten hergestellt worden.
Der Infusionsbeutel der Patientin mit der Herstellungskennziffer 20161125165,der nach der Deklaration auf dem Etikett Befüllung mit 141,00 mg des Wirkstoffs Pacli-taxel in einer 0,9 %-igen NaCl-Trägerlösung aufweisen sollte, enthielt tatsächlich 93,2 mg des Wirkstoffs Paclitaxel, dies entspricht einem Wirkstoffmindergehalt von 33,9 %. Die Arzneimittelzubereitung war von auf Veranlassung des An-geklagten hergestellt worden.
Tat 61.915 der Anklage
482Der Infusionsbeutel der Patientin mit der Herstellungskennziffer20161125117, der nach der Deklaration auf dem Etikett eine Befüllung mit 20,00 mg des Wirkstoffs Dexamethason in einer 0,9 %-igen NaCl--Trägerlösung aufweisen sollte, enthielt tatsächlich 4,63 mg des Wirkstoffs Dexamethason-21-(dihydro-gen)phosphat, dies entspricht einem Wirkstoffmindergehalt von 76,9 %. Ob die Arzneimittelzubereitung vom Angeklagten eigenhändig oder einem entsprechend angewiesenen Mitarbeiter hergestellt worden war, konnte die Kammer nicht feststellen.
483Tat 61.916 der Anklage
484626
485Der Infusionsbeutel der Patientin mit der Herstellungskennziffer 20161125163,
486![]() der nach der Deklaration auf dem Etikett Befüllung mit 130,00 mg des Wirkstoffs Pacli-taxel in einer 0,9 %-igen NaCl-Trägerlösung aufweisen sollte, enthielt tatsächlich 89,5 mg des Wirkstoffs Paclitaxel, dies entspricht einem Wirkstoffmindergehalt von 31,1 %. Die Arzneimittelzubereitung war von auf Veranlassung des An-geklagten hergestellt worden.
der nach der Deklaration auf dem Etikett Befüllung mit 130,00 mg des Wirkstoffs Pacli-taxel in einer 0,9 %-igen NaCl-Trägerlösung aufweisen sollte, enthielt tatsächlich 89,5 mg des Wirkstoffs Paclitaxel, dies entspricht einem Wirkstoffmindergehalt von 31,1 %. Die Arzneimittelzubereitung war von auf Veranlassung des An-geklagten hergestellt worden.
Tat 61.917 der Anklage
488Der Infusionsbeutel des Patienten mit der Herstellungskennziffer 20161125128,der nach der Deklaration auf dem Etikett eine Befüllung mit 390,00 mg des Wirkstoffs Folinsäure in einer 0,9 %-igen NaCl-Trägerlösung aufweisen sollte, enthielt tatsächlich 85,6 mg des Wirkstoffs Folinsäure, dies entspricht einem Wirkstoffmindergehalt von
489![]() 78,1 %. Die Arzneimittelzubereitung war von auf Veranlassung des An-geklagten hergestellt worden.
78,1 %. Die Arzneimittelzubereitung war von auf Veranlassung des An-geklagten hergestellt worden.
Tat 61.918 der Anklage
491Der Infusionsbeutel der Patientin mit der Herstellungskennziffer20161125126, der nach der Deklaration auf dem Etikett eine Befüllung mit 400,00 mg des Wirkstoffs Folinsäure in einer 0,9 %-igen NaCl-Trägerlösung aufweisen sollte, enthielt tatsächlich 144,9 mg des Wirkstoffs Folinsäure, dies entspricht einem Wirkstoff-
492![]() mindergehalt von 63,8 %. Die Arzneimittelzubereitung war von auf Ver-anlassung des Angeklagten hergestellt worden.
mindergehalt von 63,8 %. Die Arzneimittelzubereitung war von auf Ver-anlassung des Angeklagten hergestellt worden.
Tat 61.919 der Anklage
494Der Infusionsbeutel der Patientin mit der Herstellungskennziffer 20161125130,der nach der Deklaration auf dem Etikett eine Befüllung mit 710,00 mg des Wirkstoffs Folinsäure in einer 0,9 %-igen NaCl-Trägerlösung aufweisen sollte, enthielt tatsächlich 483,0 mg des Wirkstoffs Folinsäure, dies entspricht einem Wirkstoffmindergehalt von
495![]() 32 %. Die Arzneimittelzubereitung war von auf Veranlassung des Ange-klagten hergestellt worden.
32 %. Die Arzneimittelzubereitung war von auf Veranlassung des Ange-klagten hergestellt worden.
Tat 61.920 der Anklage
497Der Infusionsbeutel der Patientin mit der Herstellungskennziffer20161125127, der nach der Deklaration auf dem Etikett eine Befüllung mit 725,00 mg
498627
499des Wirkstoffs Folinsäure in einer 0,9 %-igen NaCl-Trägerlösung aufweisen sollte, enthielt tatsächlich 121,5 mg des Wirkstoffs Folinsäure, dies entspricht einem Wirkstoff-
500![]() mindergehalt von 83,2 %. Die Arzneimittelzubereitung war von auf Ver-anlassung des Angeklagten hergestellt worden.
mindergehalt von 83,2 %. Die Arzneimittelzubereitung war von auf Ver-anlassung des Angeklagten hergestellt worden.
Tat 61.921 der Anklage
502![]() Der Infusionsbeutel der Patientin mit der Herstellungskennziffer 20161125162,der nach der Deklaration auf dem Etikett eine Befüllung mit 160,00 mg des Wirkstoffs Paclitaxel in einer 0,9 %-igen NaCl-Trägerlösung aufweisen sollte, enthielt tatsächlich 88,7 mg des Wirkstoffs Paclitaxel, dies entspricht einem Wirkstoffmindergehalt von 44,6 %. Die Arzneimittelzubereitung war von auf Veranlassung des An-geklagten hergestellt worden.
Der Infusionsbeutel der Patientin mit der Herstellungskennziffer 20161125162,der nach der Deklaration auf dem Etikett eine Befüllung mit 160,00 mg des Wirkstoffs Paclitaxel in einer 0,9 %-igen NaCl-Trägerlösung aufweisen sollte, enthielt tatsächlich 88,7 mg des Wirkstoffs Paclitaxel, dies entspricht einem Wirkstoffmindergehalt von 44,6 %. Die Arzneimittelzubereitung war von auf Veranlassung des An-geklagten hergestellt worden.
Tat 61.922 der Anklage
504![]() Der Infusionsbeutel des Patienten mit der Herstellungskennziffer 20161125131,der nach der Deklaration auf dem Etikett eine Befüllung mit 1.000,00 mg des Wirkstoffs Folinsäure in einer 0,9 %-igen NaCl-Trägerlösung aufweisen sollte, enthielt tatsächlich 499,0 mg des Wirkstoffs Folinsäure, dies entspricht einem Wirkstoffmindergehalt von 50,1 %. Die Arzneimittelzubereitung war von auf Veranlassung des An-geklagten hergestellt worden.
Der Infusionsbeutel des Patienten mit der Herstellungskennziffer 20161125131,der nach der Deklaration auf dem Etikett eine Befüllung mit 1.000,00 mg des Wirkstoffs Folinsäure in einer 0,9 %-igen NaCl-Trägerlösung aufweisen sollte, enthielt tatsächlich 499,0 mg des Wirkstoffs Folinsäure, dies entspricht einem Wirkstoffmindergehalt von 50,1 %. Die Arzneimittelzubereitung war von auf Veranlassung des An-geklagten hergestellt worden.
Tat 61.923 der Anklage
506Der Infusionsbeutel der Patientin mit der Herstellungskennziffer 20161125129,der nach der Deklaration auf dem Etikett eine Befüllung mit 372,00 mg des Wirkstoffs Folinsäure in einer 0,9 %-igen NaCl-Trägerlösung aufweisen sollte, enthielt tatsächlich 136,7 mg des Wirkstoffs Folinsäure, dies entspricht einem Wirkstoffmindergehalt von
507![]() 63,2 %. Die Arzneimittelzubereitung war von auf Veranlassung des An-geklagten hergestellt worden.
63,2 %. Die Arzneimittelzubereitung war von auf Veranlassung des An-geklagten hergestellt worden.
Tat 61.924 der Anklage
509Der Infusionsbeutel der Patientin mit der Herstellungskennziffer20161125145, der nach der Deklaration auf dem Etikett eine Befüllung mit 800,00 mg des Wirkstoffs Fluorouracil in einer 0,9 %-igen NaCl-Trägerlösung aufweisen sollte, enthielt tatsächlich 579,5 mg, dies entspricht einem Wirkstoffmindergehalt von 27,6 %.
510628
511Ob die Arzneimittelzubereitung vom Angeklagten oder einem entsprechend angewiesenen Mitarbeiter hergestellt worden war, konnte die Kammer nicht feststellen.
512Tat 61.925 der Anklage
513![]() Der Infusionsbeutel des Patienten mit der Herstellungskennziffer 20161125149,der nach der Deklaration auf dem Etikett eine Befüllung mit 1.170,00 mg des Wirkstoffs Fluorouracil in einer 0,9 %-igen NaCl-Trägerlösung aufweisen sollte, enthielt tatsächlich 568,4 mg, dies entspricht einem Wirkstoffmindergehalt von 27,1 %. Die Arzneimittelzubereitung war von auf Veranlassung des Angeklagten hergestelltworden.
Der Infusionsbeutel des Patienten mit der Herstellungskennziffer 20161125149,der nach der Deklaration auf dem Etikett eine Befüllung mit 1.170,00 mg des Wirkstoffs Fluorouracil in einer 0,9 %-igen NaCl-Trägerlösung aufweisen sollte, enthielt tatsächlich 568,4 mg, dies entspricht einem Wirkstoffmindergehalt von 27,1 %. Die Arzneimittelzubereitung war von auf Veranlassung des Angeklagten hergestelltworden.
Tat 61.926 der Anklage
515Der Infusionsbeutel des Patienten mit der Herstellungskennziffer20161128020, der nach der Deklaration auf dem Etikett eine Befüllung mit 145,00 mg des Wirkstoffs Paclitaxel in einer 0,9 %-igen NaCl-Trägerlösung aufweisen sollte, enthielt tatsächlich 75,63 mg, dies entspricht einem Wirkstoffmindergehalt von 47,8 %.
516![]() Die Arzneimittelzubereitung war von Veranlassung des Angeklagtenhergestellt worden.
Die Arzneimittelzubereitung war von Veranlassung des Angeklagtenhergestellt worden.
Tat 61.927 der Anklage
518Der Infusionsbeutel der Patientin mit der Herstellungskennziffer20161128005, der nach der Deklaration auf dem Etikett eine Befüllung mit 150,00 mg des Wirkstoffs Doxetacel in einer 0,9 %-igen NaCl-Trägerlösung aufweisen sollte, enthielt tatsächlich 70,9 mg, dies entspricht einem Wirkstoffmindergehalt von 52,7 %. Die
519Arzneimittelzubereitung war von auf Veranlassung des Angeklagten her-gestellt worden.
520Tat 61.928 der Anklage
521Der Infusionsbeutel des Patienten mit der Herstellungskennziffer 20161125144,der nach der Deklaration auf dem Etikett eine Befüllung mit 300,00 mg des Wirkstoffs Etoposid in einer 0,9 %-igen NaCl-Trägerlösung aufweisen sollte, enthielt tatsächlich 102,1 mg, dies entspricht einem Wirkstoffmindergehalt von 66 %. Ob die Arzneimittelzubereitung vom Angeklagten oder einem entsprechend angewiesenen Mitarbeiter hergestellt worden war, konnte die Kammer nicht feststellen.
522629
523Tat 61.929 der Anklage
524Der Infusionsbeutel des Patienten mit der Herstellungskennziffer20161125132, der nach der Deklaration auf dem Etikett eine Befüllung mit 975,00 mg des Wirkstoffs Folinsäure in einer 0,9 %-igen NaCl-Trägerlösung aufweisen sollte, enthielt tatsächlich 249,2 mg des Wirkstoffs Folinsäure, dies entspricht einem Wirkstoff-
525![]() mindergehalt von 74,4 %. Die Arzneimittelzubereitung war von auf Ver-anlassung des Angeklagten hergestellt worden.
mindergehalt von 74,4 %. Die Arzneimittelzubereitung war von auf Ver-anlassung des Angeklagten hergestellt worden.
Tat 61.930 der Anklage
527Der Infusionsbeutel der Patientin mit der Herstellungskennziffer 20161125116,der nach der Deklaration auf dem Etikett eine Befüllung mit 20,00 mg des Wirkstoffs Dexamethason in einer 0,9 %-igen NaCl--Trägerlösung aufweisen sollte, enthielt tatsächlich 4,52 mg des Wirkstoffs Dexamethason-21-(dihydrogen)phosphat, dies entspricht einem Wirkstoffmindergehalt von 77,4 %. Ob die Arzneimittelzubereitung vom Angeklagten oder einem entsprechend angewiesenen Mitarbeiter hergestellt worden war, konnte die Kammer nicht feststellen.
528b) Abrechnen der Zubereitungen gegenüber den gesetzlichen Krankenkassen
529(1) Abrechnungsverfahren
530Die weitaus meisten Empfänger der Arzneimittelzubereitungen der Apotheke wa-
531ren gemäß dem Sozialgesetzbuch V Versicherte in der gesetzlichen Krankenversicherung. Auf Grundlage des so genannten Sachleistungsprinzips des § 2 SGB V rechnete der Angeklagte die Zubereitungen für diese Patienten mit den jeweiligen gesetzlichen Krankenkassen ab, wobei er sich - wie im Apothekenwesen fast ausnahmslos üblich - eines Abrechnungsunternehmens bediente. Das Gleiche galt für einige wenige von Patienten, deren Behandlung von anderen öffentlich-rechtlichen Kostenträgern (z. B. Sozialämtern) ebenfalls nach dem Sachleistungsprinzip getragen wurde. Im Folgenden ist zur Vereinfachung zusammenfassend stets von den gesetzlichen Krankenkas-
532630
533sen die Rede, wenn gesetzliche Krankenkassen und die sonstigen öffentlich-rechtlichen Kostenträger in dem vorgenannten Sinne gemeint sind.
534(Abrechnungen gegenüber Selbstzahlern und Patienten, deren Behandlungskosten von Kostenträgern nach dem Kostenerstattungsprinzip erstattet wurden [private Krankenversicherung, Beihilfe nach beamtenrechtlichen Grundsätzen], sind von der Anklage nicht umfasst.)
535Das Abrechnen lief während des gesamten Tatzeitraums wie folgt ab: Zunächst wurden in der Apotheke die ärztlichen Verordnungen taxiert. Diese Taxierung nahm in manchen Fällen der Angeklagte eigenhändig vor; regelmäßig mit der Taxierung be-
536![]() fasst waren auf seine Anweisung hin aber die Mitarbeiter W , S und F
fasst waren auf seine Anweisung hin aber die Mitarbeiter W , S und F
![]() . Taxieren bedeutete, den mit der gesetzlichen Krankenkasse abzurechnenden Preis des jeweils verordneten Arzneimittels zu bestimmen und mit einem maschinellen Aufdruck auf dem Verordnungsblatt („Rezept“) zu vermerken. Angegeben wurden außerdem die Anzahl der verwendeten Verpackungseinheiten, gegebenenfalls der Betrag einer vom Patienten zu leistenden Zuzahlung und der Brutto-Abrechnungsbetrag. Schließlich wurde als Sonderkennzeichen für Zytostatika-Zubereitungen die Nummer 09999092 entsprechend der Technischen Anlage 1 zur Vereinbarung über die Ermittlung von Daten im Rahmen der Arzneimittelabrechnung gemäß § 300 SGB V aufgedruckt.
. Taxieren bedeutete, den mit der gesetzlichen Krankenkasse abzurechnenden Preis des jeweils verordneten Arzneimittels zu bestimmen und mit einem maschinellen Aufdruck auf dem Verordnungsblatt („Rezept“) zu vermerken. Angegeben wurden außerdem die Anzahl der verwendeten Verpackungseinheiten, gegebenenfalls der Betrag einer vom Patienten zu leistenden Zuzahlung und der Brutto-Abrechnungsbetrag. Schließlich wurde als Sonderkennzeichen für Zytostatika-Zubereitungen die Nummer 09999092 entsprechend der Technischen Anlage 1 zur Vereinbarung über die Ermittlung von Daten im Rahmen der Arzneimittelabrechnung gemäß § 300 SGB V aufgedruckt.
Grundlage der Abrechnungsbeträge war die jeweils gültige Fassung der Anlage 3 (Preisbildung für parenterale Lösungen) des Vertrages über die Preisbildung von Stoffen und Zubereitungen aus Stoffen, basierend auf §§ 4 und 5 der Arzneimittelpreisver-ordnung (Vertrag zur Hilfstaxe für Apotheken) in Verbindung mit der jeweils gültigen Fassung der Arzneimittelpreisverordnung. Zulässig und üblich war es dabei, so genannte Verwürfe von Wirkstoffen ebenfalls abzurechnen. Verwürfe entstanden, weil die ärztlich verordneten Wirkstoffmengen für eine Zubereitung mit den Verpackungseinheiten der jeweiligen Wirkstoffe nicht stets identisch waren. So konnte es vorkommen, dass nach dem Herstellen einer Zubereitung eine Wirkstoffrestmenge aus der angebrochenen Verpackungseinheit verblieb. Falls diese Restmenge nicht für eine folgende Zubereitung innerhalb des zulässigen Verwendbarkeitszeitraums genutzt werden konnte, war sie zu verwerfen, also zu entsorgen.
539Jede Taxierung spiegelte den vom Angeklagten rechtmäßig zu vereinnahmenden Ab-
540![]()
![]()
![]()
![]()
![]()

![]()
![]()
![]()
![]()
![]()

![]()


![]()
632
542wurden zu einem späteren Zeitpunkt an die Krankenkassen versandt.
543Die Zahlungen erfolgten zunächst unter Vorbehalt. Innerhalb eines Zeitraums von einem Jahr hatten die Krankenkassen nunmehr die Möglichkeit, anhand der jetzt vorliegenden Rezepte die vorgenommenen Taxierungen auf die Richtigkeit der angesetzten Preise und der Berechnung der Abrechnungsbeträge zu überprüfen. Dies geschah stichprobenartig. Bei Beanstandungen der abgerechneten Rezepte wurden dem Angeklagten diese Beanstandungen sowie die sich hieraus ergebenden Kürzungen schriftlich mitgeteilt und ihm eine Einspruchsfrist gegen die geplante so genannte Retaxierung eingeräumt. Nach Ablauf der Einspruchsfrist oder nach erfolglosem Einspruchsverfahren wurden die sich aus der Prüfung ergebenden Kürzungen über die mit den laufenden Abrechnungen der Apotheke des Angeklagten verrechnet.
544![]()
![]() Die gesetzlichen Krankenkassen wiesen die genannten Zahlungen an die im Vier-Augen-Prinzip regelmäßig durch einen Sachbearbeiter und einen Vorgesetzten an. Eine Prüfung erfolgte nur auf Plausibilität. Die Mitarbeiter der Krankenkassen nahmen jeweils an, dass die abgerechneten Leistungen tatsächlich erbracht worden waren, insbesondere dass die abgerechneten Zubereitungen mit dem im Rezept ausgewiesenen Wirkstoff in der angegebenen Menge versehen worden waren.
Die gesetzlichen Krankenkassen wiesen die genannten Zahlungen an die im Vier-Augen-Prinzip regelmäßig durch einen Sachbearbeiter und einen Vorgesetzten an. Eine Prüfung erfolgte nur auf Plausibilität. Die Mitarbeiter der Krankenkassen nahmen jeweils an, dass die abgerechneten Leistungen tatsächlich erbracht worden waren, insbesondere dass die abgerechneten Zubereitungen mit dem im Rezept ausgewiesenen Wirkstoff in der angegebenen Menge versehen worden waren.
![]()
![]()
![]() leitete die vereinnahmten Gelder an die Apotheke des Angeklag-
leitete die vereinnahmten Gelder an die Apotheke des Angeklag-
ten weiter. Aufgrund der vertraglichen Vereinbarung zwischen dem Angeklagten und
547![]()
![]()
![]() erhielt die Apotheke jeweils zur Monatsmitte eine Abschlagszah-
erhielt die Apotheke jeweils zur Monatsmitte eine Abschlagszah-
lung für den Vormonat in Höhe von 80 % des durchschnittlichen Abrechnungsbetrages der drei Vormonate. Die Restzahlung folgte zu einem späteren Zeitpunkt.
549(2) Abrechnen unterdosierter Zubereitungen
550Im Tatzeitraum reichte der Angeklagte insgesamt für 59 Monate (Januar 2012 bis ein-
551schließlich November 2016) taxierte Rezepte bei der mit dem Zweck derAbrechnung gegenüber den gesetzlichen Krankenkassen ein. Jeweils enthalten waren diejenigen Rezepte, die sich auf die unterdosierten parenteralen Arzneimittelzubereitungen bezogen, obwohl insoweit - mangels Erbringung einer Leistung - kein Zahlungsanspruch bestand.
552633
553Das monatliche Einreichen der Rezepte für diese Zubereitungen durch den Angeklag-
554ten hatte den objektiven Erklärungswert, die Apotheke habe die entsprechendenLeistungen tatsächlich erbracht, indem sie die jeweiligen Zubereitungen verordnungsgemäß hergestellt und ausgeliefert hätte. Diese Erklärung wurde mittels der Rechnungen der deren Mitarbeiter gutgläubig waren, an die Krankenkassen wei-tergegeben. Tatsächlich war die Erklärung jedoch unrichtig, da in den Fällen der unterdosierten Zubereitungen gerade keine ordnungsgemäßen Leistungen erbracht waren. Die Sachbearbeiter der jeweiligen Krankenkassen unterlagen einer entsprechenden Fehlvorstellung, aufgrund derer sie die abgerechneten Beträge (auch) für die unterdosierten Zubereitungen anwiesen. In Kenntnis des tatsächlichen Sachverhalts hätten sie keine Zahlungen angewiesen, bei späterer Kenntnis eine Retaxierung der Abrechnungen auf null vorgenommen.
555Die Kammer konnte keine exakten Zahlungs- und Schadensbeträge für die einzelnen Monate feststellen, da sie im Wege der Wahlfeststellung lediglich eine Mindestzahl von unterdosierten Zubereitungen ermittelt hat (siehe oben). In gleicher Weise konnte sie nicht feststellen, welche der zahlreichen gesetzlichen Krankenkassen tatsächlich betroffen waren. Feststellbar sind lediglich Mindestbeträge:
556Der Angeklagte erlangte für die festgestellte Mindestzahl von 14.498 Zubereitungen von den gesetzlichen Krankenkassen durchschnittlich einen monatlichen Betrag von 234.576 Euro (abgerundet). Der Schaden gegenüber den gesetzlichen Krankenkassen insgesamt betrug 13.605.408 Euro (abgerundet).
557Für den Monat November 2016 (Tat 59 der Betrugstaten der Anklage) ist nach Bekanntwerden der Vorwürfe gegen den Angeklagten eine Auszahlung eines Abrech-
558nungsbetrages von rund 3,0 Mio. Euro gegenüber der Apotheke nicht erfolgt.
559c) Keine mikrobielle Kontamination von Zubereitungen
560Für keine einzige in der Anklageschrift aufgeführte Zubereitung konnte die Kammer eine mikrobielle Kontamination und eine damit einhergehende nicht unerhebliche Qualitätsminderung feststellen.
561![]()
![]()

![]()
 Der Angeklagte litt während des gesamten Tatzeitraums
Der Angeklagte litt während des gesamten Tatzeitraums
![]() Dadurch war er aber zu keinem Zeitpunkt in seinen kognitiven Fähigkeiten eingeschränkt, insbesondere nicht in einer Weise, dass
Dadurch war er aber zu keinem Zeitpunkt in seinen kognitiven Fähigkeiten eingeschränkt, insbesondere nicht in einer Weise, dass
![]()


![]()
![]()
![]()
![]()
![]()
![]()
![]()

636
565b) Anlass des vorliegenden Strafverfahrens
566Anlass für das vorliegende Strafverfahren war eine Strafanzeige, die Rechtsanwalt Dr.
567S aus München im Namen eines zunächst anonym bleibenden Mandanten am08.09.2017 bei der Schwerpunktstaatsanwaltschaft für Wirtschaftskriminalität in Bochum mündlich anbrachte. Der schriftlichen Strafanzeige vom 15.09.2017 beigefügt
568waren verschiedene Einkaufsrechnungen und Abrechnungsunterlagen der Apo-theke zu den Arzneimitteln Opdivo (Freiname: Nivolumab) und Xgeva (Freiname: De-
569nosumab). Zu einem späteren Zeitpunkt offenbarte sich P , der kaufmän-
570nische Leiter der Apotheke, als Anzeigenerstatter.
571Gegenstand der Strafanzeige war der Vorwurf der Unterdosierung von Arzneimittelzu-
572bereitungen. P waren in der Apotheke Gerüchte zu Ohren gekommen, dass dieparenteralen Arzneimittelzubereitungen im Reinraumlabor nicht ordnungsgemäß hergestellt werden würden. Daraufhin hatte er die Lieferscheine über die Wirkstoffliefe-rungen einerseits und die Daten des Dokumentationsprogramms Zenzy andererseits miteinander verglichen. Dabei entdeckte er deutliche Diskrepanzen zwischen den Einkaufsmengen der Wirkstoffe und der dokumentierten verarbeiteten Menge: Die Apotheke des Angeklagte verarbeitete und verkaufte anscheinend mehr Wirkstoffe, als sie einkaufte.
573![]() So stellte P bei dem von ihm untersuchten Wirkstoff mit dem Handelsnamen
So stellte P bei dem von ihm untersuchten Wirkstoff mit dem Handelsnamen
Opdivo (auf dem Markt erst seit 2015) fest, dass nur rund ein Drittel der Herstellungs-
575menge auch durch Einkäufe belegt war. P forderte ergänzend vom Hersteller ein
576Debitorenkonto mit dessen Lieferungen an die Apotheke an und prüfte die an die
577![]() zur Abrechnung weitergeleiteten Rezepte, um sicherzugehen, dass die in Zenzy dokumentierten Zubereitungen tatsächlich hergestellt und ausgeliefert worden waren. Dieses ergänzende Datenmaterial bestätigte das Ergebnis.
zur Abrechnung weitergeleiteten Rezepte, um sicherzugehen, dass die in Zenzy dokumentierten Zubereitungen tatsächlich hergestellt und ausgeliefert worden waren. Dieses ergänzende Datenmaterial bestätigte das Ergebnis.
P verwies die ermittelnden Polizeibeamten an die weitere Mitarbeiterin des Rein-
579raumlabors K , die ihren Verdacht der Unterdosierung der Arzneimittel eben-
580falls äußerte. K übergab der Polizei am 26.10.2016 einen so genannten „Rückläu-fer“, den sie durch einen Zufall in ihren Besitz gebracht hatte. Dabei handelte es sich um eine ausgelieferte onkologische Zubereitung des Angeklagten, die tatsächlich in der verordnenden Arztpraxis nicht zur Verwendung kam und aus diesem Grund zur
581637
582Vernichtung an die Apotheke des Angeklagten zurückgegeben wurde. Der Infusions-
583beutel war für eine Patientin zubereitet und sollte den WirkstoffBevacizumab, einen monoklonalen Antikörper, enthalten. Die Beamtin KK´in G brachte den Infusionsbeutel zur weiteren Untersuchung zum Paul-Ehrlich-Institut in Langen. Die dort durchgeführte Analyse führte zu dem Ergebnis, dass die Infusion keinerlei Wirkstoff enthielt. (Nicht Gegenstand der Anklage.)
584Am 29.11.2016 durchsuchten Beamte des Polizeipräsidiums Recklinghausen, beglei-
585tet von der für Bottrop zuständigen Amtsapothekerin, der Zeugin L , und dem
586Sachverständigen L sowie den ermittelnden Staatsanwälten, die Apotheke
587in Bottrop, das Reinraumlabor des Angeklagten unter der Anschrift 37 so-
588wie sein Privatanwesen in Bottrop .
589c) Nachtatgeschehen, insbesondere Medienberichterstattung
590Der Angeklagte wurde am Tag der Durchsuchung festgenommen und befindet sich seit diesem Tag ununterbrochen in Untersuchungshaft, zunächst in der Justizvollzugs-
591![]()
![]()
![]() anstalt und seit 27.12.2016 in der Justizvollzugsanstalt
anstalt und seit 27.12.2016 in der Justizvollzugsanstalt
Das Reinraumlabor des Angeklagten in der 37 in Bottrop wurde noch am Tag
593der Durchsuchung von der Amtsapothekerin geschlossen. Die Apothekerzulassung des Angeklagten ruht.
594Der Geschäftsbetrieb der Apotheke - mit Ausnahme des Reinraumlabors - sowie
595die Filialapotheke in wurden von der Mutter des Angeklagten weitergeführt.
596Durch Vertrag vom 26.01.2017 wurde jedenfalls das Gebäude 32 nebst
597Apothekenbetrieb und Einrichtung an die Mutter des Angeklagten zurückübertragen.
598Bald nach der Festnahme des Angeklagten kam es zu umfangreicher Medienberichterstattung über das Ermittlungsverfahren, vielfach regional, teils aber auch bundesweit. Bisweilen wurde der volle Name des Angeklagten genannt, vielfach erschienen auch Fotos ohne Pixelung. Die Berichterstattung hatte nicht selten vorverurteilenden Charakter und ging hinsichtlich der vermeintlich verwirklichten Delikte über den Ermittlungsstand der Staatsanwaltschaft hinaus:
599So hieß es am 29.06.2017 in einem Artikel auf der Titelseite der BILD-Zeitung: "Der Todesapotheker – 1000 qm Protzbau für sich und seinen Hund – Für sein Luxus-Leben
600638
601ließ er Krebskranke sterben." Ebenfalls auf der Titelseite fand sich ein unverpixeltes Foto des Angeklagten. Im Innenteil der Zeitung waren Innen- und Außenaufnahmen des Privathauses des Angeklagten abgedruckt. In der Zeitung DIE ZEIT (46/2017) lautete die Überschrift eines Artikels: "Die Gier des Apothekers – Tausende Krebskranke waren auf ihn angewiesen. Er aber setzte ihr Leben aufs Spiel. Die Geschichte eines Verbrechens, das auch ein Medizinskandal ist." Vergleichbare Berichte erschienen auch in anderen Medien.
6025. Vermögensverhältnisse des Angeklagten
603
639
605III. Beweiswürdigung
606Der Angeklagte hat sich in der Hauptverhandlung nicht zur Sache eingelassen, ebenso nicht im Ermittlungs- und Zwischenverfahren.
607Hingegen hat er außerhalb der Hauptverhandlung bei Explorationsgesprächen - zwischen dem 27. und dem 28. Hauptverhandlungstag - Angaben gegenüber dem ge-
608richtlich bestellten psychiatrischen Sachverständigen Prof. S gemacht. In deut-lich geringerem Umfang hat er außerdem Angaben gegenüber dem - ursprünglich von
609seinem Verteidiger beauftragten - Sachverständigen Prof. Dr. F gemacht,die sich ausschließlich auf die familiäre Herkunft und den Lebenslauf beziehen. All diese Angaben hat die Kammer durch Vernehmung der Sachverständigen in die Hauptverhandlung eingeführt. Die Kammer hat keine Zweifel, dass die beiden Sachverständigen die Angaben in der Hauptverhandlung vollständig und korrekt reprodu-
610ziert haben. Der Sachverständige Prof. S hatte die Angaben des Angeklagtenauf Tonträger aufgezeichnet und konnte sich auf eine entsprechende Verschriftlichung stützen.
611Der Angeklagte hat gegenüber Prof. S zwar allgemeine Abläufe in der Apotheke
612geschildert und seinen dortigen Tätigkeitsbereich beschrieben. Zu den eigentlichen Tatvorwürfen hat er jedoch keine konkreten Angaben gemacht. Er hat lediglich pauschal gäußert, „anfangs“ [gemeint: kurz nach seiner Inhaftierung] habe er gar nicht verstanden, was man ihm vorwerfe. Erst später sei „etwas Fleisch dran gekommen“, er habe sich „das“ aber nicht vorstellen können. Weiter hat er gegenüber Prof. S
613angegeben, am Tag vor der Durchsuchung vom 29.11.2016, also am Montag, 28.11.2016, nicht in der Apotheke gewesen zu sein. Kurz darauf hat er sich auf weitere Nachfrage korrigiert und erklärt, nur bis mittags in der Apotheke gewesen zu sein. Weiter sei die Differenz zwischen Einkaufs- und Herstellungsmenge für ihn "nicht zu erklären".
614Soweit die Kammer den Angeklagten verurteilt hat, ist er durch die Beweisaufnahme in der Hauptverhandlung überführt.
615640
6161. Angaben des Angeklagten im Einzelnen
617Der Angeklagte hat gegenüber dem Sachverständigen Prof. S Angaben zu sei-
618ner familiären Herkunft und zu seinem persönlichen und beruflichen Werdegang gemacht, wie sie den Feststellungen entsprechen. Sie decken sich mit den Angaben ge-
619genüber Prof. F .
620
Zu seiner Tätigkeit und den Abläufen in der Apotheke
622Er sei immer so gegen 5.00 Uhr aufgestanden, habe den Hund in den Garten gelassen und sei in die Apotheke gefahren. Zwischen 6.00 Uhr und 6.45 Uhr sei er im Labor tätig gewesen. Gegen 7.00 Uhr hätten die Fahrer die Therapien zur Auslieferung abgeholt, dabei habe es sich um Zubereitungen des Vortages gehandelt, es habe auch
623641
624Sachen gegeben, die noch dazugekommen seien. Er habe noch einen „ganzen Batzen“ hergestellt, übrig gebliebene Bestellungen vom Vortag und Zubereitungen mit kurz haltbaren Wirkstoffen. Es seien mindestens zehn, auch mal fünfzehn oder zwanzig Zubereitungen gewesen.
625Nachmittags nach 16:00 Uhr habe er oft ebenfalls im Reinraumlabor gearbeitet, dies aber nicht an jedem Tag, je nachdem, ob er selbst Zeit gehabt habe und ob noch fehlende Zubereitungen hätten hergestellt werden müssen. In der Zeit zwischen 8.00 Uhr und 16.00 Uhr hätten die PTAs die Arbeit im Reinraumlabor übernommen. Insgesamt habe er maximal zwei Stunden täglich Zubereitungen hergestellt. Eine Konzentration auf bestimmte Wirkstoffe, insbesondere auf monoklonale Antikörper, habe es nicht gegeben, alle Mitarbeiter hätten alles hergestellt, die Mitarbeiter den Großteil. Im Labor habe er es als ruhig empfunden.
626Es sei schneller gegangen, wenn mehrere Zytostatika-Lösungen mit demselben Wirkstoff herzustellen gewesen seien. Manche Wirkstoffe hätten zudem vorgelöst werden müssen. Für ihn sei die Zeit stressbehaftet gewesen. Auch im Übrigen habe er sich unter Stress gesetzt gefühlt von den vielen organisatorischen Dingen, die Anweisungen an die Fahrer, die Gedanken an die Termine etc. Der Stress habe sich über den Tag fortgesetzt: Termine hätten sich ergeben, das Telefon habe ständig geklingelt, auch schon morgens im Labor. Zwischen 8.00 Uhr und 16.00 Uhr sei er mit verschiedenen Dingen beschäftigt gewesen, so z.B. Mitarbeitergesprächen, Bestellungen, Telefonaten mit verschiedenen Geschäftspartnern, Marketing und habe auch Kunden bedient. Er sei auch vormittags noch einmal ins Labor gegangen und habe die Therapieprotokolle kontrolliert. Die Apotheke habe er gegen 19:00 - 20:00 Uhr verlassen, samstags gegen 15:00 - 16:00 Uhr, er sei aber auch sonntags in der Apotheke gewesen.
627Privat sei er mit den Bauplanungen für das Ärztehaus befasst gewesen, er habe Gespräche mit Architekten und anderen Bauleuten geführt. Weiter habe er mit weiteren Personen ein Hospiz gebaut. Er sei der Vorsitzende des Fördervereins gewesen.
628Daneben habe es viele Abendveranstaltungen gegeben, so eine Veranstaltungsreihe in Form eines „Gesundheitstalks“, die alle sechs bis acht Wochen stattgefunden habe, oder Marketing-Aktionen der Stadt, wie ein Songcontest oder Laufwettbewerbe, wie den Tetraeder-Lauf. Er sei an zig Stellen tätig gewesen, was im Nachhinein einfach zu viel gewesen sei. Er habe eben immer Schwierigkeiten mit dem Nein-Sagen gehabt.
629642
630Urlaub habe er rund eine Woche jährlich gemacht, nur 2012 und 2013 sei er mal länger unterwegs gewesen.
631Er habe trotz seines Stress-Levels selbst noch an der Herstellung der Zubereitungen mitgearbeitet, da er sich das vielleicht nicht völlig aus der Hand habe nehmen lassen wollen. Ein Apotheker sei aber nicht zwingend notwendig.
632Die vorhandenen Wirkstoffbestände seien in der Apotheke im PC erfasst worden, im Rahmen der Hauptverhandlung sei es aber öffentlich geworden, dass die ganzen Dokumentationen und Bestände chaotisch gewesen seien und offensichtlich nicht richtig gepflegt worden seien. In der Praxis sei es im Wesentlichen über eine "Sichtkontrolle" gegangen. Die Kühlschränke seien voll gewesen mit Wirkstoffen und die Lager auch. Wenn die letzten Vorräte aus dem Keller ins Labor gebracht worden seien, sei nachbestellt worden.
633Die Bestellungen habe meist er selbst gemacht oder er habe einem Mitarbeiter gesagt, war er bestellen solle. Wenn noch Preise hätten verhandelt werden müssen, habe er immer selbst bestellt. Eigentlich sei immer sehr viel Ware da gewesen, da er immer größere Mengen, zum Teil auch mit anderen zusammen, bestellt habe, um bessere Konditionen heraushandeln zu können. Nur in seltenen Fällen, in denen unerwartet ein Wirkstoff gefehlt habe und kurzfristig zu höheren Konditionen habe bestellt werden müssen, hätten das auch die Mitarbeiterinnen des Labors selbst gemacht.
634Zum Herstellungsprozess der Zytostatika
635Der Herstellungsprozess der onkologischen Zubereitungen sei wie folgt abgelaufen: Zunächst erhalte die Apotheke ein Therapieprotokoll eines Arztes, welches zunächst kontrolliert werde hinsichtlich der Therapieabstände, Wirkstoffmenge usw. Die Daten seien manuell in das Computerprogramm eingegeben worden. Die Kontrolle sei auch dahingehend erfolgt, ob die Wirkstoffmenge, die von Gewicht und Größe bzw. der Körperoberfläche abhängig sei und sich ändern könne, noch im System aktuell gewesen. Die Kontrolle habe er früher selbst gemacht, zuletzt sei dies im Wesentlichen von den PTA übernommen worden, er habe aber häufig noch einmal darüber geschaut. Anhand der Software seien dann die Etiketten gedruckt worden, mit denen im Labor gearbeitet worden sei. Wenn er morgens ins Labor gekommen sei, habe er dort die entsprechenden Etiketten vorgefunden.
636643
637Die Anforderungen seien bei der Herstellung durchaus unterschiedlich gewesen, auch z.B. im Hinblick auf die Fertigstellung des Infusionsbeutels oder die Lagerung des Wirkstoffs oder der Zubereitung als gekühlt oder lichtgeschützt. Er habe immer viel parallel gemacht.
638Bei der Zubereitung sei der gelöste oder als Lösung vorhandene Wirkstoff per Spritze aufgezogen worden. Bei einer Wirkstoffmenge von mehr als 50 ml habe die Wirkstoff-menge in mehreren Etappen aufgezogen werden müssen, da die maximale Spritzen-kapazität 50 ml betragen habe (sog. volumetrisches Verfahren).
639Nach Einbringung der entsprechenden Wirkstoffmenge in die Trägerlösung sei der In-fusionsbeutel mit dem erforderlichen Besteck versehen, verplombt und entsprechend der Vorgabe gelagert worden. Diese Arbeitsschritte seien grundsätzlich auf der Werkbank erfolgt, da ansonsten die Gefahr des Einatmens der toxischen Stoffe zu hoch sei. Das sei im Übrigen auch der Grund, warum der Schlauch des Infusionsbestecks mit Kochsalz gefüllt sei, damit der Arzt, wenn er die Lösung an den Port oder die Vigo des Patienten anschließt, nicht mit dem Wirkstoff in Berührung komme bzw. Gefahr laufe, diesen einzuatmen. Eine Kontrolle seiner Arbeit erfolge nicht. Nur bei manchen (farbigen) Wirkstoffen sei der Wirkstoff in der Trägerlösung erkennbar.
640Hinsichtlich der Lagerung sei es so, dass auf dem Etikett neben der Haltbarkeit auch die Lagerbedingungen stünden.
641Am Vortag der Durchsuchung sei er nicht in der Apotheke gewesen, die Angaben in der Dokumentation, dass er einen Teil der sichergestellten Zubereitungen hergestellt habe, seien „anzuzweifeln“. Die gesamte Dokumentation sei – wie sich auch aus der Beweisaufnahme ergeben habe – sehr kritisch zu bewerten. Auf weitere Nachfrage
642gab der Angeklagte weiter an, er sei nur vormittags in der Apotheke gewesenund habe auch nur vormittags Therapien hergestellt. Ab mittags sei er nicht mehr in der Apotheke gewesen. Er habe an dem Nachmittag zwei Ärzte in Bocholt und in Velen besucht.
643Wann der Kringel auf dem Herstellungsprotokoll um das Namenszeichen erfolge, mithin vor oder nach der Herstellung, könne er nicht sagen. Er wisse nicht, ob er jemals selbst einen Kringel um sein Namenszeichen gemacht habe, er habe sicherlich einmal einen Kringel gemacht, könne sich an die ganze Dokumentation gar nicht mehr so genau erinnern.
644644
645Auf Nachfrage zur Haltbarkeit der sichergestellten Zubereitungen gab der Angeklagte an, dass die Zubereitungen vom Tag der Durchsuchung eine Haltbarkeit von acht bis 20 Tagen hätten, unabhängig davon, ob sie gekühlt oder ungekühlt gelagert würden.
646Zu der Differenz zwischen Einkaufs- und Herstellungsmenge wolle er keine Angaben machen, aber es sei für ihn nicht zu erklären.
647Zu einer Gewinnsteigerung der Apotheke könne er keine Angaben machen, er wisse auch nicht, ob es eine Steigerung gebe oder dies Ergebnis der Ermittlungen sei. Die Apotheke habe aber in vielen Bereichen in den letzten Jahren enorme Zuwächse, insbesondere zwischen 2010 und 2012, verzeichnet. Er habe sich um die gesamte finanzielle Thematik nicht gekümmert, Grund des Zuwachses seien aber sicherlich das von ihm veränderte Marketing, das allgemeine Wachstum des Absatzes der Apotheke und des onkologischen Bereiches sowie der Umstand, dass nahe Apotheken geschlossen worden seien.
648Das neue Reinraumlabor für die Zytostatika sei im Februar 2016 im Keller des gegenüber liegenden Gebäudes eröffnet worden, zuvor habe es sich im Gebäude der Apotheke befunden. Dort seien seit 2001 Zytostatika hergestellt worden. Der Umzug gründe sich auf eine Änderung der Apothekenbetriebsordnung, die erhöhte Anforderungen statuiert habe. Diese Anforderungen hätten im neuen Labor besser umgesetzt werden können.
649Die Mitarbeiterzahl habe sich zwischen 2009 und 2017 etwa verdoppelt, es seien aber auch viele Boten mit einer Beschäftigung auf 450 Euro-Basis dazu gekommen. Der Umsatz sei nach seiner Übernahme schätzungsweise um 1/3 gewachsen. Der Jahresumsatz habe 40 Mio. Euro betragen, der auf die Zytostatika entfallene Anteil liege bei 12-13 Mio. Euro. Ihm sei es aber auch nicht wichtig gewesen, ob die Apotheke eine Million mehr oder weniger Umsatz mache, ihm sei es eher darum gegangen, dass die Gesamtheit in Ordnung gewesen sei.
650Sein ehrenamtliches Engagement für das Hospiz oder die Organisation des Spendenlaufes, auch die Geldspenden, dies seien alles Dinge gewesen, die er gerne gemacht habe, auch wenn die Arbeit und das Engagement für das Hospiz sehr anstrengend gewesen seien, so habe er aber die Möglichkeit gehabt, etwas für die Menschen zu tun. So habe der Förderverein mit den Spendengeldern Räumlichkeiten für das Hospiz kaufen und einrichten können. Neben der Spendenakquise und den Räumen
651645
652habe er sich im Rahmen der Hospizarbeit auch um die Verträge mit Krankenkassen und viele weitere organisatorische Belange gekümmert. Er habe viel Lob und Anerkennung für sein Engagement bekommen.
653Hinsichtlich der Strafanzeige aus dem Jahr 2013/2014 sei es so gewesen, dass Mitarbeiter ihm gesagt hätten, dass die Vorwürfe Quatsch seien, dass er niemanden angehalten habe, etwas falsch zu machen oder ihn, den Angeklagten, bei einer fehlerhaften
654Herstellung beobachtet habe. Auch habe die Mitarbeiterin , die geschiedene
655Ehefrau des Anzeigeerstatters , ihm berichtet, dass der Anzeigeerstatter
656auch die Mitarbeiterin mehrfach angezeigt habe und dies als persönlicher Affront
657![]() gegen sie, die Mitarbeiterin , zu verstehen sei.
gegen sie, die Mitarbeiterin , zu verstehen sei.
Auf Nachfrage zu den Vorwürfen der Verstöße gegen Hygienevorschriften gab der Angeklagte weiter an, dass er sein Handeln hinterfrage, die beste Kontrolle hingegen durch den behandelnden Mediziner erfolge. Diesem müsse im Rahmen der Therapie schließlich auffallen, dass Therapien nicht richtig wirken würden oder eine typische Färbung fehle. Er hätte nur ganz selten eine kritische Rückmeldung erhalten, z.B. wegen der Kristallisation einer Therapie. Zu fehlender Wirkung habe er nie eine Rückmeldung erhalten. Er könne sich die Vorwürfe nur erklären, wenn er das Gutachten
659von Prof. Dr. F lese. Wegen der großen Belastung könne er sich vorstellen,
660dass er vielleicht anfällig für Fehler gewesen sei.
661Hinsichtlich des Vier-Augen-Prinzips bei der Herstellung der Zubereitungen habe es immer Momente gegeben, dass es eng gewesen sei und er alleine produziert habe, dies sei nichts Besonderes.
662Auf Nachfrage, warum es zu Unterdosierungen, nicht aber zu Überdosierungen gekommen sei, führte der Angeklagte weiter aus, dass er dafür keine Erklärung habe, es habe sicherlich auch Überdosierungen gegeben, die seien nur aufgefallen wegen der prallen Füllung der Zubereitung.
663646
6642. Feststellungen zum Lebenslauf und den persönlichen und wirtschaftlichen Verhältnissen
665Die Feststellungen zum Lebenslauf und den persönlichen und wirtschaftlichen Verhältnissen des Angeklagten beruhen zunächst auf den Angaben, die der Angeklagte ge-
666genüber dem gerichtlichen Sachverständigen Prof. im Rahmen seiner psychi-atrischen Exploration gemacht hat. Das gilt namentlich für seinen Berufsweg und für sein soziales Engagement. Die Kammer hat keine Zweifel an der Richtigkeit dieser
667Angaben. Sie werden bestätigt durch die Aussagen der Zeugin sowie
668der Zeugen Fffl und die den Angeklagten alle bereits seit Kindheitstagen
669kennen und die einzelnen Stationen seines Werdeganges in Übereinstimmung mit sei-
670nen Ausführungen geschildert haben. war als kaufmännische Ange-
671stellte und "Mädchen für alles" der Apotheke von 1971 bis 2017 tätig; sie hatte
672den Angeklagten zu dessen Kinderzeit gelegentlich auch betreut. Iffl hat sich selbst als "engen Freund" des Angeklagten bezeichnet; er war einer der wenigen Gäste bei
673dessen standesamtlicher Trauung. Der kaufmännische Leiter kannte den An-geklagten ebenfalls bereits aus Kindertagen.
674Seine schrittweise Übernahme der Apotheke - Einstieg als angestellter Apotheker im Jahr 2000, Eröffnung des Reinraumlabors im Jahr 2001, Pacht und verantwortliche
675Leitung im Jahr 2009, Erwerb des Hauses 32 nebst Apothekenbetrieb im Jahr2012 - hat der Angeklagte selbst in Umrissen geschildert. Die Feststellungen hierzu beruhen weiter auf übereinstimmenden Zeugenaussagen langjähriger Apothekenmit-
676arbeiter, so der Zeugin KM (siehe vorstehend), der Zeugin
677r, einer Apothekerin, die seit 2007 in der Apotheke arbeitete und außerdemeine Studienfreundin des Angeklagten war, sowie der langjährigen PTA Stefanie
678Ergänzend hat die Kammer verschiedene Verträge durch Verlesen in die Hauptverhandlung eingeführt, die diese Feststellungen bestätigen: Insbesondere den Notarver-
679trag vom 24.10.2012, mit dem das Grundstück 32 und der Apothekenbetrieb
680durch die Mutter auf den Angeklagten übertragen wurden.
681Die spätere Rückübertragung des Grundstücks ergibt sich aus dem verlesenen Notarvertrag vom 26.01.2017 nebst notarieller Genehmigungserklärung der
682Mutter vom 30.01.2017. machte von einem durch Vormerkunggesicherten Rückübertragungsanspruch aus dem Vertrag vom 24.10.2012 Gebrauch.
683647
684Die Feststellungen zu den Partnerschaften bzw. der Ehe des Angeklagten stützen sich
685ergänzend auf die Aussagen der Zeuginnen K und T . Hingegen hat sichdie geschiedene Ehefrau auf ihr Zeugnisverweigerungsrecht berufen.
686Angaben zum luxuriösen Lebensstil, zum Privathaus und zu den hohen privaten Ausgaben haben die Zeugen aus dem privaten Umfeld des Angeklagten übereinstimmend gemacht. Die Feststellungen hierzu beruhen insbesondere auf den Angaben der Zeu-
687gin K , die mit dem Angeklagten etwa seit dem Jahre 2011 gut befreundet warund 2014 - 2015 als Angestellte der Apotheke das Marketing besorgte sowie als persönliche Assistentin fungierte. Sie schilderte, dass der Angeklagte gern großzügige Geschenke machte. So habe er ihr und ihrem Lebensgefährten eine teure Kreuzfahrt geschenkt, an der er - der Angeklagte - schließlich auch selbst teilgenommen habe.
688Plastisch schilderte die Zeugin K weiter, dass er ein Faible für Designer-Klei-dung entwickelt habe; sie habe dabei als seine "Modeberaterin" fungiert.
689Die Kammer stuft die Angaben der Zeugin K als glaubhaft ein; Übertreibungen
690schließt sie aus. Die Zeugin hat sich nach wie vor als Freundin des Angeklagten bezeichnet, Belastungstendenzen waren nicht erkennbar. Sie hat ihre Beziehung zum Angeklagten und dessen Verhalten im privaten Umgang sehr differenziert und in Teilen auch kritisch dargestellt.
691Dass der Angeklagte seinen Mitarbeitern in finanziellen Notlagen großzügig mit Geld aushalf, haben Zeugen aus der Apotheke bestätigt.
692Die Feststellungen zum Privathaus des Angeklagten beruhen weiter auf den glaubhaf-
693ten Ausführungen des Finanzermittlers KHK J . Er berichtete von seinen Wahr-nehmungen am Tag der Durchsuchung, an der er teilgenommen hatte. Ergänzend hat die Kammer Fotos vom Haus des Angeklagten - gefertigt am Tag der Durchsuchung - durch Augenschein in die Hauptverhandlung eingeführt. Die weiteren Feststellungen zu Einrichtung und Ausstattung beruhen auf dem Vollstreckungsprotokoll der Gerichts-
694vollzieherin vom 03.11.2017, das die Kammer durch Verlesen in dieHauptverhandlung eingeführt hat.
695Die in den Feststellungen genannten Spendenbeträge gründen sich ergänzend auf ein
696Schreiben des Verteidigers des Angeklagten, Rechtsanwalt S , vom 08.10.2014,mit dem dieser für den Angeklagten zu den Vorwürfen der Strafanzeige des Zeugen
697U des Jahres 2013 Stellung nahm. Dieses Schreiben, das die Spendenbeträge
698648
699einzeln aufführt, hat die Kammer durch Verlesen in die Hauptverhandlung eingeführt.
700Dass der Angeklagte nicht vorbestraft ist, folgt aus der Verlesung der Bundeszentral-registerauskunft vom 18.06.2018.
7013. Feststellungen zum Tatgeschehen
702Die Feststellungen zum Tatgeschehen beruhen teilweise auf den Angaben des Ange-
703klagten gegenüber Prof. S , soweit sie sich auf die regulären Abläufe in der Apo-theke beziehen und soweit die Kammer ihnen folgen konnte. Im Übrigen - namentlich zu den Unterdosierungen - beruhen die Feststellungen der Kammer auf den weiteren in die Hauptverhandlung eingeführten Beweismitteln und deren Würdigung. Die Angaben des Angeklagten sind insoweit zum Teil widerlegt.
704a) Feststellungen zum Laborbetrieb und zu den regulären Abläufen des Apotheken- und Reinraumlaborbetriebs
705Der Angeklagte selbst hat gegenüber Prof. S seine beiden großen Aufgabenbe-
706reiche des gewöhnlichen Apothekenbetriebs einerseits und des Betriebs des 2001 eröffneten Reinraumlabors andererseits beschrieben. Die Kammer folgt seinen Angaben in diesem Punkt. Sie werden von allen Mitarbeitern der Apotheke, die als Zeugen vernommen worden sind, einhelllig bestätigt.
707Zu Begriff, Verwendung, Wirkung und zu allen sonstigen Einzelheiten der parenteralen
708Arzneimittelzubereitungen, wie sie in der Apotheke hergestellt wurden, hat der
709Sachverständige Prof. Sch , Leiter der Inneren Klinik (Tumorforschung) des Univer-
710sitätsklinikums Essen und Hochschullehrer, den Feststellungen entsprechend ausgesagt. An seiner Fachkunde und der Richtigkeit seiner Angaben bestehen keine Zweifel.
711Der Angeklagte hat gegenüber Prof. S weiter den regulären Herstellungsprozess
712der parenteralen Arzneimittel in groben Zügen geschildert. Die Feststellungen dazu beruhen auf seinen Angaben, ergänzt durch die glaubhaften und detaillierten Aussa-
713gen der Zeugin K , als PTA Mitarbeiterin des Reinraumlabors seit März 2015
714sowie des Zeugen Dr. M , als Apotheker Mitarbeiter des Reinraumlabors von Ja-
715nuar bis Juni 2012. Sie stimmen insoweit überein mit der polizeilichen Aussage der
716![]() PTA H , eingeführt in die Hauptverhandlung durch Verlesen.
PTA H , eingeführt in die Hauptverhandlung durch Verlesen.
649
718H arbeitete von Oktober oder November 2011 bis zum 01.12.2014 im
719Reinraumlabor.
720Die Feststellungen zur erforderlichen „Freigabe“ der Zubereitungen, bevor die Fahrer
721sie mitnehmen durften, beruhen zunächst auf den Angaben des Zeugen dem
722Leiter des Fahrdienstes der Apotheke. Er hat die allmorgendliche Praxis ent-
723sprechend den Feststellungen der Kammer geschildert. Weder er noch ein anderer Fahrer habe jemals die parenteralen Arzneimittelzubereitungen aus dem Reinraumla-bor zur Auslieferung mitgenommen, ohne dass zuvor eine Freigabe durch einen Labormitarbeiter erfolgt sei. Insbesondere habe er auch nie Zubereitungen selbst einem
724der Kühlschränke entnommen. Die Apotheker E und Dr. M bestätigten dieseHandhabung für den Zeitraum ihrer Beschäftigung, ebenso die Zeugin K , die angegeben hat, gelegentlich selbst die Kontrolle vorgenommen und die Freigabe erteilt
725zu haben, was wiederum der Zeuge bestätigte.
726Aufgrund dieser Vielzahl an übereinstimmenden Angaben der Zeugen hat die Kammer keine Zweifel an ihrer Richtigkeit, zumal sie mit den Vorkommnissen am Morgen der Durchsuchung - geschildert durch die ermittelnden Polizeibeamten - im Einklang ste-
727hen: Der Labormitarbeiter F war der erste Mitarbeiter, der am Reinraum-
728labor erschien und die Türen öffnete. Die Fahrer der Apotheke erschienen erst
729zu einem späteren Zeitpunkt.
730Die Feststellungen zur räumlichen Situation der Apotheke und des Reinraumla-
731bors beruhen auf der detaillierten Beschreibung durch den Zeugen KHK H . Sie
732stimmt überein mit der Aussage der Zeugin KK’in G und des Sachverständigen
733L , den die Kammer insoweit als Zeugen vernommen hat. Die Inbetriebnahme
734des neuen Reinraumlabors zu Beginn des Jahres 2016 hat der Angeklagte selbst geschildert; sie wird bestätigt durch die Zeugenaussage der Amtsapothekerin
735![]() L , die die Inbetriebnahme begleitete und die Betriebsgenehmigungerteilte. Anders als der Angeklagte sich erinnerte, ist die Inbetriebnahme nicht auf Februar, sondern bereits auf Januar 2016 zu datieren. Zur örtlichen Situation hat die Kammer außerdem Fotos vom Tag der Durchsuchung in Augenschein genommen.
L , die die Inbetriebnahme begleitete und die Betriebsgenehmigungerteilte. Anders als der Angeklagte sich erinnerte, ist die Inbetriebnahme nicht auf Februar, sondern bereits auf Januar 2016 zu datieren. Zur örtlichen Situation hat die Kammer außerdem Fotos vom Tag der Durchsuchung in Augenschein genommen.
Die zentrale Stellung des Angeklagten in der Apotheke und insbesondere im
737Reinraumlabor während des Tatzeitraums ergibt sich im Wesentlichen bereits aus sei-
738nen eigenen Angaben gegenüber Prof. S . Die Kammer folgt dem. Denn dass er
739![]()
![]()
![]()
![]()
![]()
![]()
![]()

![]()
![]()
![]()
![]()
![]()
![]()

651
741gegenüber Prof. S zur Anzahl der von ihm hergestellten Zubereitungen: Mor-
742gens seien es „mindestens zehn, auch mal fünfzehn oder zwanzig“. Diese Zahlen sind deutlich zu niedrig angesetzt. Die Kammer nimmt an, dass der Angeklagte morgens
743regelmäßig rund 30 Zubereitungen produzierte. So schätzte der Zeuge Dr. M „vor-sichtig“, dass der Angeklagte von etwa 150 täglichen Zubereitungen mindestens 20 -
74430 % selbst herstellte, das wären 30 bis 45. Die Mitarbeiterin H hat in ihrerpolizeilichen Vernehmung davon gesprochen, der Angeklagte sei „sehr oft und regelmäßig“ in der Produktion gewesen, ohne dies allerdings näher zu quantifizieren. Legt
745man die Zahlen des Zeugen Dr. M zugrunde - Hinweise auf eine Änderung derArbeitspraxis nach dessen Ausscheiden aus der Apotheke gibt es nicht - ist bei gelegentlichem Produzieren nachmittags oder sonntags eine Zahl morgendlicher Zubereitungen von 30 realistisch.
746Die Kammer folgt dem Angeklagten weiter nicht darin, dass er morgens in erster Linie noch ausstehende Zubereitungen vom Vortag und Zubereitungen für den gleichen Tag mit kurzer Haltbarkeit hergestellt habe. Vielmehr produzierte er morgens zumindest einen Teil der Zubereitungen schon zur Auslieferung für den Folgetag oder für noch spätere Zeitpunkte (siehe näher unten III. 3. c) (6)).
747Der Angeklagte hat gegenüber dem Sachverständigen Prof. S im Zusammen-
748hang mit dem „Vier-Augen-Prinzip“ geäußert, dass es sich bei Engpässen ergeben habe, dass er Zubereitungen im Reinraumlabor „allein“ produziert habe. Die Kammer stellt hingegen fest, dass der Angeklagte stets allein ohne Anwesenheit anderer Personen die Zubereitungen herstellte. Dies beruht auf den Angaben des Zeugen Dr. M
749 ![]()
mend so geschildert haben. Die Zeugin K gab ergänzend an, in einigen Fällen habe
751der Angeklagte während der gewöhnlichen Laborzeiten zwischen 08:00 und 16:00 Uhr im Labor arbeiten wollen; die übrigen Mitarbeiter hätten dann die Räume verlassen
752müssen. Korrespondierend damit berichtete der Zeuge E (wenn auch für einen
753Zeitpunkt vor dem Tatzeitraum), es sei während seiner Tätigkeit in der Apotheke
754ein einziges Mal vorgekommen, dass der Angeklagte ihn angesprochen habe und mit
755ihm gemeinsam eine Zubereitung habe herstellen wollen. Dies habe ihn, E , sehrverwundert.
756652
757b) Feststellungen zu den Zubereitungen, die bis einschließlich 28.11.2016 hergestellt und ausgeliefert wurden
758Angaben des Angeklagten
759Der Angeklagte hat sich in der Hauptverhandlung zum Tatgeschehen nicht eingelas-
760sen. Gegenüber dem Sachverständigen Prof. S hat er lediglich angegeben, sichdie Differenz zwischen Einkaufsmengen und Herstellungsmengen nicht erklären zu
761können. Die Vorwürfe der Unterdosierungen aus der Strafanzeige des U auf dem Jahr 2013 hat der Angeklagte - als damaliger Beschuldigter - durch Schreiben
762des Rechtsanwalts S vom 08.10.2014, das die Kammer durch Verlesen gemäߧ 249 Abs. 1 StPO in die Hauptverhandlung eingeführt hat, energisch zurückweisen lassen.
763Fehlende Ergiebigkeit von Zeugenaussagen
764![]() In der Beweisaufnahme hat keiner der als Zeugen vernommenen Mitarbeiter der Apotheke eingeräumt, eigenhändig Unterdosierungen vorgenommen oder Unterdosierungen durch den Angeklagten oder durch andere Mitarbeiter oder Anweisungen hierzu wahrgenommen zu haben. Das Gleiche gilt für Aussagen in polizeilichen Vernehmungen, die die Kammer in die Hauptverhandlung eingeführt hat. Unergiebig wa-
In der Beweisaufnahme hat keiner der als Zeugen vernommenen Mitarbeiter der Apotheke eingeräumt, eigenhändig Unterdosierungen vorgenommen oder Unterdosierungen durch den Angeklagten oder durch andere Mitarbeiter oder Anweisungen hierzu wahrgenommen zu haben. Das Gleiche gilt für Aussagen in polizeilichen Vernehmungen, die die Kammer in die Hauptverhandlung eingeführt hat. Unergiebig wa-
ren ferner Aussagen weiterer Zeugen aus dem Umfeld der Apotheke.
766![]() Zahlreiche Mitarbeiter des Reinraumlabors der Apotheke, nämlich die Mitarbeiter F
Zahlreiche Mitarbeiter des Reinraumlabors der Apotheke, nämlich die Mitarbeiter F
![]()
![]() r, S , G , S , W , C ( ) und
r, S , G , S , W , C ( ) und
H |
haben in der Hauptverhandlung erst gar nicht ausgesagt. Sie haben |
von ihrem umfassenden Auskunftsverweigerungsrecht gemäß § 55 StPO Gebrauch gemacht. Daraus ist nichts abzuleiten.
770Der Mitarbeiter F hat gleichwohl eine so bezeichnete Stellungnahme mit
771Datum vom 30.04.2018 abgegeben, die die Verteidigung in der Hauptverhandlung einem Antrag beigefügt hat (Protokoll vom 04.05.2018, Anlage V). Die Kammer hat die Stellungnahme durch Verlesen gemäß § 249 Abs. 1 StPO und durch Inaugenschein-nahme der Unterschrift in die Hauptverhandlung eingeführt. Sie verhält sich allerdings
772653
773nicht unmittelbar zu möglichen Unterdosierungen, sondern bezieht sich auf die Aus-
774sage des Zeugen P in der Hauptverhandlung (siehe dazu unten).
775Die Aussagen weiterer Mitarbeiter des Reinraumlabors in der Hauptverhandlung waren mit Blick auf mögliche Unterdosierungen unergiebig:
776Die Zeugin K - im Reinraumlabor als PTA tätig seit März 2015 - konnte zu
777konkreten Fällen von Unterdosierungen oder Beobachtungen hierzu keine Angaben machen. Ihr Verdacht auf Manipulationen gründete sich auf die bedenkliche Handhabung der Hygienemaßnahmen durch den Angeklagten (dazu sogleich) und auf allge-
778mein gehaltene Gerüchte unter den Mitarbeitern der Apotheke.
779Der Zeuge Dr. M - als Apotheker von Januar bis Juni 2012 im Reinraumlabor tätig
780- hat nach seinen Angaben weder selbst unterdosierte Zubereitungen hergestellt noch sei er vom Angeklagten dazu angewiesen worden. Konkrete Beobachtungen zu Unterdosierungen durch den Angeklagten oder andere Mitarbeiter habe er nicht gemacht. Es habe allerdings Gerüchte unter den Mitarbeitern gegeben, Zubereitungen für Angehörige nicht durch den Angeklagten herstellen zu lassen.
781Der Zeuge E hat für den Zeitraum seiner Beschäftigung (April 2009 bis September
7822010, also vor dem Tatzeitraum) angegeben, konkrete Beobachtungen zu Unterdosierungen durch den Angeklagten oder andere Mitarbeiter habe er nicht gemacht; dies habe auch an seinem fehlenden Einblick in die Bestellungen gelegen. Eine Anweisung des Angeklagten oder eines anderen Mitarbeiters, Unterdosierungen vorzunehmen, habe er nicht erhalten. Er habe sich allerdings gewundert, dass Zubereitungen mit monoklonalen Antikörpern oftmals bereits morgens für den Folgetag fertiggestellt gewesen seien. Das sei ihm mit Blick auf die begrenzte Haltbarkeit der Zubereitungen und die Möglichkeit, dass ein behandelnder Arzt für einen Patienten kurzfristig absage, risikoreich erschienen. Außerdem habe sich in den Anbrüchen im Kühlschrank oft mehr Wirkstoff befunden, als er im Hinblick auf die bereits fertiggestellten Zubereitungen erwartet hätte.
783Die Mitarbeiterin H gab in ihrer polizeilichen Vernehmung im Ermittlungs-
784verfahren - eingeführt in die Hauptverhandlung durch Verlesen - an, von Ende 2011 bis zum 01.12.2014 im Reinraumlabor der Apotheke als PTA beschäftigt gewesen zu sein. Sie habe zu keinem Zeitpunkt mit dem Angeklagten gemeinsam eine parenterale
785654
786Arzneimittelzubereitung hergestellt und habe mithin auch keine Unterdosierung beobachtet. Sonstige Beobachtungen zu Unterdosierungen habe sie ebenfalls nicht gemacht.
787Die Zeugin M war von 2007 bis 2017 (mit einer kurzen Unterbrechung
788von einigen Wochen) als PTA in der Apotheke tätig, jedoch zählte das Reinraum-labor nicht zu ihrem Aufgabenbereich. Sie wusste ebenfalls allein von vagen Gerüchten zu berichten; konkrete Beobachtungen habe sie selbst nicht gemacht. Auch die
789Zeugin S , eine angestellte Apothekerin, die seit 2013 in derApotheke im Handverkauf tätig war, konnte keine Beobachtungen zu Unterdosierungen oder sonstigen Unregelmäßigkeiten schildern.
790Der Zeuge P , der als kaufmännischer Leiter seinen Arbeitsplatz außerhalb des
791Reinraumlabors hatte, hat - mit Ausnahme seiner eigenen „Ermittlungen“ und einer Beobachtung zum fehlerhaften Einpflegen von Lieferungen in die EDV durch den Angeklagten - lediglich ausgeführt, er habe mehrfach gerüchteweise gehört, dass im Labor der Apotheke etwas nicht ordnungsgemäß ablaufe. So habe er von der Strafan-
792zeige des U erfahren. Diese sei auch der Grund für seine weiteren "Ermitt-lungen" gewesen.
793P berichtete weiter, der Steuerberater der Apotheke habe sich über die
794hohen Gewinne erstaunt gezeigt. Die Mitarbeiterin H habe ihm anlässlichihrer Kündigung gesagt, sie gehe davon aus, dass die Hälfte der Spritzen mit Xgeva (Wirkstoff Denosumab) nicht ordnungsgemäß sei. Dies hatte die Mitarbeiterin H s im Rahmen ihrer polizeilichen Vernehmung hingegen nicht ausgesagt.
795![]() P berichtete weiter, er könne sich noch an den Inhalt eines Gespräch bei der
P berichtete weiter, er könne sich noch an den Inhalt eines Gespräch bei der
Weihnachtsfeier 2014 erinnern: Er habe dem Mitarbeiter F , der in das
797Reinraumlabor versetzt worden sei, gesagt, er solle dort auf sich aufpassen. Eine PTA
798K habe ihm dazu beigepflichtet, was ihn, P verwundert habe. Jedoch habeer nicht nachgehakt.
799Weiter habe ihm F am Tag der Durchsuchung gesagt, die Wahrscheinlich-
800keit, dass in den sichergestellten Zubereitungen Wirkstoff enthalten sei, liege bei null
801Prozent. Auch seien bei anderer Gelegenheit in einem Gespräch F s mit
802der Zeugin K und der Mitarbeiterin S die Worte gefallen, dass „Wirkstoff in
803Therapien hereingezaubert“ würde. F hat all dies in seiner vorgenannten
804655
805"Stellungnahme" vom 30.04.2018 in Abrede gestellt.
806Die Amtsapothekerin L hat als Zeugin ausgeführt, die Apothekenaufsicht habe
807![]() im Tatzeitraum keine Proben der in der
im Tatzeitraum keine Proben der in der
Apotheke hergestellten patientenindivi-
809duellen parenteralen Arzneimittelzubereitungen genommen und analysiert (vgl. bereits oben). Es habe auch sonst keine Verdachtsmomente gegen den Angeklagten gegeben. Ihre Aussage war damit ebenfalls unergiebig.
810Die Angaben des Zeugen U , der die Strafanzeige im Jahr 2013 erstattet
811hatte, waren ebenfalls nicht ergiebig und im Übrigen auch nicht glaubhaft. U hatbei seiner Vernehmung durch die Kammer angegeben, die Strafanzeige gegen den
812Angeklagten auf Grundlage von Angaben seiner geschiedenen Ehefrau C -Mitarbeiterin des Reinraumlabors - ihm gegenüber gestellt zu haben. Sie habe ihm mitgeteilt, der Angeklagte arbeite unsauber, so habe er keine Schutzkleidung getragen.
813Die weiteren Angaben des Zeugen U zu den möglichen Unterdosierungen von
814Arzneimitteln waren pauschal gehalten. Seine geschiedene Ehefrau habe ihm davon berichtet. Einzelheiten konnte er nicht benennen. Die Kammer schließt insoweit nicht
815aus, dass C gegenüber U von Unregelmäßigkeiten gesprochen hat, greif-bare Feststellungen sind dazu aber nicht möglich.
816Die Aussage U s war auch im Übrigen nicht ergiebig und nicht glaubhaft: Der
817Zeuge U erhob - im Unterschied zu seiner polizeilichen Vernehmung vom
81810.04.2014 - hingegen neue Vorwürfe gegen den Angeklagten, die bisher nicht Gegenstand seiner Angaben waren. So wusste er plötzlich von "Rückläufern" zu berichten, die erneut verwendet worden seien. Dazu hatte er bei seiner Vernehmung am 10.04.2014 keine Angaben gemacht. Details konnte er hier ebenfalls nicht nennen.
819Anzunehmen ist, dass U die Information der Medienberichterstattung zu demVerfahren entnommen hatte.
820Die Mitarbeiterin C ist im früheren Ermittlungsverfahren gegen den Angeklagten
821am 21.08.2014 polizeilich vernommen worden. Ausweislich des in der Hauptverhandlung verlesenen Protokolls der Vernehmung antwortete sie auf die Frage, ob "Herr
822S " bei der Herstellung und Verwendung von Zytostatika aus finanziellenGründen Manipulationen vorgenommen habe, dies sei nicht der Fall. Es sei auch nicht möglich, da „das Medikament nicht ausreichend wirken würde.“
823656
824Die Kammer hat diese Aussagen, insoweit sie hier zusammenfassend referiert sind, nicht zu Lasten des Angeklagten gewertet. Auf bloße Gerüchte, deren Herkunft im Einzelnen nicht näher benannt wurde, oder auf vage Angaben vom Hörensagen kann
825eine Verurteilung nicht gestützt werden. Zu weiteren Angaben des Zeugen P undzu einer möglichen entlastenden Wertung siehe unten.
826Keine Rückschlüsse aus dem Behandlungsverlauf einzelner Patienten oder statistischen Auswertungen einer Vielzahl von Behandlungsverläufen
827Aus den Behandlungsverläufen einzelner Patienten, die im Tatzeitraum parenterale
828Arzneimittelzubereitungen aus der Apotheke erhielten, konnte die Kammer keineRückschlüsse auf eine Unterdosierung von Zubereitungen ziehen. Sie hat sich dazu
829sachverständig durch den Onkologen Prof. Dr. med. Sch beraten lassen.
830Der Sachverständige Prof. Sch ist seit zehn Jahren Leiter der Inneren Klinik (Tu-
831morforschung) des Universitätsklinikums Essen und als Hochschullehrer tätig. Insgesamt verfügt er über 26 Jahre Erfahrung auf dem Gebiet der Tumorforschung.
832Der Sachverständige gab an, dass es keine verlässlichen Mittel und Wege gebe, in der Vergangenheit liegende Unterdosierungen onkologischer Wirkstoffe bei einzelnen Patienten nachträglich nachzuweisen oder sicher zu erkennen:
833Dies gelte zunächst für die Ergebnisse einer bestimmten Behandlung eines einzelnen Patienten. Die Komplexität onkologischer Behandlungen und die unterschiedliche Wirkweise onkologischer Arzneimittel sowie die patientenindividuelle Reaktion auf diese Arzneimittel verböten jeglichen Rückschluss vom Ergebnis einer einzelnen Behandlung auf einen konkret verabreichten Wirkstoff oder dessen Dosis. Ein typischer Ausgang sei für eine Behandlung nie vorherzusagen. Weiter gebe es keine verlässlichen wissenschaftlichen Daten oder Studien, die Auskunft zu den Auswirkungen einer Verringerung der empfohlenen Wirkstoffdosis geben könnten. All dies gelte umso mehr, als moderne Krebsbehandlungen durch die Kombination verschiedener Wirkstoffe gekennzeichnet seien. Das Behandlungsergebnis werde insoweit bestimmt durch die Wirkweise verschiedener Arzneimittel.
834Weiter verspreche auch die Auswertung bestimmter Messdaten einzelner Patienten keinen Erfolg: So genannte Tumormarker, also Eiweiß- oder Eiweißzuckerstoffe, die im Blut nachweisbar seien und mit der Menge an Tumorzellen im Körper korrelierten,
835657
836würden keinen verlässlichen Anhaltspunkt für die Höhe der verabreichten Dosis eines Wirkstoffs geben. Die Werte ließen allenfalls einen Rückschluss darauf zu, ob eine Medikation grundsätzlich Wirkung entfalte. Sofern eine solche Wirkung nicht feststellbar sei, müsse dies aber nicht zwangsläufig auf das Fehlen von Wirkstoff, sondern könne auch auf die fehlende Wirksamkeit der Medikation trotz ordnungsgemäßer Dosierung zurückzuführen sein.
837Abbauprodukte onkologischer Wirkstoffe seien regelmäßig nur für wenige Stunden im Blut nachweisbar. Selbst bei einer so kurzfristigen Blutentnahme erlaube ein bei einem Patienten gemessener Wert aber allenfalls Rückschlüsse auf erhebliche Unterdosierungen oder ganz fehlenden Wirkstoff.
838Aus dem Ausbleiben von Nebenwirkungen (Haarausfall, starke Übelkeit, Durchfall, Schäden der inneren Organe oder Lähmungen durch Nervenschäden) bei einzelnen Patienten sei ebenfalls ein Rückschluss auf eine Wirkstoffgabe oder die Wirkstoffdosis nicht möglich. Das Ausbleiben von Nebenwirkungen könne vielfältige Ursachen haben. Dies sei je nach Patient sehr unterschiedlich, eine pauschale Annahme, dass eine Nebenwirkung nach einer Wirkstoffgabe auftrete, sei nicht möglich. So sei es auch bei sogenannten Therapielinien nicht unüblich, dass diese gewechselt würden, wenn ein Erfolg bzw. eine Wirkung nicht mehr zu verzeichnen sei. Ein weiterer Unsicherheitsfaktor sei die verzögerte Reaktion bzw. Wirkung von Medikamenten.
839Weiter würden insbesondere monoklonale Antikörper, so Cetuximab und Trastuzu-mab, oftmals zur Vermeidung eines Rückfalls eingesetzt. In diesen Fällen könne allein aus einem Rückfall oder dem Ausbleiben eines Rückfalls bei einem einzelnen Patienten nicht auf die Wirkstoffgabe oder die Wirkstoffdosis geschlossen werden.
840Äußerlich seien Unterdosierungen bzw. das völlige Fehlen eines Wirkstoffs in einer einzelnen Zubereitung allenfalls im Falle farbiger Wirkstoffe zu erkennen. Nur die wenigsten Wirkstoffe seien jedoch farbig, so habe der Wirkstoff Doxorubicin eine rote Farbe. Doch selbst dann sei bei einer bloßen Unterdosierung ein farblicher Unterschied zur richtigen Dosierung optisch nur schwer erkennbar.
841Auch eine Auswertung der Behandlungsverläufe und Patientendaten aller Patienten,
842die Arzneimittelzubereitungen aus der Apotheken erhalten haben - faktisch oh-nehin nicht durchführbar - , könne wegen der statistischen Ungenauigkeiten keine si-
843658
844cheren Angaben zu Unterdosierungen erbringen. Allenfalls seien Wahrscheinlichkeitsaussagen möglich.
845Schließlich führe auch die Beurteilung eines behandelnden Arztes zu den Behandlungserfolgen seiner Patienten nicht weiter. Ein behandelnder Arzt könne allenfalls eine subjektive Einschätzung abgeben. Selbst bei einer großen Praxis sei im Übrigen die Zahl der Patienten zur Bildung einer "Testgruppe" zu gering (im Vergleich zu wissenschaftlichen Studien), um verlässliche Aussagen zu möglichen Unterdosierungen zu treffen, zumal nach verschiedenen Krebsarten und Krankheitsstadien differenziert werden müsse.
846Die Kammer folgt der Bewertung des Sachverständigen Prof. Sch . Der Sachver-
847ständige verfügt aufgrund seiner langjährigen Tätigkeit auf dem Gebiet der Tumorforschung über die erforderliche Sachkunde. Seine Ausführungen waren detailliert und plausibel. Nachfragen zur Wirksamkeit und Wirkweise onkologischer Wirkstoffe hat er nachvollziehbar beantwortet.
848Vor dem Hintergrund der Aussage des Sachverständigen Prof. Sch hat die Kam-
849mer davon abgesehen, einzelne Patienten oder behandelnde Ärzte als Zeugen zu vernehmen oder die Patientenunterlagen einzelner Patienten sachverständig untersuchen zu lassen.
850Keine Rückschlüsse aus Herstellungsdaten des EDV-Programms "Zenzy" oder Herstellungsprotokollen
851Anhand der Herstellungsdaten des EDV-Programms "Zenzy" oder der Herstellungsprotokolle, die sich auf Zubereitungen im Tatzeitraum beziehen, sind keine Feststellungen zu den tatsächlichen Dosierungen einzelner Zubereitungen zu treffen. Die Herstellungsdaten des EDV-Programms Zenzy, die auf den ausgedruckten Etiketten erscheinen, bilden bestimmungsgemäß jeweils die Soll-Dosierung einer Zubereitung ab. Die Herstellungsprotokolle sollten theoretisch nicht die Soll-Dosierung wiedergeben, sondern den tatsächlichen Herstellungsvorgang dokumentieren. Bei korrekter Anfertigung müssten sie also eine etwaige Unterdosierung ausweisen. Die Beweisaufnahme hat allerdings (nicht überraschend) keinerlei Hinweise auf dokumentierte Unterdosierungen ergeben.
852659
853Vergleich der Einkaufsmengen der Wirkstoffe mit den dokumentierten Herstellungsmengen
854Die Kammer hat die Feststellungen zu den Unterdosierungen daher auf andere Weise getroffen. Sie hat - für jeden Wirkstoff separat - die Einkaufsmengen der Wirkstoffe mit den dokumentierten Herstellungsmengen verglichen. Im Falle von Fehlmengen hat sie eine Mindestzahl unterdosierter Zubereitungen errechnet. Zugunsten des Angeklagten hat sie dabei mit erheblichen Sicherheitsmargen gearbeitet.
855(1) Feststellungen zu den eingekauften Wirkstoffmengen
856Die Feststellungen der Kammer zu den eingekauften Wirkstoffmengen beruhen auf
857den glaubhaften Angaben des Ermittlungsbeamten T , teilweise ergänzt durch die
858Angaben des Zeugen KHK H .
859Der Zeuge T ist als Diplom-Betriebswirt beim Polizeipräsidium Recklinghausen
860mit der Bearbeitung von Fragen mit wirtschaftlichem Bezug befasst. Die Ermittlung der
861Mengen der eingekauften Wirkstoffe durch die Apotheke war im Rahmen der Er-mittlungen seine Aufgabe.
862Die Kammer ist überzeugt, dass der Zeuge T die (nachfolgend näher dargestell-
863ten) Einkaufsmengen zutreffend ermittelt hat:
864Gang der Ermittlungen
865Der Zeuge T hat glaubhaft den Gang und die Ergebnisse seiner Ermittlungen
866geschildert. Dazu hat er ausgeführt, dass bei der Durchsuchung der Apotheke
867zunächst die Buchhaltungsunterlagen mit den Lieferscheinen und Rechnungen der vergangenen Jahre, namentlich der Jahre 2012 bis zum Tag der Durchsuchung am 29.11.2016, sichergestellt worden seien. Diese Buchhaltungsunterlagen zum Wareneingang hätten zur Ermittlung derjenigen Lieferanten gedient, die die Wirkstoffe für die
868parenteralen Arzneimittelzubereitungen an die Apotheke lieferten. Die Namen derverwendeten Wirkstoffe seien anhand einer Wirkstoffliste, die über das EDV-Programm Zenzy erstellt worden sei, ermittelt worden. Die Arbeit mit dem Programm Zenzy sei in einer virtuellen Arbeitsumgebung erfolgt (dazu sogleich).
869![]()
![]()
![]()
![]()

![]()

![]()
![]()

![]()


![]()
661
871Der Zeuge T hat im Übrigen überzeugend ausgeführt, dass ein Ermitteln der
872Einkaufsmengen allein über das Warenwirtschaftsprogramm Prokas oder das Doku-
873mentationsprogramm Zenzy der Apotheke nicht zuverlässig möglich gewesenwäre:
874Mit dem Warenwirtschaftsprogramm Prokas sei zwar ein Abgleich der ermittelten Mengen erfolgt. Dieser habe aber ergeben, dass einige Lieferungen nicht erfasst gewesen seien. Dass die Warenbestände in Prokas (sie umfassten alle Arzneimittel der Apotheke) nicht ordnungsgemäß gepflegt worden seien, haben - insoweit konform mit den
875Angaben des Zeugen T - andere Zeugen bestätigt, namentlich die Zeugin K .Es habe nämlich keinen Mitarbeiter gegeben, der fest für das Einpflegen der Warenlieferungen zuständig gewesen sei.
876Die Warenbestände im Programm Zenzy waren nach dem weiteren Ergebnis der Beweisaufnahme erst recht nicht ordnungsgemäß gepflegt, wobei es keine Schnittstelle zu Prokas gab, so dass die für die Zubereitungen verwendeten Arzneimittel (unprakti-scherweise) manuell in beide Programm, also doppelt, einzutragen waren. Die Ermitt-
877lungsbeamtin KKin G hat überzeugend ausgeführt, dass Zenzy am Tag derDurchsuchung für eine Vielzahl von Wirkstoffen Minusbestände aufgewiesen habe, die
878es real nicht gegeben haben kann. Dies haben die Zeugen K und P für wei-tere Zeitpunkte glaubhaft bestätigt.
879Der Angeklagte selbst hat bei seiner Exploration durch den Sachverständigen Prof.
880S angegeben, dass prinzipiell zwar die Lagerbestände „im PC“ hinterlegt gewe-sen seien, die Dokumentationen und Bestände aber offensichtlich nicht richtig gepflegt worden seien. In der Praxis sei es im Wesentlichen über eine "Sichtkontrolle" gegangen.
881Die Kammer stuft die in der Apotheke geführten elektronischen Aufzeichnungen
882der Warenbestände damit insgesamt als unzuverlässig ein. (An dieser Stelle ist allerdings zu betonen, dass sich die Unzuverlässigkeit von Zenzy allein auf die hinterlegten Warenbestände bezieht, während die Arzneimittelzubereitungen lückenlos dokumentiert waren. Denn ohne die Dokumentation einer Zubereitung konnte kein Etikett [siehe dazu oben] ausgedruckt werden, so dass ein Herstellen und Etikettieren der Zubereitung unmöglich gewesen wäre.)
883662
884Verlässlichkeit der Angaben der Lieferanten
885Die Kammer ist überzeugt, dass die Angaben der Lieferanten vollständig und inhaltlich zutreffend sind. Derartige Auflistungen werden in modernen Unternehmen nicht durch ein fehlerträchtiges manuelles Zusammenstellen von Rechnungen oder Lieferscheinen generiert, sondern beruhen auf einer automatisierten Auswertung von EDV-geführten Buchhaltungskonten. Im Übrigen sind (marginale) Fehler bereits im Ermitt-
886lungsverfahren (siehe vorstehend zur Ergänzung des Lieferanten zu Borte-zomib und Temserolimus) bzw. in der Hauptverhandlung (siehe unten zu Pemetrexed und Vinflunin) aufgefallen und korrigiert worden.
887Sofern darüber hinaus noch Fehler unentdeckt geblieben sein sollten, trägt die Kammer dem durch einen pauschalen Sicherheitszuschlag auf die Einkaufsmengen Rechnung, siehe dazu sogleich.
888Keine unbekannten Bezugsquellen
889Die Verteidiger R und P haben im Zwischenverfahren mit Schriftsatz
890vom 31.08.2017 behauptet, der Angeklagte habe „nach Kenntnis der Verteidigung“ außerhalb des „offiziellen Lieferbezugs“ verfahrensrelevante Wirkstoffe (insoweit nicht näher bezeichnet) eingekauft und mit „versteuertem Privatgeld“ bezahlt; auf die Geltendmachung von Betriebsausgaben sei insoweit verzichtet worden. So seien allein
891im Jahr 2014 der Kasse der Apotheke 243.079,38 EUR Bargeld alsPrivatentnahmen entnommen worden. Insbesondere habe ein Außendienst-
892mitarbeiter H [richtig: H ] der AG Wirkstoffe unter Marktpreis „ausdem Kofferraum“ heraus gegen Barzahlung verkauft. Dazu habe man sich in der Apotheke, aber auch in Parkhäusern getroffen.
893Die Beweisaufnahme hat für derartige Geschäfte keinerlei Anhaltspunkte ergeben. Ins-
894besondere der Zeuge P als kaufmännischer Leiter der Apotheke hat erklärt, ihmsei von solchen „Schwarzeinkäufen“ nichts bekannt.
895Der Zeuge H hat sinngemäß bekundet, dem Angeklagten keinerlei Zytostatika
896auf eigene Rechnung geliefert zu haben. Er habe lediglich als Verkaufsmitarbeiter
897(„Pharmareferent“) des Generika-Herstellers AG Kontakt zum Angeklagten ge-habt. Die Kammer erachtet diese Aussage als glaubhaft: Der Zeuge hat nachvollziehbar erklärt, als Pharmareferent sei es seine Aufgabe, Geschäfte anzubahnen und zu
898663
899vermitteln. Mit den Zytostatika-Produkten komme er selbst überhaupt nicht in Kontakt. Diese Produkte würden mit speziellen Kühltransportern ab Werk in Magdeburg unmittelbar zu den Empfängern transportiert. Ihm sei ferner die Lieferung von Arzneimitteln in erheblicher Größenordnung mit seinem Pkw rein praktisch nicht möglich und sie wäre auch unzweckmäßig, da wegen der Toxizität der Produkte höchst gefährlich.
900An der Einschätzung der Kammer ändert es nichts, dass die Beweisaufnahme ergeben
901hat, dass der Angeklagte dem Zeugen H im Jahr 2016 Haushaltsgeräte im Wertvon rund 7.700 Euro auf eigene Kosten liefern ließ. Es spricht einiges dafür, dass diese
902Sachleistung andere Gründe hatte. Der Zeuge H hat insoweit - nach Hinweisauf §§ 299 StGB, 55 StPO - weitere Angaben verweigert.
903Sicherheitszuschläge
904Die Kammer hat zugunsten des Angeklagten durch pauschale Sicherheitszuschläge auf die Einkaufsmengen verschiedene Umstände berücksichtigt:
905Zunächst sind kleinere Fehler bei den Angaben der Lieferanten nicht völlig auszuschließen (vgl. oben), obwohl die Beweisaufnahme hierfür keine konkreten Anhaltspunkte gegeben hat.
906Weiter mag es in Einzelfällen bei der Anlieferung von Wirkstoffen zu „Bruchware“ ge-
907kommen sein. Die Zeugen P , K |
- |
und K - alle befasst mit der |
Entgegennahme von Arzneimittellieferungen - haben dazu übereinstimmend ausge-
909sagt, dies sei vorgekommen, wenn auch äußerst selten. Der Zeuge P hat er-gänzt, die Bruchware falle bereits unter die „Retouren“, so dass sie - so die Folgerung der Kammer - bereits in den Auskünften der Lieferanten berücksichtigt ist. Aus Vorsichtsgründen setzt die Kammer die seltenen Einzelfälle von Bruchware als Faktor bei der Bemessung des Sicherheitszuschlags an.
910Weiter mag es in Einzelfällen dazu gekommen sein, dass es bei vermeintlichen Re-touren tatsächlich nicht zur Rücksendung der Ware kam, weil der Händler oder Hersteller auf diese Weise einen verdeckten Rabatt geben wollte. Ein solches Vorgehen hatte die Verteidigung - freilich ohne nähere Substantiierung - behauptet. Die Beweisaufnahme hat dazu nichts Greifbares ergeben. Aus Vorsichtsgründen setzt die Kammer auch solche Einzelfälle als Faktor bei der Bemessung des Sicherheitszuschlags an.
911664
912Die Kammer hat als weiteren Faktor berücksichtigt, dass die gelieferten Verpackungseinheiten der Wirkstoffe in einigen Fällen eine geringfügige Überschreitung der ange-
913gebenen Füllmenge aufwiesen. Dies hat die Zeugin K ebenso bestätigt, wie die
914Mitarbeiterin H bei ihrer polizeilichen Vernehmung. Die Zeugin K hatallerdings weiter ausgeführt, dass diese „Überfüllung“ in der Herstellungspraxis nicht dazu führe, dass eine entsprechend größere Wirkstoffmenge zur Verfügung stehe, sondern die „Überfüllung“ vielmehr dadurch ausgeglichen werde, dass die Wirkstoff-behältnisse faktisch nicht rückstandsfrei geleert werden könnten. Aus Vorsichtsgründen setzt die Kammer dennoch auch „Überfüllungen“ als Faktor bei der Bemessung des Sicherheitszuschlags an.
915Bei einzelnen Wirkstoffen verfügte der Angeklagte über zusätzliche Wirkstoffmengen, die ihm als so genannte Studienware (im Rahmen wissenschaftlicher Anwendungsstu-
916dien) zur Verfügung gestellt wurden, wie etwa die Zeugin K und der Zeuge E übereinstimmend angegeben haben. Insoweit handelte es sich um gesondert angelie-
917ferte und verbuchte Ware, die nicht in die von vom Zeugen T ermittelten Ein-kaufsmengen eingeflossen ist. Da nicht völlig auszuschließen ist, dass der Angeklagte Restmengen der Studienware wiederum für die verfahrensgegenständlichen Arzneimittelzubereitungen verwendet hat, hat die Kammer dies als Faktor bei der Bemessung des Sicherheitszuschlags angesetzt.
918Die Kammer hat weiter festgestellt, dass der Angeklagte in einem einzelnen Fall im September 2016 entgegen § 52a AMG eine Lieferung des Wirkstoffs Vinflunin nicht über einen Großhändler mit einer entsprechenden Lizenz erhielt, sondern über den
919Apotheker N aus Gröbenzell im Wege eines so genannten Nottausches oderNotgeschäftes. Dabei handelt es sich um die kurzfristige Überlassung eines Wirkstoffes, der typischerweise selten verschrieben und deshalb nicht vorrätig gehalten wird. Die Beweisaufnahme hat keine Hinweise ergeben, dass es neben dieser Überlassung
920des Wirkstoffes Vinflunin durch den Apotheker N - diese Lieferung hat die Kam-
921mer der ermittelten Einkaufsmenge des Zeugen T zugerechnet (siehe dazu so-
922gleich zum Wirkstoff Vinflunin) - oder einen anderen Apotheker zu weiteren Notgeschäften gekommen ist. Aus Vorsichtsgründen setzt die Kammer auch solche nicht völlig auszuschließenden weiteren Einzelfälle als Faktor bei der Bemessung des Sicherheitszuschlags an.
923665
924Die Kammer hat weiter festgestellt, dass der Verband der Zytostatika herstellenden Apotheker eine so genannte Tauschbörse für den Kauf oder Tausch von Wirkstoffen unterhielt. Auch hier hat die Beweisaufnahme zu konkreten Ankäufen des
925Angeklagten, der Mitglied des Verbandes war, nichts ergeben. Der Zeuge P ,der im Rahmen seiner buchhalterischen Tätigkeit Einblick in die Lieferwege der Apotheke hatte, gab überzeugend und nachvollziehbar an, dass der Angeklagte dort nur sehr selten tätig gewesen sei, es sei aber auch bei solchen Annahmen oder Abgaben eine buchhalterische Erfassung der Kauf- oder Tauschgeschäfte erfolgt. Aus Vorsichtsgründen setzt die Kammer auch solche nicht völlig auszuschließenden weiteren Einzelfälle als Faktor bei der Bemessung des Sicherheitszuschlags an.
926Weiter ist es in der Apotheke vereinzelt zur Umetikettierung und Wiederverwen-
927dung von so genannten „Rückläufern“ gekommen, wie die Zeugin K glaubhaft be-
928richtet hat. Bei einem „Rückläufer“ handelte es sich um eine ausgelieferte onkologi-sche Zubereitung des Angeklagten, die tatsächlich in der verordnenden Arztpraxis nicht zur Verwendung kam und aus diesem Grund zur Vernichtung an die Apotheke
929des Angeklagten zurückgegeben wurde. Solche Rückläufer wurden in der Apo-theke bisweilen für andere Patienten weiterverwendet und dazu neu etikettiert. So war es möglich, mit einer einfachen Wirkstoffmenge die doppelte Anzahl von Zubereitungen zu erreichen. (Diese Verfahrensweise ist selbstverständlich verboten, da der Apotheker die ordnungsgemäße Behandlung und Lagerung der Zubereitungen außerhalb der Apotheke nicht gewährleisten kann.) Konkrete Fälle der Umetikettierung und Wiederverwendung solcher Rückläufer konnte die Kammer nicht feststellen. Es handelte
930sich nach den Angaben der Zeugin K um Einzelfälle. Aus Vorsichtsgründen setztdie Kammer auch solche Einzelfälle als Faktor bei der Bemessung des Sicherheitszuschlags an.
931Die Kammer hat als weiteren Faktor bei der Bemessung des Sicherheitszuschlags berücksichtigt, dass bei denjenigen Wirkstoffen, die zum 01.01.2012 bereits auf dem Markt waren, Wirkstoffe als Lagerbestand vorhanden gewesen sein können, die sodann während des Tatzeitraums verwendet worden sind. Den Anfangsbestand zum
932Stichtag 01.01.2012 zu ermitteln, war nicht möglich, wie der Zeuge KHK H mitge-teilt hat. Denn weder das Warenwirtschaftsprogramm Prokas noch das Dokumentationsprogramm Zenzy würden einen stichtagsbezogenen Abruf des Warenbestandes
933666
934vorsehen; einmal abgesehen von der beschriebenen Unzuverlässigkeit der gespeicherten Daten (vgl. oben).
935Die Kammer ist aber überzeugt, dass sich der Anfangslagerbestand der Wirkstoffe zum 01.01.2012 und der (bedauerlicherweise von der Polizei nicht ermittelte) Endbestand zum 29.11.2016 weitgehend ausgleichen. Die Beweisaufnahme hat nämlich keine Hinweise darauf gegeben, dass es zum 01.01.2012 eine ungewöhnlich hohe Lagermenge gegeben haben könnte. Ganz im Gegenteil: Gerade in dem Apotheken-
936gebäude in der 32, in dem das Reinraumlabor zum damaligen Zeitpunktnoch untergebracht war, herrschte nach Zeugenaussagen eklatanter Platzmangel;
937dies war einer der Gründe für den Umzug in das neue Labor in der 37. DieLagerkapazitäten waren also beschränkt. Weiter ist ein hoher Lagerbestand wirtschaftlich nicht zweckmäßig, weil die Wirkstoffe nur begrenzt haltbar sind und sich die Einkaufspreise für Arzneimittel (mit Blick etwa auf das Ablaufen von Patentfristen) tendenziell im Zeitablauf reduzieren.
938Zugunsten des Angeklagten hat die Kammer dennoch bei den Wirkstoffen, die bereits vor dem 01.01.2012 zugelassen waren, den unbekannten Anfangsbestand als Faktor bei der Bemessung des Sicherheitszuschlags angesetzt.
939Zugunsten des Angeklagten hat die Kammer weiter unterstellt, dass der Angeklagte bzw. seine Mitarbeiter die gelieferten Wirkstoffmengen restlos für die Herstellung von Arzneimittelzubereitungen verwendeten: Insbesondere hat die Kammer die so genannten Verwürfe weder (zu Lasten des Angeklagten) durch einen Abschlag bei den Liefermengen oder an anderer Stelle rechnerisch berücksichtigt. Verwürfe entstanden, weil die ärztlich verordneten Wirkstoffmengen für eine Zubereitung mit den Verpackungseinheiten der jeweiligen Wirkstoffe nicht stets identisch waren. So konnte es vorkommen, dass nach dem Herstellen einer Zubereitung eine Wirkstoffrestmenge aus der angebrochenen Verpackungseinheit verblieb. Falls diese Restmenge nicht für eine folgende Zubereitung innerhalb des zulässigen Verwendbarkeitszeitraums genutzt werden konnte, war sie zu verwerfen, also zu entsorgen. Sie konnte allerdings gesondert bei den Kostenträgern abgerechnet werden. Diese übliche Vorgehensweise führte also dazu, dass ein Teil der Einkaufsmenge nicht für die Herstellung parenteraler Arzneimittelzubereitungen verwendet werden konnte, sondern nach Ablauf des Stabilitätszeitraums vernichtet werden musste.
940667
941Einkaufsmengen der einzelnen Wirkstoffe mit Sicherheitszuschlägen
942Auf Grundlage der Ermittlungen des Zeugen T hat die Kammer für die
943einzelnen vorliegenden Wirkstoffe die nachfolgend genannten Einkaufsmengen
944bestimmt. Ausgangspunkt waren die von dem Zeugen T ermitteltenEinkaufsmengen, die aufgrund der vorgenannten Umstände grundsätzlich um einen Sicherheitszuschlag von 10 % erhöht wurden. Diesen Wert von 10 % hat die Kammer auf einen Wert von 5 % ermäßigt, sofern es sich um einen Wirkstoff handelte, der erst nach dem 01.01.2012 auf dem Markt zugelassen wurde, ein möglicher unbekannter Anfangsbestand mithin beim Sicherheitszuschlag nicht zu berücksichtigen war. Sofern der Angeklagte für einzelne Wirkstoffe auch Studienware bezog und entsprechende Zubereitungen verarbeitete, hat die Kammer den Sicherheitszuschlag um einen Wert von 5 Prozentpunkten erhöht. Die ermittelte Einkaufsmenge wurde jeweils aufgerundet. Im Einzelnen:
945Bevacizumab
946Der Zeuge T führte aus, dass er für den Wirkstoff Bevacizumab eine Einkaufs-
947menge von 541.900 mg ermittelt habe. Die Kammer hat diesen Wert um einen Sicherheitszuschlag von 15 % erhöht, da ein möglicher Anfangslagerbestand des Wirkstoffes nicht bekannt war, und Studienware möglicherweise zu einer weiteren Menge an Wirkstoff geführt hat. Demzufolge hat die Kammer eine Wirkstoffmenge von 623.185 mg zugrunde gelegt. Zugunsten des Angeklagten hat die Kammer die Herstellungsmenge des Wirkstoffs Bevacizumab, die für die sog. „Augenspritzen“ erforderlich gewesen wäre - in diesen Fällen wurde der Angeklagte freigesprochen - nicht in Abzug gebracht.
948Bortezomib
949Der Zeuge T führte aus, dass er für den Wirkstoff Bortezomib eine Einkaufs-
950menge von 2.898 mg ermittelt habe. Die Kammer hat diesen Wert um einen Sicherheitszuschlag von 10 % erhöht, da neben den oben genannten weiteren Umständen zu berücksichtigen war, dass ein möglicher Anfangslagerbestand des Wirkstoffes nicht bekannt war. Demzufolge hat die Kammer eine Wirkstoffmenge von 3.187,80 mg zugrunde gelegt. Studienware war von der Kammer nicht zu berücksichtigen.
951![]() Brentuximab
Brentuximab
Der Zeuge T führte aus, dass er für den Wirkstoff Brentuximab eine Einkaufs-
953menge von 300 mg ermittelt habe. Die Kammer hat diesen Wert um einen Sicherheitszuschlag von 5 % erhöht. Der Wirkstoff ist erst im Oktober 2012 zugelassen worden. Zum 01.01.2012 existierte damit kein Lagerbestand. Studienware war von der Kammer nicht zu berücksichtigen. Zugrunde gelegt wurden 315 mg.
954Cetuximab
955Der Zeuge T führte aus, dass er für den Wirkstoff Cetuximab eine Einkaufs-
956menge von 172.900 mg ermittelt habe. Die Kammer hat diesen Wert um einen Sicherheitszuschlag von 10 % erhöht, da neben den oben genannten weiteren Umständen zu berücksichtigen war, dass ein möglicher Anfangslagerbestand des Wirkstoffes nicht bekannt war. Demzufolge hat die Kammer für den Wirkstoff Cetuximab eine Wirkstoff-menge von 190.190 mg zugrunde gelegt. Studienware war von der Kammer nicht zu berücksichtigen.
957Daratumumab
958Der Zeuge T führte aus, dass er für den Wirkstoff Daratumumab eine Einkaufs-
959menge von 21.200 mg ermittelt habe. Die Kammer hat diesen Wert um einen Sicherheitszuschlag von 10 % erhöht, da neben den oben genannten weiteren Umständen zu berücksichtigen war, dass ein möglicher Anfangslagerbestand des Wirkstoffes nicht bekannt war. Demzufolge hat die Kammer für den Wirkstoff Daratumumab eine Wirk-stoffmenge von 23.320 mg zugrunde gelegt. Studienware war von der Kammer nicht zu berücksichtigen.
960Decitabin
961Der Zeuge T führte aus, dass er für den Wirkstoff Decitabin eine Einkaufsmenge
962von 6.000 mg ermittelt habe. Die Kammer hat diesen Wert um einen Sicherheitszu-
963669
964schlag von 10 % erhöht, da neben den oben genannten weiteren Umständen zu berücksichtigen war, dass ein möglicher Anfangslagerbestand des Wirkstoffes nicht bekannt war. Demzufolge hat die Kammer für den Wirkstoff Decitabin eine Wirkstoff-menge von 6.600 mg zugrunde gelegt. Studienware war von der Kammer nicht zu berücksichtigen.
965Denosumab
966Zum Wirkstoff Densoumab führte der Zeuge T aus, dass er anhand der Mittei-
967lungen der Lieferanten eine Einkaufsmenge für das Präparat mit dem Handelsnamen Xgeva (120 mg Injektionslösung) von 253.320 mg ermittelt habe. Die Kammer hat aufgrund der oben genannten Umstände auf die Einkaufsmenge einen Sicherheitszuschlag von 10 % vorgenommen und einen Einkaufswert von 278.652 mg zugrunde gelegt. Der Wert von 10 % beruht darauf, dass der Wirkstoff bereits vor dem 01.10.2012 auf dem Markt zugelassen war, also möglicherweise ein Anfangslagerbestand existierte. Studienware war von der Kammer nicht zu berücksichtigen.
968Lieferungen des Präparates Prolia (60 mg Injektionslösung in einer Fertigspritze), das ebenfalls den Wirkstoff Denosumab enthält, waren nicht zu berücksichtigen. Das Präparat Prolia dient nicht der Krebsbehandlung, sondern der Behandlung anderer Krankheiten, insbesondere Knochenschwund. Aufgrund seiner speziellen Darreichungsform (Fertigspritze) kann es nicht für die Herstellung von Zubereitungen eingesetzt werden. Dies ergibt sich aus den Fachinformationen des Herstellers für die beiden Präparate, die die Kammer in der Hauptverhandlung verlesen hat.
969Ergänzend ergab sich auch aus den Abrechnungsdaten der und den dort
970aufgeführten Präparaten - insoweit unmittelbar nur für die Abrechnungen gegenüber gesetzlichen Krankenkassen und Kostenträgern -, dass die in der Anklage aufgeführten Zubereitungen allein mit dem Präparat Xgeva hergestellt worden waren.
971Eribulin
972Zum Wirkstoff Eribulin führte der Zeuge T aus, dass er anhand der Mitteilungen
973der Lieferanten eine Einkaufsmenge von 462 mg ermittelt habe. Die Kammer hat auf-
974670
975grund der oben genannten Umstände auf die Einkaufsmenge einen Sicherheitszuschlag von 10 % vorgenommen und einen Einkaufswert von 509 mg zugrunde gelegt. Der Wert von 10 % beruht darauf, dass der Wirkstoff bereits vor dem 01.01.2012 auf dem Markt zugelassen war und daher möglicherweise ein Anfangslagerbestand existierte. Studienware war von der Kammer nur in sieben Fällen zu berücksichtigen, so dass eine weitere Erhöhung nicht angezeigt ist.
976Nab-Paclitaxel
977Der Zeuge T führte aus, dass er für den Wirkstoff Nab-Paclitaxel eine Einkaufsmenge von 107.700 mg ermittelt habe. Die Kammer hat diesen Wert um einen Sicherheitszuschlag von 15 % erhöht, da ein möglicher Anfangslagerbestand des Wirkstoffes nicht bekannt war, und Studienware möglicherweise zu einer weiteren Menge an Wirkstoff geführt hat. Demzufolge hat die Kammer eine Wirkstoffmenge von 123.855 mg zugrunde gelegt.
978Nivolumab
979Der Zeuge T führte aus, dass er für den Wirkstoff Nivolumab eine Einkaufsmenge von 24.420 mg ermittelt habe. Die Kammer hat diesen Wert um einen Sicherheitszuschlag von 5 % erhöht. Der Wirkstoff ist erst im Jahr 2015 zugelassen worden. Zum 01.01.2012 existierte damit kein Lagerbestand. Demzufolge hat die Kammer eine Wirkstoffmenge von 25.641 mg zugrunde gelegt. Studienware war von der Kammer nicht zu berücksichtigen.
980Obinutuzumab
981Der Zeuge T führte aus, dass er für den Wirkstoff Obinutuzumab eine Einkaufsmenge von 49.000 mg ermittelt habe. Die Kammer hat diesen Wert um einen Sicherheitszuschlag von 5 % erhöht. Der Wirkstoff ist erst im Jahr 2014 zugelassen worden. Zum 01.01.2012 existierte damit kein Lagerbestand. Demzufolge hat die Kammer eine Wirkstoffmenge von 51.450 mg zugrunde gelegt. Studienware war von der Kammer nicht zu berücksichtigen.
982671
983Ofatumumab
984Der Zeuge T führte aus, dass er für den Wirkstoff Ofatumumab eine Einkaufs-
985menge von 26.200 mg ermittelt habe. Die Kammer hat diesen Wert um einen Sicherheitszuschlag von 5 % erhöht. Der Wirkstoff ist erst im Jahr 2012 zugelassen worden. Zum 01.01.2012 existierte damit kein Lagerbestand. Demzufolge hat die Kammer eine Wirkstoffmenge von 27.510 mg zugrunde gelegt. Studienware war von der Kammer nicht zu berücksichtigen.
986Panitumumab
987Der Zeuge T führte aus, dass er für den Wirkstoff Panitumumab eine Einkaufs-
988menge von 59.700 mg ermittelt habe. Die Kammer hat diesen Wert um einen Sicherheitszuschlag von 15 % erhöht, da ein möglicher Anfangslagerbestand des Wirkstoffs nicht bekannt war, und Studienware möglicherweise zu einer weiteren Menge an Wirkstoff geführt hat. Demzufolge hat die Kammer eine Wirkstoffmenge von 68.655 mg zugrunde gelegt.
989Pembrolizumab
990Zum Wirkstoff Pembrolizumab führte der Zeuge T aus, dass er anhand der Mit-
991teilungen der Lieferanten eine Einkaufsmenge von 1.700 mg ermittelt habe. Die Kammer hat aufgrund der oben genannten Umstände auf die Einkaufsmenge einen Sicherheitszuschlag von 10 % vorgenommen und einen Einkaufswert von 1.870 mg zugrunde gelegt. Studienware war von der Kammer insoweit nicht zu berücksichtigen.
992Pemetrexed
993Zum Wirkstoff Pemetrexed führte der Zeuge T aus, dass er anhand der Mittei-
994lungen der Lieferanten eine Einkaufsmenge von 156.500 mg ermittelt habe. Die Kammer hat hierzu eine weitere Menge von 4.500 mg des Wirkstoffs addiert. In der Be-
995weisaufnahme hat sich dazu ergeben, dass der Lieferant GmbH eine Lieferung
996von 4.500 mg aus dem Jahr 2012 (damals firmierte die GmbH noch als
997GmbH) nicht an T gemeldet hatte, weil diese unter einer veral-
998teten weiteren Kunden-Nummer der Apotheke gespeichert war.
999672
1000Die Kammer hat aufgrund der oben genannten Umstände auf die Einkaufsmenge von 161.000 mg einen Sicherheitszuschlag von 10 % vorgenommen und einen Einkaufswert von 177.100 mg zugrunde gelegt. Der Wert von 10 % beruht darauf, dass der Wirkstoff bereits vor dem 01.01.2012 zugelassen war, also möglicherweise ein Anfangslagerbestand vorhanden war. Studienware war von der Kammer nicht zu berücksichtigen.
1001Pertuzumab
1002Der Zeuge T führte aus, dass er für den Wirkstoff Pertuzumab eine Einkaufs-
1003menge von 109.620 mg ermittelt habe. Die Kammer hat diesen Wert um einen Sicherheitszuschlag von 10 % erhöht, da Studienware möglicherweise zu einer weiteren Menge an Wirkstoff geführt hat. Der Wirkstoff ist erst im Jahr 2013 zugelassen worden. Zum 01.01.2012 existierte damit kein Lagerbestand. Demzufolge hat die Kammer eine Wirkstoffmenge von 120.582 mg zugrunde gelegt.
1004Ramucirumab
1005Der Zeuge T führte aus, dass er für den Wirkstoff Ramucirumab eine Einkaufs-
1006menge von 26.500 mg ermittelt habe. Die Kammer hat diesen Wert um einen Sicherheitszuschlag von 5 % erhöht. Der Wirkstoff ist erst im Oktober 2012 zugelassen worden. Zum 01.01.2012 existierte damit kein Lagerbestand. Demzufolge hat die Kammer eine Wirkstoffmenge von 27.825 mg zugrunde gelegt. Studienware war von der Kammer nicht zu berücksichtigen.
1007Rituximab
1008Zum Wirkstoff Rituximab führte der Zeuge T aus, dass er anhand der Mitteilun-
1009gen der Lieferanten eine Einkaufsmenge von 707.900 mg ermittelt habe. Die Kammer hat aufgrund der oben genannten Umstände auf die Einkaufsmenge einen Sicherheitszuschlag von 10 % vorgenommen und einen Einkaufswert von 778.690 mg zugrunde gelegt. Der Wert von 10 % beruht darauf, dass der Wirkstoff bereits vor dem 01.01.2012 auf dem Markt zugelassen war und daher möglicherweise ein Anfangsla-
1010673
1011gerbestand existierte. Studienware war von der Kammer insoweit nicht zu berücksichtigen.
1012Temsirolimus
1013Zum Wirkstoff Temsirolimus führte der Zeuge T aus, dass er anhand der Mittei-
1014lungen der Lieferanten für den gesamten Zeitraum von 2012 bis 2016 eine Einkaufsmenge von 9.000 mg ermittelt habe. Die Kammer hat aufgrund der oben genannten Umstände auf die Einkaufsmenge einen Sicherheitszuschlag von 10 % vorgenommen und einen Einkaufswert von 9.900 mg zugrunde gelegt. Der Wert von 10 % beruht darauf, dass der Wirkstoff bereits vor dem 01.01.2012 auf dem Markt zugelassen war, insoweit möglicherweise ein Anfangslagerbestand existierte. Studienware war von der Kammer nicht zu berücksichtigen.
1015Zugunsten des Angeklagten hat die Kammer darüber hinaus die vollen Einkaufsmengen von 2012 bis 2016 zugrunde gelegt, obwohl sie den Angeklagten für das Herstellen von Zubereitungen mit Temsirolimus im Jahr 2012 freigesprochen hat. Sie hat also die für die Zubereitungen des Jahres 2012 erforderliche Wirkstoffmenge nicht abgezogen.
1016Trabectedin
1017Zum Wirkstoff Trabectedin führte der Zeuge T aus, dass er anhand der Mitteilun-
1018gen der Lieferanten eine Einkaufsmenge von 97 mg ermittelt habe. Die Kammer hat aufgrund der oben genannten Umstände auf die Einkaufsmenge einen Sicherheitszuschlag von 10 % vorgenommen und einen Einkaufswert von 106,70 mg zugrunde gelegt. Der Wert von 10 % beruht darauf, dass der Wirkstoff bereits vor dem 01.01.2012 auf dem Markt zugelassen war, insoweit möglicherweise ein Anfangslagerbestand existierte. Studienware war von der Kammer insoweit nicht zu berücksichtigen.
1019Trastuzumab
1020Der Zeuge T führte aus, dass er für den Wirkstoff Trastuzumab eine Einkaufs-
1021menge von 412.650 mg ermittelt habe. Die Kammer hat diesen Wert um einen Sicherheitszuschlag von 15 % erhöht, da ein möglicher Anfangslagerbestand des Wirkstoffs
1022674
1023existierte und Studienware möglicherweise zu einer weiteren Menge an Wirkstoff geführt hat. Demzufolge hat die Kammer eine Wirkstoffmenge von 474.547,50 mg zugrunde gelegt.
1024Trastuzumab Emtansine
1025Der Zeuge T führte aus, dass er für den Wirkstoff Trastuzumab Emtansine eine
1026Einkaufsmenge von 21.040 mg ermittelt habe. Die Kammer hat diesen Wert um einen Sicherheitszuschlag von 10 % erhöht, da Studienware möglicherweise zu einer weiteren Menge an Wirkstoff geführt hat. Der Wirkstoff ist erst im Jahr 2013 zugelassen worden. Zum 01.01.2012 existierte damit kein Lagerbestand. Demzufolge hat die Kammer eine Wirkstoffmenge von 23.144 mg zugrunde gelegt.
1027Treosulfan
1028Zum Wirkstoff Treosulfan führte der Zeuge T aus, dass er anhand der Mitteilun-
1029gen der Lieferanten eine Einkaufsmenge von 472.000 mg ermittelt habe. Die Kammer hat aufgrund der obigen genannten Umstände auf die Einkaufsmenge einen Sicherheitszuschlag von 10 % vorgenommen und einen Einkaufswert von 519.200 mg zugrunde gelegt. Der Wert von 10 % beruht darauf, dass der Wirkstoff bereits vor dem 01.01.2012 auf dem Markt zugelassen war, insoweit möglicherweise ein Anfangslagerbestand existierte. Studienware war von der Kammer insoweit nicht zu berücksichtigen.
1030Vinblastin
1031Zum Wirkstoff Vinblastin führte der Zeuge T aus, dass er anhand der Mitteilun-
1032gen der Lieferanten eine Einkaufsmenge von 780 mg ermittelt habe. Die Kammer hat aufgrund der oben genannten Umstände auf die Einkaufsmenge einen Sicherheitszuschlag von 10 % vorgenommen und einen Einkaufswert von 858 mg zugrunde gelegt. Der Wert von 10 % beruht darauf, dass der Wirkstoff bereits vor dem 01.01.2012 auf dem Markt zugelassen war, insoweit möglicherweise ein Anfangslagerbestand existierte. Studienware war von der Kammer insoweit nicht zu berücksichtigen.
1033675
1034Vinflunin
1035Zum Wirkstoff Vinflunin führte der Zeuge T aus, dass er anhand der Mitteilungen
1036der Lieferanten für den gesamten Zeitraum von 2012 bis 2016 eine Einkaufsmenge von 7.200 mg ermittelt habe. Die Kammer hat dazu eine Lieferung durch den Apothe-
1037ker N vom 30.09.2016 von insgesamt 700 mg (vier Einheiten von 1 x 2 ml Javlor25 mg/ml und zwei Einheiten von 1 x 10 ml Javlor 25 mg/ml) des Wirkstoffes Vinflunin addiert, die sich in der Beweisaufnahme ergeben hatte. Die Kammer hat weiter aufgrund der oben genannten Umstände auf die Einkaufsmenge einen Sicherheitszuschlag von 10 % vorgenommen und einen Einkaufswert von 8.690 mg zugrunde gelegt. Der Wert von 10 % beruht darauf, dass der Wirkstoff bereits vor dem 01.01.2012 auf dem Markt zugelassen war, insoweit möglicherweise ein Anfangslagerbestand existierte. Studienware war von der Kammer nicht zu berücksichtigen.
1038Zugunsten des Angeklagten hat die Kammer darüber hinaus die vollen Einkaufsmengen von 2012 bis 2016 zugrunde gelegt, obwohl sie den Angeklagten für das Herstellen von Zubereitungen mit Vinflunin im Jahr 2012 freigesprochen hat. Sie hat also die für die Zubereitungen des Jahres 2012 erforderliche Wirkstoffmenge nicht abgezogen.
1039(2) Feststellungen zu den parenteralen Arzneimittelzubereitungen und Berechnung der Anzahl der Taten
1040Die Kammer hat nunmehr für jeden Wirkstoff die zugunsten des Angeklagten „korrigierten“ Einkaufsmengen zu der Zahl der parenteralen Arzneimittelzubereitungen des betreffenden Wirkstoffs in Beziehung gesetzt und auf diese Weise eine Mindestzahl unterdosierter Zubereitungen errechnet.
1041Parenterale Arzneimittelzubereitungen der Jahre 2012 bis 2016
1042Die Feststellungen zu den hergestellten und an die behandelnden Ärzte ausgelieferten
1043parenteralen Arzneimittelzubereitungen der Apotheke beruhen auf den Datendes EDV-Programms Zenzy, der oben bereits beschriebenen Spezial-Software zur Organisation und Dokumentation der Zubereitungsherstellung. Das EDV-Programm
1044Zenzy diente in der Apotheke der Erfassung jeder einzelnen parenteralen Arz-
1045676
1046neimittelzubereitung, die hergestellt, dokumentiert und ausgeliefert wurde. In der Da-
1047tenbank dieses Programms sind alle in der Apotheke hergestellten und ausge-lieferten parenteralen Arzneimittelzubereitungen seit dem 01.01.2012 erfasst und abrufbar. Diese Daten hat die Kammer im Wege des Selbstleseverfahrens in die Hauptverhandlung eingeführt.
1048Integrität der Zenzy-Daten
1049Die in die Hauptverhandlung eingeführten Daten zu den einzelnen Zubereitungen ent-
1050sprechen den Einträgen, wie sie in der Apotheke erfolgt sind, und damit denDaten, wie sie im Programm Zenzy am 29.11.2016 vorhanden waren. Die Kammer ist von der Integrität der Daten aufgrund der detaillierten und nachvollziehbaren Angaben
1051des Ermittlungsbeamten M überzeugt:
1052Der Zeuge KOK M , ein Mitarbeiter des Polizeipräsidiums Recklinghausen, der dort
1053im Bereich der IT-Forensik tätig ist, hat die Extrahierung der Daten erläutert. Insoweit führte er aus, er habe sich am Tag der Durchsuchung zunächst mit der Funktionsweise der Software vertraut gemacht. Es handele sich um eine zentral vorgehaltene Datenbank mit verschiedenen Arbeitsplätzen mit Berechtigungen für mehrere Mitarbeiter. Die Speicherung der Daten erfolge in der Apotheke. Der Mitarbeiter F
1054habe sich auf sein Geheiß am Arbeitsplatzrechner angemeldet.
1055Er, der Zeuge M habe zunächst die Daten gesichert und den Arbeitsplatzrechner
1056sowie den Server sichergestellt. Auf der Dienststelle habe er, M , dann eine foren-
1057sische Sicherung vorgenommen worden, um die Unveränderbarkeit der Daten zu gewährleisten. Alle Festplatten seien ausgelesen worden.
1058Anhand des Arbeitsplatzrechners des Mitarbeiters F habe er sodann eine
1059Virtualisierung, also die Inbetriebnahme einer Kopie des Programms, vorgenommen. Auf diesem Weg habe er die Datenbank auf dem Stand des Tages der Durchsuchung
1060lesen können, wie sie zuvor den Nutzern in der Apotheke erschienen sei. DieFunktionsweise des Programms und die Abfrage von Daten über die Benutzeroberflä-
1061che sei ihm dann vom Geschäftsführer des Softwareherstellers, , aufAnfrage erläutert worden.
1062Der Zeuge KOK M führte weiter aus, er habe die Daten aus Zenzy in das MS-
1063Office Programm Excel - eine Tabellenkalkulationsprogramm - exportieren können.
1064677
1065Diese extrahierten Daten habe er dann nach Jahren sortiert.
1066Inhaltliche Richtigkeit der Daten
1067Die Kammer ist weiter überzeugt, dass die Daten des Programms zu den einzelnen Zubereitungen inhaltlich zutreffend sind. Die Mitarbeiter des Reinraumlabors, soweit die Kammer sie hat vernehmen können, haben den Herstellungsprozess übereinstimmend so geschildert, das als Herstellungsanweisung im Labor ein Etikett diente, das mit dem Programm Zenzy auf Grundlage der dort eingepflegten Therapiedaten erstellt wurde. Dies hat der Angeklagte auch im Rahmen seines Explorationsgespräches ge-
1068genüber dem Sachverständigen Prof. S angegeben. Ohne Eintrag in Zenzykonnte es keine Herstellung geben. Umgekehrt ist auch ersichtlich, welche eingetragenen Zubereitungen letztlich tatsächlich hergestellt wurden.
1069Die Kammer ist weiter überzeugt, dass eine (nachträgliche) Veränderung von Daten
1070durch Mitarbeiter der Apotheke nicht stattgefunden hat. Der Zeuge KOK M führte nachvollziehbar aus, dass eine solche Veränderung nicht möglich sei. Das System arbeite wie ein Protokoll, jeder Schritt werde vermerkt, mithin wäre auch eine nachträgliche Veränderung von Daten erkennbar gewesen.
1071Berechnung der Mindestanzahl der Taten
1072Die Kammer hat anhand der Einkaufsmengen und der Herstellungsmengen für jeden einzelnen Wirkstoff gesondert berechnet, für welche Anzahl von parenteralen Arzneimittelzubereitungen der Angeklagte über die erforderliche Wirkstoffmenge verfügte. Dann hat sie die Differenz zu den tatsächlich hergestellten Zubereitungen ermittelt. Das Ergebnis spiegelt mithin die Mindestzahl von Zubereitungen wider, für die der Angeklagte über keinen Wirkstoff verfügte. Die Kammer zieht daraus den Schluss, dass diese Anzahl von Zubereitungen unterdosiert war.
1073Die Kammer ist dabei wie folgt vorgegangen: Sie hat zunächst anhand der Daten aus dem Programm Zenzy für jeden einzelnen Wirkstoff gesondert die Gesamtanzahl an Zubereitungen und die dafür insgesamt erforderliche Wirkstoffmenge berechnet. Auf Grundlage dieser Menge hat sie sodann die durchschnittliche Wirkstoffmenge einer Arzneimittelzubereitung dieses konkreten Wirkstoffs ermittelt. Diese durchschnittliche
1074678
1075Wirkstoffmenge hat sie zugunsten des Angeklagten mit einem Sicherheitsabschlag von 10 % versehen und die Werte abgerundet. Dies wirkt sich in der Weise zugunsten des Angeklagten aus, dass bei einer geringeren Durchschnittsmenge an Wirkstoff für eine Zubereitung mittels einer bestimmten Gesamtwirkstoffmenge mehr Zubereitungen hergestellt werden können, so dass sich Anzahl der unterdosierten Zubereitungen verringert.
1076Zugunsten des Angeklagten hat die Kammer dabei weiter angenommen, dass eine Arzneimittelzubereitung nur mit mindestens 80 % der angegebenen, ärztlich verordneten Wirkstoffmenge befüllt sein muss (Toleranz von 20 %), um noch die pharmazeuti-
1077schen Standards zu erfüllen. Der Sachverständige L hatte demgegenüber ausfachlicher Sicht einen Mindestwert von 90 % (also eine Toleranz von 10 %) bei den - hier vorliegenden - Arzneimittelzubereitungen angenommen, während der Wert bei Fertigarzneimitteln sogar bei 95 % liege (Toleranz von 5 %). Auch insoweit hat die Kammer die ermittelte Menge abgerundet.
1078Unter Zugrundelegung der Wirkstoffmenge einer durchschnittlichen Zubereitung und der - wie unter der Vorziffer erläutert - insgesamt vorhandenen Wirkstoffmenge hat die Kammer berechnet, wie viele parenterale Zubereitungen eines Wirkstoffs mit dem vorhandenen Wirkstoff hätten ordnungsgemäß dosiert hergestellt werden können (Einkaufsmenge dividiert durch die durchschnittliche Menge für eine Zubereitung). Den ermittelten Wert hat die Kammer zugunsten des Angeklagten aufgerundet.
1079Diese Anzahl von möglichen Zubereitungen hat die Kammer dann von der tatsächlichen Gesamtzahl der parenteralen Arzneimittelzubereitungen jedes einzelnen Wirkstoffs in Abzug gebracht. Auf die ermittelte Anzahl unterdosierter parenteraler Arzneimittelzubereitungen hat die Kammer zugunsten des Angeklagten einen weiteren Sicherheitsabschlag von 5 % vorgenommen und die ermittelte Zahl wiederum abgerundet. Im Rahmen dieses Sicherheitsabschlages hat die Kammer zugunsten des Angeklagten auch eingepreist, dass im Januar 2016 in der Phase zwischen der Schließung des alten und der Eröffnung des neuen Reinraumlabors an zwei Arbeitstagen, die konkret nicht mehr festgestellt werden konnten, eine nicht feststellbare Anzahl parentera-
1080![]()
![]() ler Arzneimittelzubereitungen in der Apotheke des Zeugen A auf Bitte des Ange-klagten hergestellt wurden. Diese Zubereitungen wurden im Programm Zenzy der Apotheke dokumentiert. Die Kammer geht insoweit davon aus, dass die parenter-alen Arzneimittelzubereitungen ordnungsgemäß dosiert waren. Hinweise auf anders
ler Arzneimittelzubereitungen in der Apotheke des Zeugen A auf Bitte des Ange-klagten hergestellt wurden. Diese Zubereitungen wurden im Programm Zenzy der Apotheke dokumentiert. Die Kammer geht insoweit davon aus, dass die parenter-alen Arzneimittelzubereitungen ordnungsgemäß dosiert waren. Hinweise auf anders
679
1082lautende Anweisungen des Angeklagten an Mitarbeiter des Zeugen A , Unterdo-
1083sierungen vorzunehmen, sind nicht ersichtlich.
1084Zu den Wirkstoffen im Einzelnen:
1085Bevacizumab
1086Für den Wirkstoff Bevacizumab konnte die Kammer - unter Abzug der „Augenspritzen“ - feststellen, dass im Tatzeitraum die in den Feststellungen aufgeführten 4.443 Zubereitungen hergestellt worden sind. Für diese 4.443 Zubereitungen hat die Kammer anhand der Daten aus Zenzy festgestellt, dass insgesamt eine Wirkstoffmenge von 3.018.624,47 mg erforderlich gewesen wäre. Die durchschnittliche Größe einer Arzneimittelzubereitung mit dem Wirkstoff Bevacizumab betrug mithin abgerundet 679 mg. Unter Berücksichtigung des Sicherheitsabschlages von 10 % hat die Kammer einen (abgerundeten) Wert von 611 mg zugrunde gelegt. Unter weiterer Berücksichtigung der Wirkstofffüllmenge von nur 80 % ergibt sich insoweit eine durchschnittliche Wirkstoffmenge von 488 mg.
1087Unter Zugrundelegung der Einkaufsmenge von 623.185 mg konnten mit der vorhandenen Wirkstoffmenge (aufgerundet) 1.278 parenterale Zubereitungen des Wirkstoffs Bevacizumab hergestellt werden. Die Differenz zu den tatsächlich hergestellten Zubereitungen liegt bei 3.165 (4.443 abzgl. 1.278), mithin war für 3.165 Zubereitungen kein Wirkstoff vorhanden. Unter Anwendung des weiteren Sicherheitsabschlags von 5 % ergibt sich (abgerundet) eine Anzahl von 3.006 Taten hinsichtlich des Wirkstoffs Be-vacizumab.
1088Dabei hat die Beweisaufnahme keine Ansatzpunkte erbracht festzustellen, exakt welche der 4.443 Zubereitungen unterdosiert waren. Dies gilt entsprechend für die Zubereitungen mit den weiteren im Folgenden aufgeführten Wirkstoffen.
1089Bortezomib
1090Für den Wirkstoff Bortezomib konnte die Kammer feststellen, dass im Tatzeitraum die in den Feststellungen aufgeführten 2.457 Zubereitungen hergestellt worden sind. Für diese 2.457 Zubereitungen hat die Kammer anhand der Daten aus Zenzy festgestellt,
1091680
1092dass insgesamt eine Wirkstoffmenge von 5.685,58 mg erforderlich gewesen wäre. Die durchschnittliche Größe einer Arzneimittelzubereitung mit dem Wirkstoff Bortezomib betrug mithin abgerundet 2,31 mg. Unter Berücksichtigung des Sicherheitsabschlages von 10 % hat die Kammer einen (abgerundeten) Wert von 2,07 mg zugrunde gelegt. Unter weiterer Berücksichtigung der Wirkstofffüllmenge von nur 80 % ergibt sich insoweit eine durchschnittliche Wirkstoffmenge von 1,65 mg. Unter Zugrundelegung der Einkaufsmenge von 3.187,8 mg konnten mit der vorhandenen Wirkstoffmenge (aufgerundet) 1.932 parenterale Zubereitungen des Wirkstoffs Bortezomib hergestellt werden. Die Differenz zu den tatsächlich hergestellten Zubereitungen liegt bei 525 (2.457 abzgl. 1.932), mithin war für 525 Zubereitungen kein Wirkstoff vorhanden. Unter Anwendung des weiteren Sicherheitsabschlags von 5 % ergibt sich (abgerundet) eine Anzahl von 498 Taten hinsichtlich des Wirkstoffs Bortezomib.
1093Brentuximab
1094Für den Wirkstoff Brentuximab konnte die Kammer feststellen, dass im Tatzeitraum die in den Feststellungen aufgeführten 13 Zubereitungen hergestellt worden sind. Für diese 13 Zubereitungen hat die Kammer anhand der Daten aus Zenzy festgestellt, dass insgesamt eine Wirkstoffmenge von 1.636,20 mg erforderlich gewesen wäre. Die durchschnittliche Größe einer Arzneimittelzubereitung mit dem Wirkstoff Brentuximab betrug mithin abgerundet 125 mg. Unter Berücksichtigung des Sicherheitsabschlages von 10 % hat die Kammer einen (abgerundeten) Wert von 112 mg zugrunde gelegt. Unter weiterer Berücksichtigung der Wirkstofffüllmenge von nur 80 % ergibt sich insoweit eine durchschnittliche Wirkstoffmenge von 89 mg. Unter Zugrundelegung der Einkaufsmenge von 315 mg konnten mit der vorhandenen Wirkstoffmenge (aufgerundet) vier parenterale Zubereitungen des Wirkstoffs Brentuximab hergestellt werden. Die Differenz zu den tatsächlich hergestellten Zubereitungen liegt bei neun, mithin war für neun Zubereitungen kein Wirkstoff vorhanden. Unter Anwendung des weiteren Sicherheitsabschlags von 5 % ergibt sich (abgerundet) eine Anzahl von acht Taten hinsichtlich des Wirkstoffs Brentuximab.
1095Cetuximab
1096Für den Wirkstoff Cetuximab konnte die Kammer feststellen, dass im Tatzeitraum die
1097681
1098in den Feststellungen aufgeführten 1.313 Zubereitungen hergestellt worden sind. Für diese 1.313 Zubereitungen hat die Kammer anhand der Daten aus Zenzy festgestellt, dass insgesamt eine Wirkstoffmenge von 647.353,50 mg erforderlich gewesen wäre. Die durchschnittliche Größe einer Arzneimittelzubereitung mit dem Wirkstoff Cetuxi-mab betrug mithin abgerundet 493 mg. Unter Berücksichtigung des Sicherheitsabschlages von 10 % hat die Kammer einen (abgerundeten) Wert von 443 mg zugrunde gelegt. Unter weiterer Berücksichtigung der Wirkstofffüllmenge von nur 80 % ergibt sich insoweit eine durchschnittliche Wirkstoffmenge von 354 mg. Unter Zugrundelegung der Einkaufsmenge von 190.190 mg konnten mit der vorhandenen Wirkstoff-menge (aufgerundet) 538 parenterale Zubereitungen des Wirkstoffs Cetuximab hergestellt werden. Die Differenz zu den tatsächlich hergestellten Zubereitungen liegt bei 775 (1.313 abzgl. 538), mithin war für 775 kein Wirkstoff vorhanden. Unter Anwendung des weiteren Sicherheitsabschlags von 5 % ergibt sich (abgerundet) eine Anzahl von 736 Taten hinsichtlich des Wirkstoffs Cetuximab.
1099Daratumumab
1100Für den Wirkstoff Daratumumab konnte die Kammer feststellen, dass im Tatzeitraum die in den Feststellungen aufgeführten 32 Zubereitungen hergestellt worden sind. Für diese 32 Zubereitungen hat die Kammer anhand der Daten aus Zenzy festgestellt, dass insgesamt eine Wirkstoffmenge von 35.252 mg erforderlich gewesen wäre. Die durchschnittliche Größe einer Arzneimittelzubereitung mit dem Wirkstoff Daratu-mumab betrug mithin abgerundet 1.101 mg. Unter Berücksichtigung des Sicherheitsabschlages von 10 % hat die Kammer einen (abgerundeten) Wert von 990 mg zugrunde gelegt. Unter weiterer Berücksichtigung der Wirkstofffüllmenge von nur 80 % ergibt sich insoweit eine durchschnittliche Wirkstoffmenge von 792 mg. Unter Zugrundelegung der Einkaufsmenge von 23.320 mg konnten mit der vorhandenen Wirkstoff-menge (aufgerundet) 30 parenterale Zubereitungen des Wirkstoffs Daratumumab hergestellt werden. Die Differenz zu den tatsächlich hergestellten Zubereitungen liegt bei zwei. Unter Anwendung des weiteren Sicherheitsabschlags von 5 % ergibt sich (abgerundet) eine Tat hinsichtlich des Wirkstoffs Daratumumab.
1101Decitabin
1102682
1103Für den Wirkstoff Decitabin konnte die Kammer feststellen, dass in den Jahren 2014 bis 2016 die in den Feststellungen aufgeführten 275 Zubereitungen hergestellt hat. Für diese 275 Zubereitungen hat die Kammer anhand der Daten aus Zenzy festgestellt, dass insgesamt eine Wirkstoffmenge von 10.421 mg erforderlich gewesen wäre. Die durchschnittliche Größe einer Arzneimittelzubereitung mit dem Wirkstoff Decitabin betrug mithin abgerundet 37 mg. Unter Berücksichtigung des Sicherheitsabschlages von 10 % hat die Kammer einen (abgerundeten) Wert von 33 mg zugrunde gelegt. Unter weiterer Berücksichtigung der Wirkstofffüllmenge von nur 80 % ergibt sich insoweit eine durchschnittliche Wirkstoffmenge von 26 mg. Unter Zugrundelegung der Einkaufsmenge von 6.600 mg konnten mit der vorhandenen Wirkstoffmenge (aufgerundet) 254 parenterale Zubereitungen des Wirkstoffs Decitabin hergestellt werden. Die Differenz zu den tatsächlich hergestellten Zubereitungen liegt bei 21. Unter Anwendung des weiteren Sicherheitsabschlags von 5 % ergeben sich (abgerundet) 19 Taten hinsichtlich des Wirkstoffs Decitabin.
1104Denosumab
1105Für den Wirkstoff Denosumab konnte die Kammer feststellen, dass im Tatzeitraum die in den Feststellungen aufgeführten 5.115 Zubereitungen hergestellt worden sind. Für diese 5.115 Zubereitungen hat die Kammer anhand der Daten aus Zenzy festgestellt, dass insgesamt eine Wirkstoffmenge von 613.800 mg erforderlich gewesen wäre. Die Größe einer Arzneimittelzubereitung mit dem Wirkstoff Denosumab betrug immer 120 mg. Unter Berücksichtigung der einheitlichen Größe von 120 mg hat die Kammer von einem weiteren Sicherheitsabschlag von 10 % abgesehen. Unter weiterer Berücksichtigung der Wirkstofffüllmenge von nur 80 % ergibt sich insoweit eine durchschnittliche Wirkstoffmenge von 96 mg. Unter Zugrundelegung der Einkaufsmenge von 278.652 mg konnten mit der vorhandenen Wirkstoffmenge (aufgerundet) 2.903 paren-terale Zubereitungen des Wirkstoffs Denosumab hergestellt werden. Die Differenz zu den tatsächlich hergestellten Zubereitungen liegt bei 2.212 (5.115 abzgl. 2.903), mithin war für 2.212 kein Wirkstoff vorhanden. Unter Anwendung des weiteren Sicherheitsabschlags von 5 % ergibt sich (abgerundet) eine Anzahl von 2.101 Taten hinsichtlich des Wirkstoffs Denosumab.
1106683
1107Eribulin
1108Für den Wirkstoff Eribulin konnte die Kammer feststellen, dass im Tatzeitraum die in den Feststellungen aufgeführten 595 Zubereitungen hergestellt worden sind. Für diese 595 Zubereitungen hat die Kammer anhand der Daten aus Zenzy festgestellt, dass insgesamt eine Wirkstoffmenge von 1.343,29 mg erforderlich gewesen wäre. Die durchschnittliche Größe einer Arzneimittelzubereitung mit dem Wirkstoff Eribulin betrug mithin abgerundet 2,2 mg. Unter Berücksichtigung des Sicherheitsabschlages von 10 % hat die Kammer einen (abgerundeten) Wert von 1,98 mg zugrunde gelegt. Unter weiterer Berücksichtigung der Wirkstofffüllmenge von nur 80 % ergibt sich insoweit eine durchschnittliche Wirkstoffmenge von 1,58 mg. Unter Zugrundelegung der Einkaufsmenge von 509 mg konnten mit der vorhandenen Wirkstoffmenge (aufgerundet) 323 parenterale Zubereitungen des Wirkstoffs Eribulin hergestellt werden. Die Differenz zu den tatsächlich hergestellten Zubereitungen liegt bei 272 (595 abzgl. 323), mithin war für 272 kein Wirkstoff vorhanden. Unter Anwendung des weiteren Sicherheitsabschlags von 5 % ergibt sich (abgerundet) eine Anzahl von 258 Taten hinsichtlich des Wirkstoffs Eribulin.
1109Nab-Paclitaxel
1110Für den Wirkstoff Nab-Paclitaxel konnte die Kammer feststellen, dass im Tatzeitraum die in den Feststellungen aufgeführten 953 Zubereitungen hergestellt worden sind. Für diese 953 Zubereitungen hat die Kammer anhand der Daten aus Zenzy festgestellt, dass insgesamt eine Wirkstoffmenge von 241.511,30 mg erforderlich gewesen wäre. Die durchschnittliche Größe einer Arzneimittelzubereitung mit dem Wirkstoff Nab-Paclitaxel betrug mithin abgerundet 253 mg. Unter Berücksichtigung des Sicherheitsabschlages von 10 % hat die Kammer einen (abgerundeten) Wert von 227 mg zugrunde gelegt. Unter weiterer Berücksichtigung der Wirkstofffüllmenge von nur 80 % ergibt sich insoweit eine durchschnittliche Wirkstoffmenge von 181 mg. Unter Zugrundelegung der Einkaufsmenge von 123.855 mg konnten mit der vorhandenen Wirkstoff-menge (aufgerundet) 685 parenterale Zubereitungen des Wirkstoffs Nab-Paclitaxel hergestellt werden. Die Differenz zu den tatsächlich hergestellten Zubereitungen liegt bei 268 (953 abzgl. 685), mithin war für 268 kein Wirkstoff vorhanden. Unter Anwendung des weiteren Sicherheitsabschlags von 5 % ergibt sich (abgerundet) eine Anzahl von 254 Taten hinsichtlich des Wirkstoffs Nab-Paclitaxel.
1111![]() Nivolumab
Nivolumab
Für den Wirkstoff Nivolumab konnte die Kammer feststellen, dass im Tatzeitraum die in den Feststellungen aufgeführten 364 Zubereitungen hergestellt worden sind. Für diese 364 Zubereitungen hat die Kammer anhand der Daten aus Zenzy festgestellt, dass insgesamt eine Wirkstoffmenge von 90.313 mg erforderlich gewesen wäre. Die durchschnittliche Größe einer Arzneimittelzubereitung mit dem Wirkstoff Nivolumab betrug mithin abgerundet 248 mg. Unter Berücksichtigung des Sicherheitsabschlages von 10 % hat die Kammer einen (abgerundeten) Wert von 223 mg zugrunde gelegt. Unter weiterer Berücksichtigung der Wirkstofffüllmenge von nur 80 % ergibt sich insoweit eine durchschnittliche Wirkstoffmenge von 178 mg. Unter Zugrundelegung der Einkaufsmenge von 25.641 mg konnten mit der vorhandenen Wirkstoffmenge (aufgerundet) 145 parenterale Zubereitungen des Wirkstoffs Nivolumab hergestellt werden. Die Differenz zu den tatsächlich hergestellten Zubereitungen liegt bei 219 (364 abzgl. 145), mithin war für 219 kein Wirkstoff vorhanden. Unter Anwendung des weiteren Sicherheitsabschlags von 5 % ergibt sich (abgerundet) eine Anzahl von 208 Taten hinsichtlich des Wirkstoffs Nivolumab.
1113Obinutuzumab
1114Für den Wirkstoff Obinutuzumab konnte die Kammer feststellen, dass im Tatzeitraum die in den Feststellungen aufgeführten 98 Zubereitungen hergestellt worden sind. Für diese 98 Zubereitungen hat die Kammer anhand der Daten aus Zenzy festgestellt, dass insgesamt eine Wirkstoffmenge von 84.100 mg erforderlich gewesen wäre. Die durchschnittliche Größe einer Arzneimittelzubereitung mit dem Wirkstoff Obinutuzu-mab betrug mithin abgerundet 858 mg. Unter Berücksichtigung des Sicherheitsabschlages von 10 % hat die Kammer einen (abgerundeten) Wert von 772 mg zugrunde gelegt. Unter weiterer Berücksichtigung der Wirkstofffüllmenge von nur 80 % ergibt sich insoweit eine durchschnittliche Wirkstoffmenge von 617 mg. Unter Zugrundelegung der Einkaufsmenge von 51.450 mg konnten mit der vorhandenen Wirkstoff-menge (aufgerundet) 84 parenterale Zubereitungen des Wirkstoffs Obinutuzumab hergestellt werden. Die Differenz zu den tatsächlich hergestellten Zubereitungen liegt bei
1115685
111614. Unter Anwendung des weiteren Sicherheitsabschlags von 5 % ergibt sich (abgerundet) eine Anzahl von 13 Taten hinsichtlich des Wirkstoffs Obinutuzumab.
1117Ofatumumab
1118Für den Wirkstoff Ofatumumab konnte die Kammer feststellen, dass im Tatzeitraum die in den Feststellungen aufgeführten 54 Zubereitungen hergestellt worden sind. Für diese 54 Zubereitungen hat die Kammer anhand der Daten aus Zenzy festgestellt, dass insgesamt eine Wirkstoffmenge von 96.100 mg erforderlich gewesen wäre. Die durchschnittliche Größe einer Arzneimittelzubereitung mit dem Wirkstoff Ofatumumab betrug mithin abgerundet 1.779 mg. Unter Berücksichtigung des Sicherheitsabschlages von 10 % hat die Kammer einen (abgerundeten) Wert von 1.601 mg zugrunde gelegt. Unter weiterer Berücksichtigung der Wirkstofffüllmenge von nur 80 % ergibt sich insoweit eine durchschnittliche Wirkstoffmenge von 1.280 mg. Unter Zugrundelegung der Einkaufsmenge von 27.510 mg konnten mit der vorhandenen Wirkstoff-menge (aufgerundet) 22 parenterale Zubereitungen des Wirkstoffs Ofatumumab hergestellt werden. Die Differenz zu den tatsächlich hergestellten Zubereitungen liegt bei 32. Unter Anwendung des weiteren Sicherheitsabschlags von 5 % ergibt sich (abgerundet) eine Anzahl von 30 Taten hinsichtlich des Wirkstoffs Ofatumumab.
1119Panitumumab
1120Für den Wirkstoff Panitumumab konnte die Kammer feststellen, dass im Tatzeitraum die in den Feststellungen aufgeführten 439 Zubereitungen hergestellt worden sind. Für diese 439 Zubereitungen hat die Kammer anhand der Daten aus Zenzy festgestellt, dass insgesamt eine Wirkstoffmenge von 202.496 mg erforderlich gewesen wäre. Die durchschnittliche Größe einer Arzneimittelzubereitung mit dem Wirkstoff Panitumumab betrug mithin abgerundet 461 mg. Unter Berücksichtigung des Sicherheitsabschlages von 10 % hat die Kammer einen (abgerundeten) Wert von 414 mg zugrunde gelegt. Unter weiterer Berücksichtigung der Wirkstofffüllmenge von nur 80 % ergibt sich insoweit eine durchschnittliche Wirkstoffmenge von 331 mg. Unter Zugrundelegung der Einkaufsmenge von 68.655 mg konnten mit der vorhandenen Wirkstoffmenge (aufgerundet) 208 parenterale Zubereitungen des Wirkstoffs Panitumumab hergestellt werden. Die Differenz zu den tatsächlich hergestellten Zubereitungen liegt bei 231 (439
1121686
1122abzgl. 208), mithin war für 231 kein Wirkstoff vorhanden. Unter Anwendung des weiteren Sicherheitsabschlags von 5 % ergibt sich (abgerundet) eine Anzahl von 219 Taten hinsichtlich des Wirkstoffs Panitumumab.
1123Pembrolizumab
1124Für den Wirkstoff Pembrolizumab konnte die Kammer feststellen, dass im Tatzeitraum die in den Feststellungen aufgeführten 19 Zubereitungen hergestellt worden sind. Für diese 19 Zubereitungen hat die Kammer anhand der Daten aus Zenzy festgestellt, dass insgesamt eine Wirkstoffmenge von 3.098 mg erforderlich gewesen wäre. Die durchschnittliche Größe einer Arzneimittelzubereitung mit dem Wirkstoff Pembrolizu-mab betrug mithin abgerundet 164 mg. Unter Berücksichtigung des Sicherheitsabschlages von 10 % hat die Kammer einen (abgerundeten) Wert von 147 mg zugrunde gelegt. Unter weiterer Berücksichtigung der Wirkstofffüllmenge von nur 80 % ergibt sich insoweit eine durchschnittliche Wirkstoffmenge von 117 mg. Unter Zugrundelegung der Einkaufsmenge von 1.870 mg konnten mit der vorhandenen Wirkstoffmenge (aufgerundet) 16 parenterale Zubereitungen des Wirkstoffs Pembrolizumab hergestellt werden. Die Differenz zu den tatsächlich hergestellten Zubereitungen liegt bei drei. Unter Anwendung des weiteren Sicherheitsabschlags von 5 % ergibt sich (abgerundet) eine Anzahl von zwei Taten hinsichtlich des Wirkstoffs Pembrolizumab.
1125Pemetrexed
1126Für den Wirkstoff Pemetrexed konnte die Kammer feststellen, dass im Tatzeitraum die in den Feststellungen aufgeführten 418 Zubereitungen hergestellt worden sind. Für diese 418 Zubereitungen hat die Kammer anhand der Daten aus Zenzy festgestellt, dass insgesamt eine Wirkstoffmenge von 383.325 mg erforderlich gewesen wäre. Die durchschnittliche Größe einer Arzneimittelzubereitung mit dem Wirkstoff Pemetrexed betrug mithin abgerundet 917 mg. Unter Berücksichtigung des Sicherheitsabschlages von 10 % hat die Kammer einen (abgerundeten) Wert von 825 mg zugrunde gelegt. Unter weiterer Berücksichtigung der Wirkstofffüllmenge von nur 80 % ergibt sich insoweit eine durchschnittliche Wirkstoffmenge von 660 mg. Unter Zugrundelegung der Einkaufsmenge von 177.100 mg konnten mit der vorhandenen Wirkstoffmenge (auf-
1127687
1128gerundet) 268 parenterale Zubereitungen des Wirkstoffs Pemetrexed hergestellt werden. Die Differenz zu den tatsächlich hergestellten Zubereitungen liegt bei 150 (418 abzgl. 268), mithin war für 150 Zubereitungen kein Wirkstoff vorhanden. Unter Anwendung des weiteren Sicherheitsabschlags von 5 % ergibt sich (abgerundet) eine Anzahl von 142 Taten hinsichtlich des Wirkstoffs Pemetrexed.
1129Pertuzumab
1130Für den Wirkstoff Pertuzumab konnte die Kammer feststellen, dass im Tatzeitraum die in den Feststellungen aufgeführten 967 Zubereitungen hergestellt worden sind. Für diese 967 Zubereitungen hat die Kammer anhand der Daten aus Zenzy festgestellt, dass insgesamt eine Wirkstoffmenge von 455.700 mg erforderlich gewesen wäre. Die durchschnittliche Größe einer Arzneimittelzubereitung mit dem Wirkstoff Pertuzumab betrug mithin abgerundet 471 mg. Unter Berücksichtigung des Sicherheitsabschlages von 10 % hat die Kammer einen (abgerundeten) Wert von 423 mg zugrunde gelegt. Unter weiterer Berücksichtigung der Wirkstofffüllmenge von nur 80 % ergibt sich insoweit eine durchschnittliche Wirkstoffmenge von 338 mg. Unter Zugrundelegung der Einkaufsmenge von 120.582 mg konnten mit der vorhandenen Wirkstoffmenge (aufgerundet) 357 parenterale Zubereitungen des Wirkstoffs Pertuzumab hergestellt werden. Die Differenz zu den tatsächlich hergestellten Zubereitungen liegt bei 610 (967 abzgl. 357), mithin war für 610 kein Wirkstoff vorhanden. Unter Anwendung des weiteren Sicherheitsabschlags von 5 % ergibt sich (abgerundet) eine Anzahl von 579 Taten hinsichtlich des Wirkstoffs Pertuzumab.
1131Ramucirumab
1132Für den Wirkstoff Ramucirumab konnte die Kammer feststellen, dass im Tatzeitraum die in den Feststellungen aufgeführten 121 Zubereitungen hergestellt worden sind. Für diese 121 Zubereitungen hat die Kammer anhand der Daten aus Zenzy festgestellt, dass insgesamt eine Wirkstoffmenge von 68.624 mg erforderlich gewesen wäre. Die durchschnittliche Größe einer Arzneimittelzubereitung mit dem Wirkstoff Ramucir-umab betrug mithin abgerundet 567 mg. Unter Berücksichtigung des Sicherheitsabschlages von 10 % hat die Kammer einen (abgerundeten) Wert von 510 mg zugrunde gelegt. Unter weiterer Berücksichtigung der Wirkstofffüllmenge von nur 80 % ergibt
1133688
1134sich insoweit eine durchschnittliche Wirkstoffmenge von 408 mg. Unter Zugrundelegung der Einkaufsmenge von 27.825 mg konnten mit der vorhandenen Wirkstoff-menge (aufgerundet) 69 parenterale Zubereitungen des Wirkstoffs Ramucirumab hergestellt werden. Die Differenz zu den tatsächlich hergestellten Zubereitungen liegt bei 52 (121 abzgl. 69), mithin war für 52 kein Wirkstoff vorhanden. Unter Anwendung des weiteren Sicherheitsabschlags von 5 % ergibt sich (abgerundet) eine Anzahl von 49 Taten hinsichtlich des Wirkstoffs Ramucirumab.
1135Rituximab
1136Für den Wirkstoff Rituximab konnte die Kammer feststellen, dass im Tatzeitraum die in den Feststellungen aufgeführten 2.207 Zubereitungen hergestellt worden sind. Für diese 2.207 Zubereitungen hat die Kammer anhand der Daten aus Zenzy festgestellt, dass insgesamt eine Wirkstoffmenge von 1.607.498,10 mg erforderlich gewesen wäre. Die durchschnittliche Größe einer Arzneimittelzubereitung mit dem Wirkstoff Rituximab betrug mithin abgerundet 728 mg. Unter Berücksichtigung des Sicherheitsabschlages von 10 % hat die Kammer einen (abgerundeten) Wert von 655 mg zugrunde gelegt. Unter weiterer Berücksichtigung der Wirkstofffüllmenge von nur 80 % ergibt sich insoweit eine durchschnittliche Wirkstoffmenge von 524 mg. Unter Zugrundelegung der Einkaufsmenge von 778.690 mg konnten mit der vorhandenen Wirkstoffmenge (aufgerundet) 1.487 parenterale Zubereitungen des Wirkstoffs Rituximab hergestellt werden. Die Differenz zu den tatsächlich hergestellten Zubereitungen liegt bei 720 (2.207 abzgl. 1.487), mithin war für 720 kein Wirkstoff vorhanden. Unter Anwendung des weiteren Sicherheitsabschlags von 5 % ergibt sich (abgerundet) eine Anzahl von 684 Taten hinsichtlich des Wirkstoffs Rituximab.
1137Temsirolimus
1138Für den Wirkstoff Temsirolimus konnte die Kammer feststellen, dass im Tatzeitraum die in den Feststellungen aufgeführten 450 Zubereitungen hergestellt worden sind. Für diese 450 Zubereitungen hat die Kammer anhand der Daten aus Zenzy festgestellt, dass insgesamt eine Wirkstoffmenge von 29.295 mg erforderlich gewesen wäre. Die durchschnittliche Größe einer Arzneimittelzubereitung mit dem Wirkstoff Temsirolimus betrug mithin abgerundet 65 mg. Unter Berücksichtigung des Sicherheitsabschlages
1139689
1140von 10 % hat die Kammer einen (abgerundeten) Wert von 58 mg zugrunde gelegt. Unter weiterer Berücksichtigung der Wirkstofffüllmenge von nur 80 % ergibt sich insoweit eine durchschnittliche Wirkstoffmenge von 46 mg. Unter Zugrundelegung der Einkaufsmenge von 9.900 mg konnten mit der vorhandenen Wirkstoffmenge (aufgerundet) 216 parenterale Zubereitungen des Wirkstoffs Temsirolimus hergestellt werden. Die Differenz zu den tatsächlich hergestellten Zubereitungen liegt bei 234 (450 abzgl. 216), mithin war für 234 kein Wirkstoff vorhanden. Unter Anwendung des weiteren Sicherheitsabschlags von 5 % ergibt sich (abgerundet) eine Anzahl von 222 Taten hinsichtlich des Wirkstoffs Temsirolimus.
1141Trabectedin
1142Für den Wirkstoff Trabectedin konnte die Kammer feststellen, dass im Tatzeitraum die in den Feststellungen aufgeführten 99 Zubereitungen hergestellt hat. Für diese 99 Zubereitungen hat die Kammer anhand der Daten aus Zenzy festgestellt, dass insgesamt eine Wirkstoffmenge von 195,53 mg erforderlich gewesen wäre. Die durchschnittliche Größe einer Arzneimittelzubereitung mit dem Wirkstoff Trabectedin betrug mithin abgerundet 1,98 mg. Unter Berücksichtigung des Sicherheitsabschlages von 10 % hat die Kammer einen (abgerundeten) Wert von 1,78 mg zugrunde gelegt. Unter weiterer Berücksichtigung der Wirkstofffüllmenge von nur 80 % ergibt sich insoweit eine durchschnittliche Wirkstoffmenge von 1,42 mg. Unter Zugrundelegung der Einkaufsmenge von 106,7 mg konnten mit der vorhandenen Wirkstoffmenge (aufgerundet) 76 paren-terale Zubereitungen des Wirkstoffs Trabectedin hergestellt werden. Die Differenz zu den tatsächlich hergestellten Zubereitungen liegt bei 23 (99 abzgl. 76), mithin war für 23 kein Wirkstoff vorhanden. Unter Anwendung des weiteren Sicherheitsabschlags von 5 % ergibt sich (abgerundet) eine Anzahl von 21 Taten hinsichtlich des Wirkstoffs Trabectedin.
1143Trastuzumab
1144Für den Wirkstoff Trastuzumab konnte die Kammer feststellen, dass im Tatzeitraum die in den Feststellungen aufgeführten 7.323 Zubereitungen hergestellt worden sind. Für diese 7.323 Zubereitungen hat die Kammer anhand der Daten aus Zenzy festgestellt, dass insgesamt eine Wirkstoffmenge von 2.756.345,20 mg erforderlich gewesen
1145690
1146wäre. Die durchschnittliche Größe einer Arzneimittelzubereitung mit dem Wirkstoff Trastuzumab betrug mithin abgerundet 376 mg. Unter Berücksichtigung des Sicherheitsabschlages von 10 % hat die Kammer einen (abgerundeten) Wert von 338 mg zugrunde gelegt. Unter weiterer Berücksichtigung der Wirkstofffüllmenge von nur 80 % ergibt sich insoweit eine durchschnittliche Wirkstoffmenge von 270 mg. Unter Zugrundelegung der Einkaufsmenge von 474.547,50 mg konnten mit der vorhandenen Wirk-stoffmenge (aufgerundet) 1.758 parenterale Zubereitungen des Wirkstoffs Trastuzu-mab hergestellt werden. Die Differenz zu den tatsächlich hergestellten Zubereitungen liegt bei 5.565 (7.323 abzgl. 1.758), mithin war für 5.565 kein Wirkstoff vorhanden. Unter Anwendung des weiteren Sicherheitsabschlags von 5 % ergibt sich (abgerundet) eine Anzahl von 5.286 Taten hinsichtlich des Wirkstoffs Trastuzumab.
1147Trastuzumab Emtansine
1148Für den Wirkstoff Trastuzumab Emtansine konnte die Kammer feststellen, dass im Tatzeitraum die in den Feststellungen aufgeführten 228 Zubereitungen hergestellt worden sind. Für diese 228 Zubereitungen hat die Kammer anhand der Daten aus Zenzy festgestellt, dass insgesamt eine Wirkstoffmenge von 59.488,60 mg erforderlich gewesen wäre. Die durchschnittliche Größe einer Arzneimittelzubereitung mit dem Wirkstoff Trastuzumab Emtansine betrug mithin abgerundet 260 mg. Unter Berücksichtigung des Sicherheitsabschlages von 10 % hat die Kammer einen (abgerundeten) Wert von 234 mg zugrunde gelegt. Unter weiterer Berücksichtigung der Wirkstofffüllmenge von nur 80 % ergibt sich insoweit eine durchschnittliche Wirkstoffmenge von 187 mg. Unter Zugrundelegung der Einkaufsmenge von 23.144 mg konnten mit der vorhandenen Wirkstoffmenge (aufgerundet) 123 parenterale Zubereitungen des Wirkstoffs Trastuzumab Emtansine hergestellt werden. Die Differenz zu den tatsächlich hergestellten Zubereitungen liegt bei 105 (228 abzgl. 123), mithin war für 105 kein Wirkstoff vorhanden. Unter Anwendung des weiteren Sicherheitsabschlags von 5 % ergibt sich (abgerundet) eine Anzahl von 99 Taten hinsichtlich des Wirkstoffs Trastuzumab Emtansine.
1149Treosulfan
1150Für den Wirkstoff Treosulfan konnte die Kammer feststellen, dass im Tatzeitraum die
1151691
1152in den Feststellungen aufgeführten 119 Zubereitungen hergestellt worden sind. Für diese 119 Zubereitungen hat die Kammer anhand der Daten aus Zenzy festgestellt, dass insgesamt eine Wirkstoffmenge von 872.600 mg erforderlich gewesen wäre. Die durchschnittliche Größe einer Arzneimittelzubereitung mit dem Wirkstoff Treosulfan betrug mithin abgerundet 7.332 mg. Unter Berücksichtigung des Sicherheitsabschlages von 10 % hat die Kammer einen (abgerundeten) Wert von 6.598 mg zugrunde gelegt. Unter weiterer Berücksichtigung der Wirkstofffüllmenge von nur 80 % ergibt sich insoweit eine durchschnittliche Wirkstoffmenge von 5.278 mg. Unter Zugrundelegung der Einkaufsmenge von 519.200 mg konnten mit der vorhandenen Wirkstoff-menge (aufgerundet) 99 parenterale Zubereitungen des Wirkstoffs Treosulfan hergestellt werden. Die Differenz zu den tatsächlich hergestellten Zubereitungen liegt bei 20 (119 abzgl. 99), mithin war für 20 kein Wirkstoff vorhanden. Unter Anwendung des weiteren Sicherheitsabschlags von 5 % ergibt sich (abgerundet) eine Anzahl von 19 Taten hinsichtlich des Wirkstoffs Treosulfan.
1153Vinblastin
1154Für den Wirkstoff Vinblastin konnte die Kammer feststellen, dass im Tatzeitraum die in den Feststellungen aufgeführten 124 Zubereitungen hergestellt worden sind. Für diese 124 Zubereitungen hat die Kammer anhand der Daten aus Zenzy festgestellt, dass insgesamt eine Wirkstoffmenge von 1.293,32 mg erforderlich gewesen wäre. Die durchschnittliche Größe einer Arzneimittelzubereitung mit dem Wirkstoff Vinblastin betrug mithin abgerundet 10,43 mg. Unter Berücksichtigung des Sicherheitsabschlages von 10 % hat die Kammer einen (abgerundeten) Wert von 9,3 mg zugrunde gelegt. Unter weiterer Berücksichtigung der Wirkstofffüllmenge von nur 80 % ergibt sich insoweit eine durchschnittliche Wirkstoffmenge von 7,4 mg. Unter Zugrundelegung der Einkaufsmenge von 858 mg konnten mit der vorhandenen Wirkstoffmenge (aufgerundet) 116 parenterale Zubereitungen des Wirkstoffs Vinblastin hergestellt werden. Die Differenz zu den tatsächlich hergestellten Zubereitungen liegt bei acht. Unter Anwendung des weiteren Sicherheitsabschlags von 5 % ergibt sich (abgerundet) eine Anzahl von sieben Taten hinsichtlich des Wirkstoffs Vinblastin.
1155Vinflunin
1156692
1157Für den Wirkstoff Vinflunin konnte die Kammer feststellen, dass im Tatzeitraum die in den Feststellungen aufgeführten 59 Zubereitungen hergestellt worden sind. Für diese 59 Zubereitungen hat die Kammer anhand der Daten aus Zenzy festgestellt, dass insgesamt eine Wirkstoffmenge von 37.146 mg erforderlich gewesen wäre. Die durchschnittliche Größe einer Arzneimittelzubereitung mit dem Wirkstoff Vinflunin betrug mithin abgerundet 629 mg. Unter Berücksichtigung des Sicherheitsabschlages von 10 % hat die Kammer einen (abgerundeten) Wert von 566 mg zugrunde gelegt. Unter weiterer Berücksichtigung der Wirkstofffüllmenge von nur 80 % ergibt sich insoweit eine durchschnittliche Wirkstoffmenge von 452 mg. Unter Zugrundelegung der Einkaufsmenge von 8.690 mg konnten mit der vorhandenen Wirkstoffmenge (aufgerundet) 20 parenterale Zubereitungen des Wirkstoffs Vinflunin hergestellt werden. Die Differenz zu den tatsächlich hergestellten Zubereitungen liegt bei 39 (59 abzgl. 20), mithin war für 39 kein Wirkstoff vorhanden. Unter Anwendung des weiteren Sicherheitsabschlags von 5 % ergibt sich (abgerundet) eine Anzahl von 37 Taten hinsichtlich des Wirkstoffs Vinflunin.
1158(3) Tatbegehung durch den Angeklagten
1159Die Kammer ist überzeugt, dass der Angeklagte die ganz überwiegende Anzahl der unterdosierten Zubereitungen eigenhändig herstellte. Direkte Beweismittel gibt es zwar nicht. Niemand hat den Angeklagten unmittelbar beobachtet, wie er beispielsweise in einen Infusionsbeutel eine zu geringe Menge an Wirkstoff einfüllte. Die Kammer hat ihre Überzeugung aber durch eine Gesamtwürdigung sonstiger objektiver Umstände gewonnen:
1160Der Angeklagte war derjenige, der täglich ungestört die Gelegenheit hatte, eine Vielzahl unterdosierter Arzneimittelzubereitungen herzustellen. Nach den Angaben der Zeugen, die ebenfalls im Reinraumlabor tätig waren, arbeitete er als einziger stets allein und damit unbeobachtet. Nicht nur verzichtete er darauf, jeweils einen weiteren Mitarbeiter zur Herstellung nach dem „Vier-Augen-Prinzip“ hinzuziehen, er arbeitete nur, wenn kein anderer Mitarbeiter im Reinraumlabor anwesend war. Diese Möglichkeit des unbeobachteten Unterdosierens erklärt plausibel, weshalb der Angeklagte überhaupt selbst im Labor tätig war. Denn die intensive tägliche Laborarbeit, wie sie der Angeklagte pflegte, ist für einen Apothekenleiter sehr ungewöhnlich und wird in
1161693
1162vergleichbaren Apotheken in aller Regel vollständig nachgeordneten Mitarbeitern überlassen, meist den pharmazeutisch-technischen Assistenten. So haben es insbe-
1163sondere die Apotheker E und Dr. M als Zeugen geschildert. Soweit der Ange-
1164klagte gegenüber dem Sachverständigen Prof. S gesagt hat, er könne ein Labornur leiten, wenn er auch Einblick in die Herstellungspraxis habe (wörtlich: „Wer da drin ist und die Aufsicht führt, der muss auch herstellen können“), hätte dieser Einblick sicherlich keine tägliche Mitarbeit erfordert. Dies gilt umso mehr, als der Angeklagte durch sein sonstiges berufliches und außerberufliches Engagement extrem einge-
1165spannt war, wie er selbst gegenüber dem Sachverständigen Prof. S äußerte.
1166Der Angeklagte war weiter der einzige, der von den Unterdosierungen unmittelbar wirtschaftlich profitierte, und zwar im Millionenbereich. Er kannte die Einkaufspreise der Wirkstoffe genau und wusste, welche Unterdosierungen in welchem Umfang ihm welchen finanziellen Vorteil verschaffen würden. Es lag in seinem kriminellen Interesse, eine möglichst geringe Menge an Wirkstoff einzusetzen. Angesichts der völlig fehlenden Kontrollen handelte es sich aus seiner Sicht um das „perfekte Verbrechen“.
1167Der Angeklagte war vor allem aber die zentrale Person der Apotheke, insbeson-
1168dere des Reinraumlabors: Er war der Inhaber und Chef, er war jeden Tag im Labor, er teilte die Arbeit ein, er bestellte die Wirkstoffe, er gab morgens die Lieferungen frei, er suchte sich sein Personal selbst aus. Namentlich den angestellten PTAs war er aufgrund seiner überragenden Kenntnisse als vielseitig pharmazeutisch und betriebswirtschaftlich ausgebildeter Apotheker, der den Betrieb überdies seit Kindesbeinen kannte, fachlich und intellektuell haushoch überlegen.
1169Vor diesem Hintergrund erachtet es die Kammer als völlig ausgeschlossen, dass nicht der Angeklagte, sondern andere Personen das Unterdosieren von Arzneimitteln geplant und/oder eigenhändig in die Tat umgesetzt haben könnten. Die Kammer zieht vielmehr den Schluss, dass es der Angeklagte war, der den Plan, Arzneimittezuberei-tungen unterzudosieren, selbst fasste und sodann in die Tat umsetzte.
1170Die Kammer ist allerdings weiter überzeugt, dass der Angeklagte andere Mitarbeiter des Reinraumlabors veranlasste, ebenfalls unterdosierte Zubereitungen herzustellen, was diese jedenfalls in einzelnen Fällen taten. Wie diese Veranlassung im Einzelnen geschehen ist, bleibt nach der Beweisaufnahme offen. Eine ausdrückliche Anweisung des Angeklagten, in konkreten Einzelfällen unterzudosieren, ist nicht feststellbar. Jedoch geschahen die Unterdosierungen durch Mitarbeiter im generellen Wissen und
1171694
1172Einverständnis des Angeklagten:
1173Die als Zeugen vernommenen Mitarbeiter des Reinraumlabors (EM, Dr. WM, FM) haben allerdings ausgesagt, jedenfalls nicht entsprechend angewiesen oder sonst aufgefordert worden zu sein, Zubereitungen falsch zu dosieren. Sie hätten auch keine Kenntnis, dass andere Mitarbeiter zu Unterdosierungen veranlasst worden seien. Dies besagt allerdings wenig, da ohnehin nicht anzunehmen ist, dass der Angeklagte die Mehrzahl seiner Mitarbeiter einweihte. Die Kammer zieht ihren Schluss daraus, dass bei den am 29.11.2016 sichergestellten unterdosierten Zubereitungen anhand der Her-
1174stellungsprotokolle die Herstellung durch die Mitarbeiter und GM nachzu-weisen ist (siehe dazu näher unten) . Daraus leitet die Kammer ab, dass eine solche Einbindung auch schon früher stattfand. Denn es ist nicht davon auszugehen, dass der Angeklagte über einen rund fünfjährigen Tatzeitraum ausschließlich eigenhändig unterdosierte Zubereitungen herstellte und ausgerechnet bei einer größeren Zahl unterdosierter Zubereitungen, die zur Auslieferung am Tag der Durchsuchung bestimmt waren, (erstmals) Mitarbeiter mitwirkten.
1175Die Kammer schließt dabei aus, dass Mitarbeiter „auf eigene Faust", also ohne Veranlassung, Kenntnis und Billigung des Angeklagten absichtlich unterdosierte Zubereitungen herstellten. Dagegen sprechen nicht nur ein fehlendes Motiv und die gegenseitige Kontrolle durch das „Vier-Augen-Prinzip", sondern vor allem die bereits
1176benannte zentrale Stellung des Angeklagten als Leiter der Apotheke und desReinraumlabors. Er hatte insbesondere das Reinraumlabor unter seiner festen Kontrolle (siehe oben), so dass ein eigenmächtiges Abweichen von seinen Vorgaben nicht in Betracht kam.
1177c) Feststellungen zu den Zubereitungen, die am 29.11.2016 sichergestellt wurden
1178Die Feststellungen zu den 66 unterdosierten parenteralen Arzneimittelzubereitungen, die am 29.11.2016 von den Ermittlungsbeamten sichergestellt wurden, beruhen auf den Ausführungen der Sachverständigen und Zeugen M und Dr. GM, den An-
1179gaben des Zeugen KHK der Zeuginnen KK'in G und LM sowie aufverlesenen Urkunden. Der Angeklagte hat insoweit gegenüber dem Sachverständigen
1180Prof. nur Angaben zu seiner Abwesenheit im Reinraumlabor am 28.11.2016gemacht (dazu sogleich im Rahmen der Zuordnung der einzelnen Zubereitungen).
1181695
1182(1) Durchsuchung des Reinraumlabors und Dokumentation der sichergestellten Proben
1183Die Feststellungen der Kammer zur Durchsuchung des Reinraumlabors der Apo-
1184theke am 29.11.2016 beruhen auf den glaubhaften Angaben der Zeugin KK'in GM, des Sachverständigen und Zeugen IM und der Zeugin IM. Die Zeuginnen und der Sachverständige haben die Räumlichkeiten sowie die Sicherstellung der insge-samt 117 parenteralen Arzneimittelzubereitungen übereinstimmend und zur Überzeu-gung der Kammer geschildert.
1185Ergänzend hat die Kammer den Durchsuchungsbericht der Zeugin KK'in GH vom
118630.11.2016, der das Reinraumlabor und die Örtlichkeiten an der 37 betrifft,
1187durch Verlesen in die Hauptverhandlung eingeführt. Ergänzend hat die Kammer weiter ein Sicherstellungsprotokoll zu Tat 61.864 der Anklage (Patientin B), welches
1188die Zeugin KK'in GH erstellt hatte, exemplarisch durch Verlesen in dieHauptverhandlung eingeführt. Dieses Sicherstellungsprotokoll, welches nach den
1189überzeugenden Angaben der KK'in G für jede sichergestellte Probe existiert,dokumentiert die Nummerierung und die Inhaltsangaben (u.a. Name des Patienten,
1190Wirkstoff, Menge, Kennziffer der Apotheke) auf den jeweiligen parenteralenArzneimittelzubereitungen, wie sie sich aus den aufgeklebten Etiketten ergeben. Die Kammer schließt aufgrund dieser detaillierten Dokumentation aus, dass es zu Verwechslungen von einzelnen Proben gekommen sein könnte.
1191Die Feststellungen zu den Herstellungsprotokollen und Therapieinformationen, insbe-
1192sondere auch zur Herstellungskennziffer der Apotheke sowie den weiteren dortenthaltenen einzelnen Angaben zu jeder parenteralen Arzneimittelzubereitung beruhen zu den Taten 61.864 bis 61.930 der Anklage auf den im Wege des Selbstleseverfahrens in die Hauptverhandlung eingeführten Urkunden. Die Kammer hat zu allen parenteralen Arzneimittelzubereitungen hinsichtlich derer der Angeklagte verurteilt wurde, das Herstellungsprotokoll oder - sofern dieses nicht vorhanden war - die Therapieinformation aus Zenzy im Selbstleseverfahren eingeführt. Die Angaben zu Menge und Wirkstoff der parenteralen Arzneimittelzubereitungen beruhen ergänzend auf den Angaben der Sachverständigen LM und Dr. GM. Ergänzend hat die Kammer exemplarisch das Herstellungsprotokoll
1193zu der parenteralen Arzneimittelzubereitung der Patientin - dieses
1194696
1195betrifft die von der Zeugin K am 26.10.2016 der Polizei übergebene Probe - durch
1196Verlesen in die Hauptverhandlung eingeführt.
1197(2) Analyse des Sachverständigen L (Landeszentrum für Gesundheit)
1198Die Feststellungen zu den Unterdosierungen bei den Taten 61.893 bis 61.930 der Anklage beruhen auf der plausiblen und in sich schlüssigen Darstellung des Sachver-
1199ständigen L , der als Zeuge ergänzende Informationen gegeben hat.
1200Qualifikation und Tätigkeit des Sachverständigen L
1201Der Sachverständige L ist ausgebildeter Apotheker und Mitarbeiter des Landes-
1202zentrums für Gesundheit Nordrhein-Westfalen (im Folgenden LZG). Das LZG ist die zuständige Stelle für die Überwachung pharmazeutischer Unternehmen in Nordrhein-Westfalen und übernimmt als Arzneimitteluntersuchungsstelle laufend die chemisch-pharmazeutische Analyse von Arzneimittelproben. Der Sachverständige L gehörtder Arzneimitteluntersuchungsstelle an. Er verfügt über umfangreiche praktische Erfahrung bei der Analyse von Arzneimitteln.
1203Das LZG ist von der Deutschen Akkreditierungsstelle (Dakks) für die Untersuchung von Arzneimitteln akkreditiert, diese Akkreditierung umfasst neben den vorliegend angewandten Methoden (dazu sogleich) auch die Möglichkeit der Arbeit im so genannten flexiblen Bereich, also die Befugnis zur Modifizierung, Weiter- und Neuentwicklung von Prüfverfahren. Die Akkreditierung bestätigt, dass die Stelle ihre Aufgaben fachkundig und nach geltenden Anforderungen erfüllt. Damit unterliegt das LZG einer stetigen Überwachung durch die Akkreditierungsstelle, die eine Überprüfung des Systems der Qualitätssicherung vornimmt, so auch im Hinblick auf die Vorgaben für die Lagerung von Proben, für die Prüfung von Geräten und die von den Mitarbeitern einzuhaltenden Anweisungen.
1204Weiter verfügt das LZG für verschiedene Bereiche über sog. Standard Operating Pro-cedures (im Folgenden SOP), mithin verbindliche Verfahrensanweisungen, die die Vorgaben an eine konkrete Tätigkeit beschreiben.
1205697
1206Ablauf der Sicherstellung und Transport der Proben
1207Der Sachverständige L hat glaubhaft und nachvollziehbar die Sicherstellung der
1208insgesamt 117 sichergestellten Zubereitungen erläutert: Die Proben seien zunächst durchgehend temperaturkontrolliert und geschützt zum LZG nach Münster transportiert worden. Insoweit habe er nach der Durchsuchung und Sicherstellung der Proben, bei der er selbst zugegen war, zunächst die verwendeten Wirkstoffe ermittelt, um den ordnungsgemäßen Transport und die hinreichende Kühlung und Lagerung der sichergestellten Proben überprüfen zu können. Die gekühlt zu transportierenden Proben seien entsprechend gekühlt transportiert und vor, während und nach dem Transport mit Temperatur-Loggern und Thermometern kontrolliert worden. Auffälligkeiten habe es nicht gegeben. Die temperaturkontrollierte Lagerung sei auch im LZG fortgesetzt worden. Die Lagerung sei entsprechend den Vorgaben eines Wirkstoffs entweder gekühlt oder bei Raumtemperatur erfolgt.
1209Die 29 Zubereitungen, die laut Etikett mit monoklonalen Antikörpern hergestellt waren, habe er ausgesondert und an das Paul-Ehrlich-Institut (im Folgenden PEI) in Langen
1210übermittelt, wo sie von dem Sachverständigen Dr. G untersucht worden seien(dazu sogleich).
1211Die weiteren 88 Proben seien im LZG zur Untersuchung verblieben. Hinsichtlich vier dieser verbliebenen 88 Proben habe sich sodann herausgestellt, dass eine Untersuchung nicht habe stattfinden können: Zwei der Proben hätten mangels geeigneter Verfahren nicht geeignet geprüft werden können, zwei weitere Proben seien auskristallisiert gewesen. Für die verbliebenen 84 Proben habe er - unter Beachtung der Verfahrensanweisungen des LZG - dann zunächst Prüfaufträge erstellt, die er nach dem jeweiligen, sich aus der Etikettierung einer Zubereitung ergebenen Wirkstoff ausgerichtet habe.
1212Prüfungen/Messverfahren des Sachverständigen L
1213HPLC/DAD und Stabilitätsvergleichsmuster
1214Hinsichtlich der Proben sei er, der Sachverständige L , wie folgt vorgegangen:
1215698
1216Alle 84 Proben seien mittels Hochleistungsflüssigkeitschromatographie/-Diodenarray-detektion (HPLC/DAD) überprüft worden. Für dieses Verfahren sei das LZG akkreditiert.
1217Bei der Hochleistungsflüssigkeitschromatographie handelt sich um ein chromatogra-phisches Trennverfahren: Die zu untersuchende Substanz wird zusammen mit einem Laufmittel, der so genannten mobilen Phase, unter hohem Druck durch eine sogenannte Trennsäule gepresst. In dieser Trennsäule befindet sich eine weitere Substanz, die so genannte stationäre Phase. Bei dem Vorgang des Durchpressens kommt es zu mehr oder weniger starken Wechselwirkungen der Bestandteile der zu untersuchenden Substanz (hier: der Zubereitung) mit der stationären Phase. Je nach Stärke der Wechselwirkung verlassen die Bestandteile die Trennsäule früher oder später und erscheinen zu verschiedenen Zeiten an der Ausgangsstelle der Trennsäule, wo sie hier mit einem Diodenarray-Detektor erfasst werden.
1218Diese Untersuchungen seien auf Grundlage der Verfahrensanweisungen, die der Ak-kreditierung des LZG zugrunde lagen, erfolgt. Die HPLC-Geräte seien ordnungsgemäß geeicht, es handele sich dabei um Standardarbeitsgeräte des LZG.
1219Sofern mit dieser Methode ein Mindergehalt einer Zubereitung festgestellt worden sei,
1220habe er, der Sachverständige L , dann zu einem späteren Zeitpunkt unter dengleichen Bedingungen eine zweite Prüfung mittels HPLC/DAD durchgeführt. Insoweit habe bei dieser zweiten Prüfung auch festgestellt werden können, ob es zwischenzeitlich zu einem Wirkstoffabbau gekommen sei.
1221Vorab habe er zudem für alle im LZG untersuchten Wirkstoffe so genannte Stabilitäts-vergleichsmuster, also Nachbauten der Proben, angefertigt. Dazu habe er - mit Ausnahme eines Wirkstoffs - das verwendete Fertigarzneimittel von denselben Herstellern angefordert, von denen auch die vom Angeklagten verwendeten Wirkstoffe stammten. Zudem habe er auch für die von dem Angeklagten verwandten Trägerlösungen Vergleichspräparate von den Herstellern bestellt, die auch den Angeklagten belieferten. Nur in einem Fall habe er auf ein sichergestelltes Behältnis aus der Apotheke des Angeklagten zur Herstellung des Stabilitätsvergleichsmusters zurückgriffen.
1222Mit diesen Substanzen - Wirkstoff und Trägerlösung - habe der Sachverständige
1223L dann Vergleichsproben (eben die „Stabilitätsvergleichsmuster“) hergestellt, dieden Inhalten entsprachen, die sich aus den Etiketten auf den sichergestellten Proben
1224699
1225ergaben (= Soll-Dosierung). Die Lagerung sei entsprechend der Vergleichsprobe aus dem Labor des Angeklagten erfolgt. Diese Stabilitätsvergleichsmuster habe er ebenfalls mittels HPLC/DAD untersucht. Die Testung der Stabilitätsvergleichsmuster, deren Wirkstoffgehalt aufgrund der eigenen Anfertigung bekannt gewesen sei, mittels HPLC/DAD habe die Wirksamkeit des Testverfahrens nachgewiesen. Die erwarteten Wirkstoffgehalte seien auch gemessen worden. Dies bestätige die Richtigkeit der gemessenen Wirkstoffgehalte der Proben aus dem Labor des Angeklagten.
1226Zusätzlich: Messung des Platingehalts mit optischer Emissionsspektrometrie
1227Für die platinhaltigen Wirkstoffe (Cisplatin, Carboplatin, Oxaliplatin) , die nach der ersten Beprobung Mindergehalte aufgewiesen hätten, habe er, der Sachverständige
1228L , zusätzlich zur zweiten Messung mittels HPLC/DAD zudem eine Absicherungseiner Ergebnisse über eine Feststellung des Platingehalts mittels des Verfahrens der optischen Emissionsspektrometrie mit induktiv gekoppeltem Plasma (im Folgenden ICP/OES) vorgenommen.
1229Die Besonderheit bei Platin liege darin, dass es sich als chemisches Element (Pt, Ord-nungszahl 78) nicht abbaut, so dass die Lagerbedingungen (Temperatur, Lagerzeit, Lichteinfall usw.) keinen Einfluss auf den Gehalt an Platin in einer Zubereitung haben können. Somit könne aus dem Platingehalt in der Lösung der Rückschluss gezogen werden, wieviel Wirkstoff sich ursprünglich in der jeweiligen Trägerlösung befunden habe. Hinsichtlich dieser platinhaltigen Wirkstoffe seien auch die Stabilitätsvergleichsmuster hinsichtlich ihres Platingehaltes untersucht worden, um einen Platinabbau durch Zeitablauf bzw. Lagerung ausschließen zu können. Diese Platinwerte hätten durchweg die Ergebnisse der HPLC/DAD-Beprobung bestätigt.
1230Zusätzlich: Messung des Bezylalkoholgehalts
1231Für den Wirkstoff Etoposid, dem von Herstellerseite ergänzend Benzylalkohol als Konservierungsstoff zugesetzt ist, sei eine ergänzende Überprüfung dieses Anteils von Benzylalkohol, der hinsichtlich des Anteils in der Zubereitung dem Anteil des Wirkstoffs Etoposid entspreche, mittels HPLC/DAD vorgenommen worden. Auch insoweit habe der Anteil an Benzylalkohol dem Mindergehalt des Wirkstoffs Etoposid entsprochen.
1232![]() Zusätzlich: Gewichtsbeprobung
Zusätzlich: Gewichtsbeprobung
Ergänzend habe er, der Sachverständige L , zur Validierung seiner Ergebnisse
1234für die Infusionsbeutel mit 0,9 %-iger NaCl-Trägerlösung eine Gewichtsbeprobung durchgeführt. Ausgangspunkt sei gewesen, dass das Bruttogewicht der wirkstofffreien Beutel um das Gewicht des hinzugefügten Wirkstoffkonzentrates erhöht sein müsse. Die Gewichte der Proben aus dem Labor des Angeklagten seien insoweit durch Wiegen ermittelt worden. Weiter habe er die Bruttogewichte der herstellerseits bestellten Trägerlösung ermittelt. Dabei habe er solche Infusionsbeutel verwendet, die den Chargen von einem Teil der Proben aus dem Labor des Angeklagten entstammten. Anhand von zehn wirkstofffreien Infusionsbeuteln mit 250 ml 0,9 %iger NaCl-Lösung und fünf wirkstofffreien Infusionsbeuteln mit 500 ml 0,9 %iger NaCl-Lösung habe er die Durchschnittsgewichte ermittelt. Dabei sei zunächst festzustellen gewesen, dass die Bruttogewichte relativ geringe Schwankungen innerhalb einer Charge aufwiesen. Das Durchschnittsgewicht eines 250 ml-Beutels Trägerlösung habe bei 278,7 g und eines 500 ml-Beutels bei 539,8 g gelegen. Anhand der Probenetiketten bzw. der Angaben in den Herstellungsprotokollen habe er die jeweils im Rahmen der Herstellung in die Beutel injizierten Volumen an Wirkstoffkonzentrat ermittelt und ausgehend von einer Dichte der Wirkstoffkonzentrate von ca. 1 g/ml das jeweils danach eingebrachte Gewicht an Wirkstoffkonzentrat berechnet. Von den ermittelten Gewichten der Proben aus dem Labor des Angeklagten sei das berechnete Wirkstoffgewicht in Abzug gebracht worden, um das theoretische Bruttogewicht der wirkstofffreien Trägerlösung zu ermitteln. Die ermittelten Gewichte für die Proben aus dem Labor des Angeklagten hätten dabei deutlich unter dem erwarteten Wert gelegen: durchschnittlich hätten die Proben aus dem Labor des Angeklagten ein Gewicht (abzüglich der deklarierten Wirk-stoffzugabe) von 260,09 g (Werte zwischen 239,2 g und 267,6 g) ausgewiesen. Dies entspreche nicht dem ermittelten Bruttogewicht der wirkstofffreien Beutel derselben Charge von 278,8 g. Hinweise, wonach den Infusionsbeuteln vor Zugabe des Wirk-stoffkonzentrates ein Teil der Trägerlösungen entnommen worden wäre, seien den Herstellungsprotokollen nicht zu entnehmen. Bei anderen, im LZG untersuchten Proben aus dem Labor des Angeklagten sei eine solche Entnahme in den Herstellungsprotokollen explizit vermerkt gewesen.
1235701
1236Zusätzlich: Augenschein
1237Für die Probe 90 (Tat 61.922 der Anklage, ausführlich sogleich) hat der Sachverstän-
1238dige L ergänzend - ebenfalls nur zur Validierung seines Ergebnisses - festge-stellt, dass auch nach dem äußeren Erscheinungsbild der Probe, die klar erschien, ein Mindergehalt anzunehmen sei. Andere Zubereitungen, die ebenfalls den Wirkstoff Fo-
1239linsäure enthielten, hätten - wie es dem Sachverständige L auch im Übrigen be-kannt sei - eine gelbliche Verfärbung gehabt. Dies sei auf die gelbliche Farbe des
1240Wirkstoffs Folinsäure des Herstellers der auf dem Herstellungsprotokoll ausge-wiesen gewesen sei, zurückzuführen. Bei der Probe 97 mit dem gleichen deklarierten Gehalt an Folinsäure, die zudem als ordnungsgemäß befüllt beprobt worden sei, habe hingegen die für den Wirkstoff typische Verfärbung vorgelegen. Die entsprechenden Lichtbilder hat die Kammer durch Inaugenscheinnahme in die Hauptverhandlung eingeführt und die unterschiedliche Verfärbung festgestellt.
1241Dies steht nicht im Widerspruch zu den Ausführungen des Sachverständigen Prof.
1242Sch , der ausgesagt hat, in der Regel lasse sich eine Unterdosierung nicht an der
1243Farbe der Zubereitung erkennen. Den Wirkstoff Folinsäure hatte Prof. Sch auf
1244Nachfrage als farblos bezeichnet. Tatsächlich ist die Färbung von so geringem Grad, dass ein Unterschied nur bei direktem Vergleich von Zubereitungen mit und ohne Wirkstoff auffällt.
1245Kein Mindergehalt durch Wirkstoffabbau
1246Die Stabilität der Wirkstoffe der Proben zu den Taten 61.893 bis 61.930 der Anklage aus dem Labor des Angeklagten sei gewährleistet gewesen, wie der
1247Sachverständige L zur Überzeugung der Kammer ausgeführt hat. EinWirkstoffabbau, der die Mindergehalte erklären könnte, sei nicht festzustellen gewesen. Anhand der Stabilitätsvergleichsmuster sei die Feststellung zu treffen, dass eine Zubereitung zum Zeitpunkt der Untersuchung, die teilweise aufgrund der Vielzahl an zu untersuchenden Proben erst mehrere Wochen nach der Sicherstellung erfolgen konnte, weiterhin hinreichend stabil gewesen sei, dass also ein Abbau des Wirkstoffs allein aufgrund des Zeitablaufs und/oder der Umstände der Lagerung ausgeschlossen werden konnte. Nur für die beiden Zubereitungen mit dem Wirkstoff Doxetacel sei für die Zeitspanne zwischen Sicherstellung und Beprobung bei dem Stabilitätsmuster eine Auskristallisierung zu beobachten gewesen.
1248702
1249Bei einer Probe mit dem Wirkstoff Mitomycin habe der Abbau im Stabilitätsver-gleichsmuster den Mindergehalt der sichergestellten Zubereitung erklären können.
1250Als Orientierung habe er, der Sachverständige L , außerdem die sog. STABIL®-
1251Liste zugrunde gelegt. Dabei handele es sich um eine tabellarische Übersicht zur phy-sikalisch-chemischen Stabilität von Stammlösungen und applikationsfertigen Zuberei-tungen der auf dem Markt befindlichen Zytostatika-Fertigarzneimittel.
1252Festlegung von Messunsicherheiten
1253Für jede Beprobung habe er, der Sachverständige L , gesondert eine Messunsi-
1254cherheit festgelegt. Diese Messunsicherheit sei mit einem Wert von mindestens 3 % festgesetzt worden. Sie sei rechnerisch ermittelt worden, dabei seien individuell für jede Probe verschiedene Kriterien aus der Gehaltsbestimmung, so z.B. die Streuung, Kalibriergrade oder das Bruttogewicht berücksichtigt worden. Geringe Abweichungen zwischen den beiden Beprobungen einer Probe oder geringe Abweichungen zum Stabilitätsvergleichsmuster seien - soweit nicht anders ausgeführt - jeweils mit dieser Messunsicherheit zu erklären gewesen.
1255Mitwirkung von Mitarbeitern
1256Der Sachverständige L führte weiter aus, dass er selbst als Prüfleiter für alle
1257Proben, die einen Mindergehalt aufgewiesen hätten, tätig gewesen sei. Er habe die gesamte Untersuchung geleitet und überwacht. Mit der konkreten Durchführung einzelner Testverfahren seien indes auch andere Mitarbeiter des LZG betraut worden. Bei den Mitarbeitern habe es sich durchweg um geschulte Mitarbeiter gehandelt, die der ständigen Kontrolle durch das Qualitätssicherungssystem des LZG unterlägen; Chemielaboranten bzw. chemisch-technische Assistenten und eine geschulte medizinisch-technische Assistentin. Er, der Sachverständige selbst, habe für jede einzelne Probe aus dem Labor des Angeklagten einen Prüfauftrag geschrieben, der die anzuwendende Methode und weitere Vorgaben enthalten habe. Aufgabe des Mitarbeiters sei dann die Bedienung des jeweiligen Testgerätes und die Erstellung einer Testanalyse und eines Reportes gewesen. Ein weiterer Mitarbeiter habe dann nochmal jeden einzelnen Parameter untersucht. Den entsprechenden Report habe er als Prüfleiter geprüft und individuell entschieden, ob
1258703
1259eine Wiederholung oder die Anwendung weiterer Methoden erforderlich seien. Zudem habe er die Messunsicherheit bestimmt. Die Mitarbeiter hätten zudem seiner Anweisung entsprechend die Stabilitätsvergleichsmuster erstellt, dabei handele es sich um eine einfach gelagerte Tätigkeit. Bei allen Testverfahren sei das Vier-Augen-Prinzip angewandt worden.
1260Ergebnisse des Sachverständigen LM
1261Der Sachverständige M ist insoweit zu den Taten 61.893 bis 61.930 der Anklage zu folgenden Ergebnissen an Mindergehalten von Zubereitungen gekommen. (Die Kammer hat ihren Feststellungen jeweils den geringeren Mindergehalt der beiden Be-probungen mittels HPLC/DAD zugrunde gelegt. Soweit die Prüfung einer Zubereitung einen ordnungsgemäßen Wirkstoffgehalt ergeben hat, hat die Kammer die entsprechende Tat der Anklage der Verurteilung nicht zugrunde gelegt (vgl. unten) )
1262Anklage |
LZG |
Patient |
Wirkstoff |
Ergeb- nis |
HPLC/DAD 1. Durchg. |
2. Durchg. |
ICP/OES + and. Verf. |


![]()
![]()
![]()
![]()

705
1265Ergänzend sei durch das Verfahren ICP/OES der Platingehalt, der keinen Schwankungen bei einem möglichen Abbau des Wirkstoffs unterliegt, bestimmt worden. Aus der Deklaration von 158 mg Oxaliplatin resultiere grundsätzlich ein Platinsollwert von 77,58 mg. Gemessen worden sei ein Wert von 46,61 mg Platin, dies entspreche einem Wirkstoffanteil von Oxaliplatin von 94,9 mg, mithin ergebe dies wiederum einen Wirk-stoffmindergehalt von 39,9 %. Zu berücksichtigen sei eine Messunsicherheit von 3 %.
1266Die Stabilität des Wirkstoffs sei gesichert gewesen. Die erste Untersuchung mittels HPLC/DAD habe noch innerhalb des durch die STABIL-LISTE® ausgewiesenen physikalisch-chemisch stabilen Zeitfensters von 28 Tagen nach Herstellung durchgeführt werden können. Auszugehen sei insoweit aufgrund der Kennziffer des Herstellungsprotokolls von „20161125159“ von einer Herstellung nicht vor dem 25.11.2016. Für beide Prüfungen mittels HPLC/DAD habe sich anhand der erstellten Stabilitätsver-gleichsmuster ergeben, dass die beiden Stabilitätsvergleichsproben in dem untersuchten Zeitraum zunächst einen nahezu unveränderten und dann nur einen leichten Abfall von 4 % bzw. 5 % Wirkstoffgehalt aufgewiesen hätten. Eine Abnahme des Wirkstoff-gehaltes auf die Größenordnung des Mindergehaltes der Probe sei hierbei nicht zu beobachten gewesen. Auch für die Beprobung mittels ICP/OES habe es erwartungsgemäß bei der Stabilitätsvergleichsprobe keinen Wirkstoffabbau gegeben.
1267![]() Tat 61.894 der Anklage:
Tat 61.894 der Anklage:
![]() Zum Infusionsbeutel des Patienten führte der Sachverständige L
Zum Infusionsbeutel des Patienten führte der Sachverständige L
dass sich aus der Deklaration auf dem Etikett eine Befüllung mit 166 mg des Wirkstoffs Oxaliplatin in einer 5 %-Glucose-Trägerlösung ergeben habe. Die Identität des Wirkstoffs Oxaliplatin habe sich bestätigt. Bei der ersten Prüfung mittels HPLC/DAD am 15.12.2016 habe sich ein Befund von 48,4 mg des Wirkstoffs Oxaliplatin, mithin ein Wirkstoffmindergehalt von 70,8 % bei einer Messunsicherheit von 4,2 % ergeben. Die zweite Prüfung mittels HPLC/DAD habe einen Befund von 47,3 mg und mithin einen Wirkstoffmindergehalt von 71,5 % bei einer Messunsicherheit von 3 % ergeben.
1270Ergänzend sei durch das Verfahren ICP/OES der Platingehalt bestimmt worden. Aus der Deklaration von 166 mg Oxaliplatin resultiere grundsätzlich ein Platinsollwert von 81,51 mg. Gemessen worden sei ein Wert von 24,05 mg Platin, dies entspreche einem
1271706
1272Wirkstoffanteil von Oxaliplatin von 49,0 mg, mithin ergebe dies wiederum einen Wirk-stoffmindergehalt von 70,5 %. Zu berücksichtigen sei eine Messunsicherheit von 4,0 %.
1273Die Stabilität des Wirkstoffs sei gesichert gewesen. Die erste Untersuchung mittels HPLC/DAD habe noch innerhalb des durch die STABIL-LISTE® ausgewiesenen physikalisch-chemisch stabilen Zeitfensters von 28 Tagen durchgeführt werden können. Auszugehen sei insoweit aufgrund der Kennziffer des Herstellungsprotokolls von „20161125158“ von einer Herstellung nicht vor dem 25.11.2016. Für beide Prüfungen mittels HPLC/DAD habe sich anhand der erstellten Stabilitätsvergleichsmuster ergeben, dass die beiden Stabilitätsvergleichsproben in dem untersuchten Zeitraum zunächst einen nahezu unveränderten und dann nur einen leichten Abfall von 4 % bzw. 5 % Wirkstoffgehalt aufgewiesen hätten. Eine Abnahme des Wirkstoffgehaltes auf die Größenordnung des Mindergehaltes der Probe sei hierbei nicht zu beobachten gewesen. Auch für die Beprobung mittels ICP/OES habe es erwartungsgemäß bei der Sta-bilitätsvergleichsprobe keinen Wirkstoffabbau gegeben.
1274Tat 61.895 der Anklage:
1275Zum Infusionsbeutel der Patientin führte der Sachverständige L aus, dass
1276sich aus der Deklaration auf dem Etikett eine Befüllung mit 71 mg des Wirkstoffs O-xaliplatin in einer 5 %-Glucose-Trägerlösung ergeben habe. Die Identität des Wirkstoffs Oxaliplatin habe sich bestätigt. Bei der ersten Prüfung mittels HPLC/DAD am 15.12.2016 habe sich ein Befund von 28,3 mg des Wirkstoffs Oxaliplatin, mithin ein Wirkstoffmindergehalt von 60,1 % bei einer Messunsicherheit von 5,7 % ergeben. Die zweite Prüfung mittels HPLC/DAD habe einen Befund von 27,8 mg und mithin einen Wirkstoffmindergehalt von 60,8 % bei einer Messunsicherheit von 3 % ergeben.
1277Ergänzend sei durch das Verfahren ICP/OES der Platingehalt bestimmt worden. Aus der Deklaration von 71 mg Oxaliplatin resultiere grundsätzlich ein Platinsollwert von 34,9 mg. Gemessen worden sei ein Wert von 14,8 mg Platin, dies entspreche einem Wirkstoffanteil von Oxaliplatin von 30,1 mg, mithin ergebe dies wiederum einen Wirk-stoffmindergehalt von 57,6 %. Zu berücksichtigen sei eine Messunsicherheit von 5 %.
1278707
1279Die Stabilität des Wirkstoffs sei gesichert gewesen. Die erste Untersuchung mittels HPLC/DAD habe noch innerhalb des durch die STABIL-LISTE® ausgewiesenen physikalisch-chemisch stabilen Zeitfensters von 28 Tagen durchgeführt werden können. Auszugehen sei insoweit aufgrund der Kennziffer des Herstellungsprotokolls von „20161125160“ von einer Herstellung nicht vor dem 25.11.2016. Für beide Prüfungen mittels HPLC/DAD habe sich anhand der erstellten Stabilitätsvergleichsmuster ergeben, dass die beiden Stabilitätsvergleichsproben in dem untersuchten Zeitraum zunächst einen nahezu unveränderten und dann nur einen leichten Abfall von 4 % bzw. 5 % Wirkstoffgehalt aufgewiesen hätten. Eine Abnahme des Wirkstoffgehaltes auf die Größenordnung des Mindergehaltes der Probe sei hierbei nicht zu beobachten gewesen. Auch für die Beprobung mittels ICP/OES habe es erwartungsgemäß bei der Sta-bilitätsvergleichsprobe keinen Wirkstoffabbau gegeben.
1280Tat 61.896 der Anklage:
1281Zum Infusionsbeutel des Patienten führte der Sachverständige L aus,
1282dass sich aus der Deklaration auf dem Etikett eine Befüllung mit 98 mg des Wirkstoffs Oxaliplatin in einer 5 %-Glucose-Trägerlösung ergeben habe. Die Identität des Wirkstoffs Oxaliplatin habe sich bestätigt. Bei der ersten Prüfung mittels HPLC/DAD am 15.12.2016 habe sich ein Befund von 17,9 mg des Wirkstoffs Oxaliplatin, mithin ein Wirkstoffmindergehalt von 81,7 % bei einer Messunsicherheit von 5,1 % ergeben. Die zweite Prüfung mittels HPLC/DAD habe einen Befund von 17,3 mg und mithin einen Wirkstoffmindergehalt von 82,3 % bei einer Messunsicherheit von 4,1 % ergeben.
1283Ergänzend sei durch das Verfahren ICP/OES der Platingehalt bestimmt worden. Aus der Deklaration von 98 mg Oxaliplatin resultiere grundsätzlich ein Platinsollwert von 48,1 mg. Gemessen worden sei ein Wert von 8,7 mg Platin, dies entspreche einem Wirkstoffanteil von Oxaliplatin von 17,7 mg, mithin ergebe dies wiederum einen Wirk-stoffmindergehalt von 82,0%. Zu berücksichtigen sei eine Messunsicherheit von 7 %.
1284Die Stabilität des Wirkstoffs sei gesichert gewesen. Die erste Untersuchung mittels HPLC/DAD habe noch innerhalb des durch die STABIL-LISTE® ausgewiesenen physikalisch-chemisch stabilen Zeitfensters von 28 Tagen durchgeführt werden können. Auszugehen sei insoweit aufgrund der Kennziffer des Herstellungsprotokolls von „20161125161“ von einer Herstellung nicht vor dem 25.11.2016. Für beide Prüfungen
1285708
1286mittels HPLC/DAD habe sich anhand der erstellten Stabilitätsvergleichsmuster ergeben, dass die beiden Stabilitätsvergleichsproben in dem untersuchten Zeitraum zunächst einen nahezu unveränderten und dann nur einen leichten Abfall von 4 % bzw. 5 % Wirkstoffgehalt aufgewiesen hätten. Eine Abnahme des Wirkstoffgehaltes auf die Größenordnung des Mindergehaltes der Probe sei hierbei nicht zu beobachten gewesen. Auch für die Beprobung mittels ICP/OES habe es erwartungsgemäß bei der Sta-bilitätsvergleichsprobe keinen Wirkstoffabbau gegeben.
1287Tat 61.897 der Anklage:
1288Zum Infusionsbeutel der Patientin führte der Sachverständige L aus,
1289dass sich aus der Deklaration auf dem Etikett eine Befüllung mit 300 mg des Wirkstoffs Carboplatin in einer 5 %-Glucose-Trägerlösung ergeben habe. Die Identität des Wirkstoffs Carboplatin habe sich bestätigt. Bei der ersten Prüfung mittels HPLC/DAD am 14.12.2016 habe sich ein Befund von 143,8 mg des Wirkstoffs Carboplatin, mithin ein Wirkstoffmindergehalt von 52,1 % bei einer Messunsicherheit von 3 % ergeben. Die zweite Prüfung mittels HPLC/DAD habe einen Befund von 141,4 mg und mithin einen Wirkstoffmindergehalt von 52,9 % bei einer Messunsicherheit von 3 % ergeben.
1290Ergänzend sei durch das Verfahren ICP/OES der Platingehalt bestimmt worden. Aus der Deklaration von 300 mg Carboplatin resultiere grundsätzlich ein Platinsollwert von 157,6 mg. Gemessen worden sei ein Wert von 76,2 mg Platin, dies entspreche einem Wirkstoffanteil von Carboplatin von 145,1 mg, mithin ergebe dies wiederum einen Wirkstoffmindergehalt von 52,9%. Zu berücksichtigen sei eine Messunsicherheit von 10 %.
1291Die Stabilität des Wirkstoffs sei gesichert gewesen. Die erste Untersuchung mittels HPLC/DAD habe noch innerhalb des durch die STABIL-LISTE® ausgewiesenen physikalisch-chemisch stabilen Zeitfensters von 28 Tagen durchgeführt werden können. Auszugehen sei insoweit aufgrund der Kennziffer des Herstellungsprotokolls von „20161125137“ von einer Herstellung nicht vor dem 25.11.2016. Für beide Prüfungen mittels HPLC/DAD habe sich anhand der erstellten Stabilitätsvergleichsmuster ergeben, dass die beiden Stabilitätsvergleichsproben in dem untersuchten Zeitraum einen nahezu unveränderten Wirkstoffgehalt aufgewiesen hätten. Eine Abnahme des Wirk-stoffgehaltes auf die Größenordnung des Mindergehaltes der Probe sei hierbei nicht
1292709
1293zu beobachten gewesen. Auch für die Beprobung mittels ICP/OES habe es erwartungsgemäß bei der Stabilitätsvergleichsprobe keinen Wirkstoffabbau gegeben.
1294Tat 61.898 der Anklage:
1295Zum Infusionsbeutel des Patienten führte der Sachverständige L aus, dass
1296sich aus der Deklaration auf dem Etikett eine Befüllung mit 160,00 mg des Wirkstoffs Irinotecan in einer 0,9 %-Glucose-Trägerlösung ergeben habe. Ausweislich des Herstellungsprotokolls handele es sich um 20 mg/ml Irinotecan-HCl x 3 H2O. Die im Herstellungsprotokoll dokumentierte Wirkstoff-Zugabe von 8,00 ml könne mithin lediglich einer Menge von 147,23 mg Irinotecan entsprechen. Die Identität des Wirkstoffs Irino-tecan habe sich bestätigt. Bei der ersten Prüfung mittels HPLC/DAD am 13.12.2016 habe sich ein Befund von 42,6 mg des Wirkstoffs Irinotecan, mithin ein Wirkstoffmin-dergehalt von 73,4 % bei einer Messunsicherheit von 5,6 % ergeben. Unter Zugrundelegung des aus dem Herstellungsprotokoll errechneten Wirkstoffgehalts als Irinote-can-HCl x 3 H2O ergebe sich ein Wirkstoffmindergehalt von 69,2 %. Die zweite Prüfung mittels HPLC/DAD habe einen Befund von 41,8 mg und mithin einen Wirkstoff-mindergehalt von 73,9 % bei einer Messunsicherheit von 6,8 % ergeben. Unter Zugrundelegung des aus dem Herstellungsprotokoll errechneten Wirkstoffgehalts als Iri-notecan-HCl x 3 H2O ergebe sich ein Wirkstoffmindergehalt von 69,8 %.
1297Die Stabilität des Wirkstoffs sei gesichert gewesen. Die erste Untersuchung mittels HPLC/DAD habe noch innerhalb des durch die STABIL-LISTE® ausgewiesenen physikalisch-chemisch stabilen Zeitfensters von 28 Tagen durchgeführt werden können. Auszugehen sei insoweit aufgrund der Kennziffer des Herstellungsprotokolls von „20161125156“ von einer Herstellung nicht vor dem 25.11.2016. Für beide Prüfungen mittels HPLC/DAD habe sich anhand der erstellten Stabilitätsvergleichsmuster ergeben, dass die beiden Stabilitätsvergleichsproben in dem untersuchten Zeitraum einen nahezu unveränderten Wirkstoffgehalt aufgewiesen hätten. Eine Abnahme des Wirk-stoffgehaltes auf die Größenordnung des Mindergehaltes der Probe sei hierbei nicht zu beobachten gewesen.
1298Tat 61.899 der Anklage:
1299710
1300Zum Infusionsbeutel der Patientin führte der Sachverständige IM aus,
1301dass sich aus der Deklaration auf dem Etikett eine Befüllung mit 4,00 mg des Wirkstoffs Zoledronsäure in einer 0,9 %-igen NaCI-Lösung ergeben habe. Ein Nachweis von Zoledronsäure sei in keinem von drei durchgeführten Durchgängen der Prüfung mittels HPLC/DAD möglich gewesen. Die Nachweisgrenze habe bei < 2 ppm gelegen.
1302Die Stabilität des Wirkstoffs sei gesichert gewesen. Auszugehen sei insoweit aufgrund der Kennziffer des Herstellungsprotokolls von „20161128035" von einer Herstellung nicht vor dem 28.11.2016. Für die Prüfungen mittels HPLC/DAD habe sich anhand der erstellten Stabilitätsvergleichsmuster ergeben, dass alle Stabilitätsvergleichsproben, insoweit mit unterschiedlichen Wirkstoffgehalten für die Proben mit dem Wirkstoff Zoledronsäure, in dem untersuchten Zeitraum zwischen dem ersten und dem 139. Tag einen nahezu unveränderten Wirkstoffgehalt, der sich im Rahmen von +/— 10 % bewegt habe, aufgewiesen hätten. Zugrunde zu legen sei für die Stabilitätsvergleichs-muster eine Messunsicherheit von 9 %. Eine Abnahme des Wirkstoffgehaltes, vorliegend ein vollständiger Wirkstoffabbau, sei hierbei nicht zu beobachten gewesen.
1303Tat 61.900 der Anklage:
1304Zum Infusionsbeutel der Patientin führte der Sachverständige IM aus, dass
1305sich aus der Deklaration auf dem Etikett eine Befüllung mit 4,00 mg des Wirkstoffs Zoledronsäure in einer 0,9 %-igen NaCI-Lösung ergeben habe. Ein Nachweis von Zoledronsäure sei in keinem von drei durchgeführten Durchgängen der Prüfung mittels HPLC/DAD möglich gewesen. Die Nachweisgrenze habe wiederum bei < 2 ppm gelegen.
1306Die Stabilität des Wirkstoffs sei gesichert gewesen. Auszugehen sei insoweit aufgrund der Kennziffer des Herstellungsprotokolls von „20161128036" von einer Herstellung nicht vor dem 28.11.2016. Auch insoweit sei — entsprechend der Ausführungen zu Tat 61.899 der Anklage — festzustellen, dass alle Stabilitätsvergleichsproben einen nahezu unveränderten Wirkstoffgehalt, der sich im Rahmen von +/— 10 % bewegt habe, aufgewiesen hätten. Eine Abnahme des Wirkstoffgehaltes, vorliegend ein vollständiger Wirkstoffabbau, sei nicht zu beobachten gewesen.
1307711
1308Tat 61.901 der Anklage:
1309Zum Infusionsbeutel des Patienten führte der Sachverständige L aus,
1310dass sich aus der Deklaration auf dem Etikett eine Befüllung mit 50,00 mg des Wirkstoffs Vinorelbin in einer 0,9 %-igen NaCl-Lösung ergeben habe. Ein Nachweis von Vinorelbin sei in keinem von drei durchgeführten Durchgängen der Prüfung mittels HPLC/DAD möglich gewesen. Die Nachweisgrenze habe bei < 4 ppm und im zweiten Durchgang bei < 3 ppm gelegen.
1311Die Stabilität des Wirkstoffs sei gesichert gewesen. Die erste Untersuchung mittels HPLC/DAD habe am 19.12.2016 innerhalb des durch die STABIL-LISTE® ausgewiesenen physikalisch-chemisch stabilen Zeitfensters von 28 Tagen durchgeführt werden können. Auszugehen sei insoweit aufgrund der Kennziffer des Herstellungsprotokolls von „20161128024“ von einer Herstellung nicht vor dem 28.11.2016. Für die Prüfungen mittels HPLC/DAD habe sich anhand der erstellten Stabilitätsvergleichsmuster ergeben, dass alle Stabilitätsvergleichsproben in dem untersuchten Zeitraum einen nahezu unveränderten Wirkstoffgehalt, der sich im Rahmen von +/– 10 % bewegt habe, aufgewiesen hätten. Zugrunde zu legen sei für die Stabilitätsvergleichsmuster eine Messunsicherheit von 9 %. Eine Abnahme des Wirkstoffgehaltes, vorliegend ein vollständiger Wirkstoffabbau, sei hierbei nicht zu beobachten gewesen.
1312Tat 61.902 der Anklage:
1313Zur Spritze der Patientin führte der Sachverständige L aus, dass sich
1314aus der Deklaration auf dem Etikett eine Befüllung mit 2,10 mg des Wirkstoffs Borte-zomib in einer 0,9 %-igen NaCl-Trägerlösung ergeben habe. Die Identität des Wirkstoffs Bortezomib habe sich bestätigt. Bei der ersten Prüfung mittels HPLC/DAD habe sich ein Befund von 0,29 mg des Wirkstoffs Bortezomib, mithin ein Wirkstoffminderge-halt von 86,0 % bei einer Messunsicherheit von 6,0 % ergeben. Die zweite Prüfung mittels HPLC/DAD habe einen Befund von 0,32 mg und mithin einen Wirkstoffminder-gehalt von 84,9 % bei einer Messunsicherheit von 5,0 % ergeben.
1315Die Stabilität des Wirkstoffs sei gesichert gewesen. Die erste Untersuchung mittels HPLC/DAD am 13.01.2017 habe zwar erst nach 49 Tagen und somit nicht innerhalb
1316712
1317des durch die STABIL-LISTE® ausgewiesenen physikalisch-chemisch stabilen Zeitfensters von 28 Tagen durchgeführt werden können. Auszugehen sei insoweit aufgrund der Kennziffer des Herstellungsprotokolls von „20161125134“ von einer Herstellung nicht vor dem 25.11.2016. Für beide Prüfungen mittels HPLC/DAD habe sich anhand des erstellten Stabilitätsvergleichsmusters ergeben, dass die Stabilitätsver-gleichsprobe in dem untersuchten Zeitraum einen nahezu unveränderten Wirkstoffge-halt aufgewiesen hätte. Bei dem Stabilitätsvergleichsmuster sei zum zweiten Untersuchungszeitpunkt ein etwas höherer Wirkstoffgehalt bestimmt worden als zum ersten Zeitpunkt, dies erkläre sich mit dem Spezifikationsbereich von +/- 10 %. Eine Abnahme des Wirkstoffgehaltes auf die Größenordnung des Mindergehaltes der Probe sei hierbei nicht zu beobachten gewesen. Unschädlich sei es zudem, dass die Lagerung der Probe bis zum Untersuchungszeitpunkt in der Spritze erfolgt sei, während das Stabili-tätsvergleichsmuster in dem Originalgefäß des Fertigarzneimittels, in dem die Zubereitung stattgefunden hatte, aufbewahrt worden sei. Dies habe keine Auswirkungen auf den Wirkstoffgehalt.
1318Tat 61.903 der Anklage:
1319Zur Spritze der Patientin führte der Sachverständige L aus, dass sich
1320aus der Deklaration auf dem Etikett eine Befüllung mit 2,00 mg des Wirkstoffs Borte-zomib in einer 0,9 %-igen NaCl-Trägerlösung ergeben habe. Die Identität des Wirkstoffs Bortezomib habe sich bestätigt. Bei der ersten Prüfung mittels HPLC/DAD habe sich ein Befund von 1,29 mg des Wirkstoffs Bortezomib, mithin ein Wirkstoffminderge-halt von 35,5 % bei einer Messunsicherheit von 6,0 % ergeben. Die zweite Prüfung mittels HPLC/DAD habe einen Befund von 1,38 mg und mithin einen Wirkstoffminder-gehalt von 31,1 % bei einer Messunsicherheit von 6,0 % ergeben.
1321Die Stabilität des Wirkstoffs sei gesichert gewesen. Die erste Untersuchung mittels HPLC/DAD am 13.01.2017 habe zwar erst nach 49 Tagen und somit nicht innerhalb des durch die STABIL-LISTE® ausgewiesenen physikalisch-chemisch stabilen Zeitfensters von 28 Tagen durchgeführt werden können. Auszugehen sei insoweit aufgrund der Kennziffer des Herstellungsprotokolls von „20161125135“ von einer Herstellung nicht vor dem 25.11.2016. Für beide Prüfungen mittels HPLC/DAD habe sich –
1322713
1323wie zu Tat 61.902 der Anklage ausgeführt – anhand des erstellten Stabilitätsver-gleichsmusters ergeben, dass die Stabilitätsvergleichsprobe in dem untersuchten Zeitraum einen nahezu unveränderten Wirkstoffgehalt aufgewiesen habe. Eine Abnahme des Wirkstoffgehaltes auf die Größenordnung des Mindergehaltes der Probe sei nicht zu beobachten gewesen.
1324Tat 61.904 der Anklage:
1325Zum Infusionsbeutel der Patientin führte der Sachverständige L aus,
1326dass sich aus der Deklaration auf dem Etikett eine Befüllung mit 1.020 mg Cyclophos-phamid in einer 0,9 %-igen NaCl-Trägerlösung ergeben habe. Die Identität des Wirkstoffs Cyclophosphamid habe sich bestätigt. Bei der ersten Prüfung mittels HPLC/DAD habe sich ein Befund von 593,7 mg des Wirkstoffs Cyclophosphamid, mithin ein Wirk-stoffmindergehalt von 41,8 % bei einer Messunsicherheit von 3,0 % ergeben. Die zweite Prüfung mittels HPLC/DAD habe einen Befund von 577,4 mg und mithin einen Wirkstoffmindergehalt von 43,4 % bei einer Messunsicherheit von 3,0 % ergeben.
1327Die Stabilität des Wirkstoffs sei gesichert gewesen. Die erste Untersuchung mittels HPLC/DAD habe am 13.12.2016 innerhalb des durch die STABIL-LISTE® ausgewiesenen physikalisch-chemisch stabilen Zeitfensters von 28 Tagen durchgeführt werden können. Auszugehen sei insoweit aufgrund der Kennziffer des Herstellungsprotokolls von „20161125139“ von einer Herstellung nicht vor dem 25.11.2016. Für die Prüfungen mittels HPLC/DAD habe sich anhand der erstellten Stabilitätsvergleichsmuster ergeben, dass alle Stabilitätsvergleichsproben in dem untersuchten Zeitraum einen nahezu unveränderten Wirkstoffgehalt aufgewiesen hätten. Eine Abnahme des Wirkstoffgehal-tes auf die Größenordnung des Mindergehaltes der Probe sei hierbei nicht zu beobachten gewesen.
1328Tat 61.905 der Anklage:
1329Zum weiteren Infusionsbeutel der Patientin führte der Sachverständige L aus, dass sich aus der Deklaration auf dem Etikett eine Befüllung mit Epirubicin in Trägerlösung von 5 %-Glucosteril ergeben habe. Aus dem Herstellungsprotokoll habe sich ergeben, dass insoweit das Fertigarzneimittel 2mg/ml Epirubicin-HCl verwendet
1330714
1331worden sei. Die insoweit angegebene Wirkstoffzugabe laut Deklaration beziehe sich auf die Zugabe von 153,00 mg Epirubicin-HCl. Die Identität des Wirkstoffs Epirubicin habe sich bestätigt. Bei der ersten Prüfung mittels HPLC/DAD habe sich ein Befund von 92,4 mg des Wirkstoffs Epirubicin, mithin ein Wirkstoffmindergehalt von 39,6 % bei einer Messunsicherheit von 3,4 % ergeben. Ausgehend von dem laut Herstellungsprotokoll beigefügten Gehalt von Epirubicin-HCl liege ein Mindergehalt von 35,5 % vor. Die zweite Prüfung mittels HPLC/DAD habe einen Befund von 94,0 mg und mithin einen Wirkstoffmindergehalt von 38,6 % bei einer Messunsicherheit von 3,0 % ergeben. Ausgehend von dem laut Herstellungsprotokoll beigefügten Gehalt von Epirubicin-HCl liege ein Mindergehalt von 34,4 % vor.
1332Die Stabilität des Wirkstoffs sei gesichert gewesen. Die erste Untersuchung mittels HPLC/DAD habe am 22.12.2016 innerhalb des durch die STABIL-LISTE® ausgewiesenen physikalisch-chemisch stabilen Zeitfensters von 28 Tagen durchgeführt werden können. Auszugehen sei insoweit aufgrund der Kennziffer des Herstellungsprotokolls von „20161125142“ von einer Herstellung nicht vor dem 25.11.2016. Für die Prüfungen mittels HPLC/DAD habe sich anhand der erstellten Stabilitätsvergleichsmuster ergeben, dass alle Stabilitätsvergleichsproben in dem untersuchten Zeitraum einen nahezu unveränderten Wirkstoffgehalt aufgewiesen hätten. Eine Abnahme des Wirkstoffgehal-tes auf die Größenordnung des Mindergehaltes der Probe sei nicht zu beobachten gewesen.
1333Tat 61.906 der Anklage
1334Zum Infusionsbeutel des Patienten führte der Sachverständige L aus,
1335dass sich aus der Deklaration auf dem Etikett eine Befüllung mit 2,20 mg Topotecan in 0,9 %-iger NaCl-Trägerlösung ergeben habe. Ein Nachweis von Topotecan sei in keinem der beiden durchgeführten Durchgänge der Prüfung mittels HPLC/DAD möglich gewesen. Die Nachweisgrenze habe in beiden Durchgängen bei < 1 ppm gelegen.
1336Die Stabilität des Wirkstoffs sei gesichert gewesen. Die erste Untersuchung mittels HPLC/DAD habe am 23.12.2016 innerhalb des durch die STABIL-LISTE® ausgewiesenen physikalisch-chemisch stabilen Zeitfensters von 28 Tagen durchgeführt werden können. Auszugehen sei insoweit aufgrund der Kennziffer des Herstellungsprotokolls von „20161128046“ von einer Herstellung nicht vor dem 28.11.2016. Für die Prüfungen
1337715
1338mittels HPLC/DAD habe sich anhand der erstellten Stabilitätsvergleichsmuster ergeben, dass alle Stabilitätsvergleichsproben in dem untersuchten Zeitraum einen nahezu unveränderten Wirkstoffgehalt aufgewiesen hätten. Eine Abnahme des Wirkstoffgehal-tes, vorliegend ein vollständiger Wirkstoffabbau, sei nicht zu beobachten gewesen.
1339Tat 61.907 der Anklage:
1340Zum Infusionsbeutel des Patienten führte der Sachverständige L aus, dass
1341sich aus der Deklaration auf dem Etikett eine Befüllung mit 115,00 mg des Wirkstoffs Carfilzomib in einer 5 %-Glucose-Trägerlösung ergeben habe. Die Identität des Wirkstoffs Carfilzomib habe sich bestätigt. Bei der ersten Prüfung mittels HPLC/DAD habe sich ein Befund von 24,41 mg des Wirkstoffs Carfilzomib, mithin ein Wirkstoffminder-gehalt von 79,0 % bei einer Messunsicherheit von 3,0 % ergeben. Die zweite Prüfung mittels HPLC/DAD habe einen Befund von 23,2 mg und mithin einen Wirkstoffminder-gehalt von 79,8 % bei einer Messunsicherheit von 3,0 % ergeben.
1342Die Stabilität des Wirkstoffs sei gesichert gewesen. Die erste Untersuchung mittels HPLC/DAD am 12.01.2017 habe zwar erst nach 45 Tagen und somit nicht innerhalb des durch die STABIL-LISTE® ausgewiesenen physikalisch-chemisch stabilen Zeitfensters von 24 Stunden durchgeführt werden können. Auszugehen sei insoweit aufgrund der Kennziffer des Herstellungsprotokolls von „20161128037“ von einer Herstellung nicht vor dem 28.11.2016. Die Lagerung der Probe sei aber durchweg temperaturkontrolliert und lichtgeschützt erfolgt. Für die Prüfung mittels HPLC/DAD habe sich anhand des erstellten Stabilitätsvergleichsmusters ergeben, dass die Stabilitätsver-gleichsprobe nach dem untersuchten Zeitraum von 45 Tagen einen nahezu unveränderten Wirkstoffgehalt aufgewiesen habe. Eine Abnahme des Wirkstoffgehaltes auf die Größenordnung des Mindergehaltes der Probe sei nicht zu beobachten gewesen.
1343Tat 61.908 der Anklage
1344Zum Infusionsbeutel der Patientin führte der Sachverständige L aus,
1345dass sich aus der Deklaration auf dem Etikett eine Befüllung mit 45,00 mg des Wirkstoffs Carfilzomib in einer 5 %-Glucose-Trägerlösung ergeben habe. Die Identität des Wirkstoffs Carfilzomib habe sich bestätigt. Bei der ersten Prüfung mittels HPLC/DAD
1346716
1347habe sich ein Befund von 29,5 mg des Wirkstoffs Carfilzomib, mithin ein Wirkstoffmin-dergehalt von 34,4 % bei einer Messunsicherheit von 3,0 % ergeben. Die zweite Prüfung mittels HPLC/DAD habe einen Befund von 29,1 mg und mithin einen Wirkstoff-mindergehalt von 36,4 % bei einer Messunsicherheit von 3,0 % ergeben.
1348Die Stabilität des Wirkstoffs sei gesichert gewesen. Die erste Untersuchung mittels HPLC/DAD am 12.01.2017 habe wie bei der vorgenannten Probe zur Tat 61.907 der Anklage erst nach 45 Tagen und somit nicht innerhalb des durch die STABIL-LISTE® ausgewiesenen physikalisch-chemisch stabilen Zeitfensters von 24 Stunden durchgeführt werden können. Auszugehen sei insoweit aufgrund der Kennziffer des Herstellungsprotokolls von „20161128038“ von einer Herstellung nicht vor dem 28.11.2016. Die Lagerung der Probe sei auch hier durchweg temperaturkontrolliert und lichtgeschützt erfolgt. Für die Prüfung mittels HPLC/DAD habe sich anhand des erstellten Stabilitätsvergleichsmusters ergeben, dass die Stabilitätsvergleichsprobe nach dem untersuchten Zeitraum von 45 Tagen einen nahezu unveränderten Wirkstoffgehalt aufgewiesen habe. Eine Abnahme des Wirkstoffgehaltes auf die Größenordnung des Mindergehaltes der Probe sei nicht zu beobachten gewesen.
1349Tat 61.909 der Anklage:
1350Zum Infusionsbeutel der Patientin führte der Sachverständige L aus,
1351dass sich aus der Deklaration auf dem Etikett eine Befüllung mit 10,00 mg des Wirkstoffs Vinblastinsulfat in einer 0,9 %-igen NaCl-Lösung ergeben habe. Ein Nachweis von Vinblastinsulfat sei in keinem der durchgeführten Durchgänge der Prüfung mittels HPLC/DAD möglich gewesen. Die Nachweisgrenze habe dabei bei < 1 ppm gelegen.
1352Die Stabilität des Wirkstoffs sei gesichert gewesen. Auszugehen sei insoweit aufgrund der Kennziffer des Herstellungsprotokolls von „20161123101“ von einer Herstellung nicht vor dem 23.11.2016. Für die Prüfungen mittels HPLC/DAD habe sich anhand der erstellten Stabilitätsvergleichsmuster ergeben, dass beide Stabilitätsvergleichsproben in dem untersuchten Zeitraum zwischen dem ersten und dem 29. Tag einen nahezu unveränderten Wirkstoffgehalt aufgewiesen hätten. Eine Abnahme des Wirkstoffgehal-tes, vorliegend ein vollständiger Wirkstoffabbau, sei hierbei nicht zu beobachten gewesen. Dabei sei auch unschädlich, dass die erste Untersuchung erst am 42. Tag nach der Sicherstellung habe erfolgen können. Dass ein Wirkstoff sich über 29 Tage nicht
1353717
1354abbaue und dass dann zwischen dem 30. Tag und dem 42. Tag ein vollständiger Wirk-stoffabbau stattfinde, sei auszuschließen.
1355Tat 61.910 der Anklage:
1356Zum Infusionsbeutel der Patientin führte der Sachverständige L aus,
1357dass sich aus der Deklaration auf dem Etikett eine Befüllung mit 4,00 mg des Wirkstoffs Zoledronsäure in einer 0,9 %-igen NaCl-Lösung ergeben habe. Ein Nachweis von Zoledronsäure sei in keinem der durchgeführten Durchgänge der Prüfung mittels HPLC/DAD möglich gewesen. Die Nachweisgrenze habe wiederum bei < 2 ppm gelegen.
1358Die Stabilität des Wirkstoffs sei gesichert gewesen. Auszugehen sei insoweit aufgrund der Kennziffer des Herstellungsprotokolls von „20161125182“ von einer Herstellung nicht vor dem 25.11.2016. Für die Prüfungen mittels HPLC/DAD habe sich anhand der erstellten Stabilitätsvergleichsmuster ergeben, dass alle Stabilitätsvergleichsproben, insoweit mit unterschiedlichen Wirkstoffgehalten für die Proben mit dem Wirkstoff Zoledronsäure, in dem untersuchten Zeitraum zwischen dem ersten und dem 139. Tag einen nahezu unveränderten Wirkstoffgehalt, der sich im Rahmen von +/– 10 % bewegt habe, aufgewiesen hätten. Zugrunde zu legen sei für die Stabilitätsvergleichs-muster eine Messunsicherheit von 9 %. Eine Abnahme des Wirkstoffgehaltes, vorliegend ein vollständiger Wirkstoffabbau, sei hierbei nicht zu beobachten gewesen.
1359Tat 61.911 der Anklage:
1360Zum Infusionsbeutel der Patientin führte der Sachverständige L aus,
1361dass sich aus der Deklaration auf dem Etikett eine Befüllung mit 20,00 mg des Wirkstoffs Dexamethason in einer 0,9 %-igen NaCl--Trägerlösung ergeben habe. Aus der Therapieinformation aus dem Programm Zenzy habe sich ergeben, dass insoweit das Fertigarzneimittel Dexahexal verwendet worden sei. Dabei handele es sich um den Wirkstoff Dexamethason-21-(dihydrogen)phosphat in einer Konzentration von 4 mg/ml. Dabei handele es sich nicht um den deklarierten Wirkstoff Dexamethason. Unter Zugrundelegung der Therapieinformation sei eine Wirkstoffmenge von 20,00 mg Dexamethason-21-(dihydrogen)phosphat zu erwarten gewesen. Die Identität des
1362718
1363Wirkstoffs Dexamethason-21-(dihydrogen)phosphat habe sich bestätigt, der deklarierte Wirkstoff Dexamethason sei hingegen nicht festzustellen gewesen. Bei der ersten Prüfung mittels HPLC/DAD habe sich ein Befund von 4,08 mg des Wirkstoffs Dexa-methason-21-(dihydrogen)phosphat, mithin ein Wirkstoffmindergehalt von 79,6 % bei einer Messunsicherheit von 3,8 % ergeben. Die zweite Prüfung mittels HPLC/DAD habe einen Befund von 1,51 mg von Dexamethason-21-(dihydrogen)phosphat und als Abbauprodukt 2,11 mg Dexamethason (umgerechnet 2,54 mg Dexamethason-21-(dihydrogen)phosphat), insgesamt somit 4,05 mg und mithin einen Wirkstoffminderge-halt von 79,8 % bei einer Messunsicherheit von 3,9 % ergeben.
1364Die Stabilität des Wirkstoffs sei gesichert gewesen. Auszugehen sei insoweit aufgrund der Kennziffer des Herstellungsprotokolls von „20161125115“ von einer Herstellung nicht vor dem 25.11.2016. Die Beprobung sei am 06.01.2017 nach 39 Tagen erfolgt. Für die Prüfungen mittels HPLC/DAD habe sich anhand der erstellten Stabilitätsver-gleichsmuster ergeben, dass alle Stabilitätsvergleichsproben in dem untersuchten Zeitraum von 39 Tagen einen nahezu unveränderten Wirkstoffgehalt aufgewiesen hätten. Eine Abnahme des Wirkstoffgehaltes sei hierbei nicht zu beobachten gewesen.
1365Tat 61.912 der Anklage:
1366Hinsichtlich des weiteren Infusionsbeutels der Patientin führte der Sachver-
1367ständige L aus, dass sich aus der Deklaration auf dem Etikett eine Befüllung mit
1368142,00 mg des Wirkstoffs Doxetacel in einer 0,9 %-igen NaCl-Trägerlösung ergeben habe. Die Identität des Wirkstoffs Doxetacel habe sich bestätigt. Bei der ersten Prüfung mittels HPLC/DAD habe sich ein Befund von 69,3 mg des Wirkstoffs Doxetacel, mithin ein Wirkstoffmindergehalt von 51,2 % bei einer Messunsicherheit von 3,0 % ergeben. Die zweite Prüfung mittels HPLC/DAD habe einen Befund von 68,0 mg und mithin einen Wirkstoffmindergehalt von 52,1 % bei einer Messunsicherheit von 3,0 % ergeben.
1369Die Stabilität des Wirkstoffs sei gesichert gewesen. Die erste Untersuchung mittels HPLC/DAD am 27.12.2016 habe nur kurz nach Ablauf des durch die STABIL-LISTE® ausgewiesenen physikalisch-chemisch stabilen Zeitfensters von 28 Tagen durchgeführt werden können. Auszugehen sei insoweit aufgrund der Kennziffer des Herstellungsprotokolls von „20161125141“ von einer Herstellung nicht vor dem 25.11.2016. Die Lagerung der Probe sei durchweg temperaturkontrolliert und lichtgeschützt erfolgt.
1370719
1371Für die Prüfung mittels HPLC/DAD habe sich anhand des erstellten Stabilitätsver-gleichsmusters ergeben, dass die Stabilitätsvergleichsprobe nach 14 Tagen einen nahezu unveränderten Wirkstoffgehalt aufgewiesen habe. Zum zweiten Untersuchungszeitpunkt nach 42 Tagen seien deutliche Ausflockungen (Kristalle) erkennbar gewesen, insoweit hätten sich auch Mindergehalte ergeben von 14,5 % und 25,6 %. Bei der Probe aus dem Labor des Angeklagten, die deutlich vor dem Ablauf von 42 Tagen untersucht worden sei, sei eine solche Ausflockung gerade nicht festzustellen gewesen, dies auch nicht nach dem Ablauf von 45 Tagen. Zudem spreche auch der geprüfte nahezu unveränderte Mindergehalt von 51,2 % und 52,1 % für die Stabilität. Eine Abnahme des Wirkstoffgehaltes auf die Größenordnung des Mindergehaltes der Probe sei nicht durch eine Ausflockung oder Abnahme der Stabilität zu erklären.
1372Tat 61.913 der Anklage:
1373Zum weiteren Infusionsbeutel der Patientin führte der Sachverständige L
1374aus, dass sich aus der Deklaration auf dem Etikett eine Befüllung mit 136,00 mg des Wirkstoffs Paclitaxel in einer 0,9 %-igen NaCl-Trägerlösung ergeben habe. Die Identität des Wirkstoffs Paclitaxel habe sich bestätigt. Bei der ersten Prüfung mittels HPLC/DAD habe sich ein Befund von 96,5 mg des Wirkstoffs Paclitaxel, mithin ein Wirkstoffmindergehalt von 29,0 % bei einer Messunsicherheit von 3,0 % ergeben. Die zweite Prüfung mittels HPLC/DAD habe einen Befund von 94,6 mg und mithin einen Wirkstoffmindergehalt von 30,4 % bei einer Messunsicherheit von 3,0 % ergeben.
1375Die Stabilität des Wirkstoffs sei gesichert gewesen. Die erste Untersuchung mittels HPLC/DAD am 08.12.2016 habe noch innerhalb des durch die STABIL-LISTE® ausgewiesenen physikalisch-chemisch stabilen Zeitfensters von 14 Tagen durchgeführt werden können. Auszugehen sei insoweit aufgrund der Kennziffer des Herstellungsprotokolls von „20161125166“ von einer Herstellung nicht vor dem 25.11.2016. Die Lagerung der Probe sei durchweg temperaturkontrolliert und lichtgeschützt erfolgt. Für die Prüfung mittels HPLC/DAD habe sich anhand des erstellten Stabilitätsvergleichs-musters ergeben, dass die Stabilitätsvergleichsproben nach 15 Tagen einen nahezu unveränderten Wirkstoffgehalt aufgewiesen hätten. Eine Abnahme des Wirkstoffgehal-tes auf die Größenordnung des Mindergehaltes der Probe sei nicht festzustellen gewesen.
1376![]() Tat 61.914 der Anklage:
Tat 61.914 der Anklage:
Zum Infusionsbeutel der Patientin führte der Sachverständige IM aus, dass
1378sich aus der Deklaration auf dem Etikett eine Befüllung mit 141,00 mg des Wirkstoffs Paclitaxel in einer 0,9 %-igen NaCI-Trägerlösung ergeben habe. Die Identität des Wirkstoffs Paclitaxel habe sich bestätigt. Bei der ersten Prüfung mittels HPLC/DAD habe sich ein Befund von 92,8 mg des Wirkstoffs Paclitaxel, mithin ein Wirkstoffminderge-halt von 34,2 % bei einer Messunsicherheit von 3,2 % ergeben. Die zweite Prüfung mittels HPLC/DAD habe einen Befund von 93,2 mg und mithin einen Wirkstoffminder-gehalt von 33,9 % bei einer Messunsicherheit von 3,0 % ergeben.
1379Die Stabilität des Wirkstoffs sei gesichert gewesen. Die erste Untersuchung mittels HPLC/DAD am 08.12.2016 habe noch innerhalb des durch die STABIL-LISTE® ausgewiesenen physikalisch-chemisch stabilen Zeitfensters von 14 Tagen durchgeführt werden können. Auszugehen sei insoweit aufgrund der Kennziffer des Herstellungsprotokolls von „20161125165" von einer Herstellung nicht vor dem 25.11.2016. Die Lagerung der Probe sei durchweg temperaturkontrolliert und lichtgeschützt erfolgt. Für die Prüfung mittels HPLC/DAD habe sich anhand des erstellten Stabilitätsvergleichs-musters ergeben, dass die Stabilitätsvergleichsproben nach 15 Tagen einen nahezu unveränderten Wirkstoffgehalt aufgewiesen haben. Eine Abnahme des Wirkstoffgehal-tes auf die Größenordnung des Mindergehaltes der Probe sei nicht festzustellen.
1380Tat 61.915 der Anklage:
1381Zum Infusionsbeutel der Patientin führte der Sachverständige LM aus,
1382dass sich aus der Deklaration auf dem Etikett eine Befüllung mit 20,00 mg des Wirkstoffs Dexamethason in einer 0,9 %-igen NaCI--Trägerlösung ergeben habe. Aus der Therapieinformation aus dem Programm Zenzy habe sich wiederum wie auch bei der Probe 77a (Tat 61.911) ergeben, dass insoweit das Fertigarzneimittel Dexahexal verwendet worden sei mit dem Wirkstoff Dexamethason-21-(dihydrogen)phosphat in einer Konzentration von 4 mg/ml. Auch insoweit sei unter Zugrundelegung der Therapieinformation eine Wirkstoffmenge von 20,00 mg Dexamethason-21-(dihydro-gen)phosphat zu erwarten gewesen. Die Identität des Wirkstoffs Dexamethason-21-
1383721
1384(dihydrogen)phosphat habe sich bestätigt, der deklarierte Wirkstoff Dexamethason sei hingegen zunächst nicht festzustellen gewesen. Bei der ersten Prüfung mittels HPLC/DAD habe sich ein Befund von 4,59 mg des Wirkstoffs Dexamethason-21-(dihydrogen)phosphat, mithin ein Wirkstoffmindergehalt von 77,0 % bei einer Messunsicherheit von 3,8 % ergeben. Die zweite Prüfung mittels HPLC/DAD habe einen Befund von 2,22 mg von Dexamethason-21-(dihydrogen)phosphat und als Abbauprodukt 2,00 mg Dexamethason (umgerechnet 2,41 mg Dexamethason-21-(dihydrogen)phos-phat), insgesamt somit 4,63 mg und mithin einen Wirkstoffmindergehalt von 76,9 % bei einer Messunsicherheit von 3,8 % ergeben.
1385Die Stabilität des Wirkstoffs sei gesichert gewesen. Auszugehen sei insoweit aufgrund der Kennziffer des Herstellungsprotokolls von „20161125117“ von einer Herstellung nicht vor dem 25.11.2016. Die Beprobung sei am 06.01.2017 wie auch bei der Probe 77a (Tat 61.911) nach 39 Tagen erfolgt. Für die Prüfungen mittels HPLC/DAD habe sich anhand der erstellten Stabilitätsvergleichsmuster ergeben, dass alle Stabilitäts-vergleichsproben in dem untersuchten Zeitraum von 39 Tagen einen nahezu unveränderten Wirkstoffgehalt aufgewiesen hätten. Eine Abnahme des Wirkstoffgehaltes sei hierbei nicht zu beobachten gewesen.
1386Tat 61.916 der Anklage:
1387Zum Infusionsbeutel der Patientin führte der Sachverständige L aus, dass
1388sich aus der Deklaration auf dem Etikett eine Befüllung mit 130,00 mg des Wirkstoffs Paclitaxel in einer 0,9 %-igen NaCl-Trägerlösung ergeben habe. Die Identität des Wirkstoffs Paclitaxel habe sich bestätigt. Bei der ersten Prüfung mittels HPLC/DAD habe sich ein Befund von 88,0 mg des Wirkstoffs Paclitaxel, mithin ein Wirkstoffminderge-halt von 32,3 % bei einer Messunsicherheit von 3,0 % ergeben. Die zweite Prüfung mittels HPLC/DAD habe einen Befund von 89,5 mg und mithin einen Wirkstoffminder-gehalt von 31,1 % bei einer Messunsicherheit von 3,2 % ergeben.
1389Die Stabilität des Wirkstoffs sei gesichert gewesen. Die erste Untersuchung mittels HPLC/DAD am 08.12.2016 habe noch innerhalb des durch die STABIL-LISTE® ausgewiesenen physikalisch-chemisch stabilen Zeitfensters von 14 Tagen durchgeführt werden können. Auszugehen sei insoweit aufgrund der Kennziffer des Herstellungsprotokolls von „20161125163“ von einer Herstellung nicht vor dem 25.11.2016. Die
1390722
1391Lagerung der Probe sei durchweg temperaturkontrolliert und lichtgeschützt erfolgt. Für die Prüfung mittels HPLC/DAD habe sich anhand des erstellten Stabilitätsvergleichs-musters zudem ergeben, dass die Stabilitätsvergleichsproben auch nach 15 Tagen einen nahezu unveränderten Wirkstoffgehalt aufgewiesen haben. Eine Abnahme des Wirkstoffgehaltes auf die Größenordnung des Mindergehaltes der Probe sei nicht festzustellen.
1392Tat 61.917 der Anklage:
1393Zum weiteren Infusionsbeutel des Patienten führte der Sachverständige L
1394aus, dass sich aus der Deklaration auf dem Etikett eine Befüllung mit 390,00 mg des Wirkstoffs Folinsäure in einer 0,9 %-igen NaCl-Trägerlösung ergeben habe. Die Identität des Wirkstoffs Folinsäure habe sich bestätigt. Bei der ersten Prüfung mittels HPLC/DAD habe sich ein Befund von 85,6 mg des Wirkstoffs Folinsäure, mithin ein Wirkstoffmindergehalt von 78,1 % bei einer Messunsicherheit von 3,0 % ergeben. Die zweite Prüfung mittels HPLC/DAD habe einen Befund von 84,0 mg und mithin einen Wirkstoffmindergehalt von 78,5 % bei einer Messunsicherheit von 3,0 % ergeben.
1395Die Stabilität des Wirkstoffs sei gesichert gewesen. Die erste Untersuchung mittels HPLC/DAD am 08.12.2016 habe noch innerhalb des durch die STABIL-LISTE® ausgewiesenen physikalisch-chemisch stabilen Zeitfensters von 28 Tagen durchgeführt werden können. Auszugehen sei insoweit aufgrund der Kennziffer des Herstellungsprotokolls von „20161125128“ von einer Herstellung nicht vor dem 25.11.2016. Die Lagerung der Probe sei durchweg temperaturkontrolliert und lichtgeschützt erfolgt. Für die Prüfung mittels HPLC/DAD habe sich anhand von vier erstellten Stabilitätsver-gleichsmustern mit dem Wirkstoff Folinsäure (mit den jeweils höchsten und niedrigsten deklarierten Wirkstoffinhalten sowie gelagert bei Raum- und Kühltemperatur) ergeben, dass die Stabilitätsvergleichsproben nach 13 Tagen alle einen nahezu unveränderten Wirkstoffgehalt aufgewiesen haben. Eine Abnahme des Wirkstoffgehaltes auf die Größenordnung des Mindergehaltes der Probe sei nicht festzustellen. Ein solcher könne sich auch nicht durch eine andere Lagerung (Raum- statt Kühltemperatur oder andersherum) erklären.
1396723
1397Tat 61.918 der Anklage:
1398Zum Infusionsbeutel der Patientin führte der Sachverständige L aus,
1399dass sich aus der Deklaration auf dem Etikett eine Befüllung mit 400,00 mg des Wirkstoffs Folinsäure in einer 0,9 %-igen NaCl-Trägerlösung ergeben habe. Die Identität des Wirkstoffs Folinsäure habe sich bestätigt. Bei der ersten Prüfung mittels HPLC/DAD habe sich ein Befund von 144,9 mg des Wirkstoffs Folinsäure, mithin ein Wirkstoffmindergehalt von 63,8 % bei einer Messunsicherheit von 3,0 % ergeben. Die zweite Prüfung mittels HPLC/DAD habe einen Befund von 142,0 mg und mithin einen Wirkstoffmindergehalt von 64,5 % bei einer Messunsicherheit von 3,0 % ergeben.
1400Die Stabilität des Wirkstoffs sei gesichert gewesen. Die erste Untersuchung mittels HPLC/DAD am 08.12.2016 habe noch innerhalb des durch die STABIL-LISTE® ausgewiesenen physikalisch-chemisch stabilen Zeitfensters von 28 Tagen durchgeführt werden können. Auszugehen sei insoweit aufgrund der Kennziffer des Herstellungsprotokolls von „20161125126“ von einer Herstellung nicht vor dem 25.11.2016. Die Lagerung der Probe sei durchweg temperaturkontrolliert und lichtgeschützt erfolgt. Für die Prüfung mittels HPLC/DAD habe sich anhand von vier erstellten Stabilitätsver-gleichsmustern mit dem Wirkstoff Folinsäure (mit den jeweils höchsten und niedrigsten deklarierten Wirkstoffinhalten sowie gelagert bei Raum- und Kühltemperatur) ergeben, dass die Stabilitätsvergleichsproben nach 13 Tagen alle einen nahezu unveränderten Wirkstoffgehalt aufgewiesen haben. Eine Abnahme des Wirkstoffgehaltes auf die Größenordnung des Mindergehaltes der Probe sei nicht festzustellen. Ein solcher könne sich auch nicht durch eine andere Lagerung (Raum- statt Kühltemperatur oder andersherum) erklären.
1401Tat 61.919 der Anklage:
1402Zum weiteren Infusionsbeutel der Patientin führte der Sachverständige L
1403aus, dass sich aus der Deklaration auf dem Etikett eine Befüllung mit 710,00 mg des Wirkstoffs Folinsäure in einer 0,9 %-igen NaCl-Trägerlösung ergeben habe. Die Identität des Wirkstoffs Folinsäure habe sich bestätigt. Bei der ersten Prüfung mittels HPLC/DAD habe sich ein Befund von 483,0 mg des Wirkstoffs Folinsäure, mithin ein Wirkstoffmindergehalt von 32,0 % bei einer Messunsicherheit von 3,0 % ergeben. Die
1404724
1405zweite Prüfung mittels HPLC/DAD habe einen Befund von 475,9 mg und mithin einen Wirkstoffmindergehalt von 33,0 % bei einer Messunsicherheit von 3,0 % ergeben.
1406Die Stabilität des Wirkstoffs sei gesichert gewesen. Die erste Untersuchung mittels HPLC/DAD am 07.12.2016 habe noch innerhalb des durch die STABIL-LISTE® ausgewiesenen physikalisch-chemisch stabilen Zeitfensters von 28 Tagen durchgeführt werden können. Auszugehen sei insoweit aufgrund der Kennziffer des Herstellungsprotokolls von „20161125130“ von einer Herstellung nicht vor dem 25.11.2016. Die Lagerung der Probe sei durchweg temperaturkontrolliert und lichtgeschützt erfolgt. Für die Prüfung mittels HPLC/DAD habe sich anhand von vier erstellten Stabilitätsver-gleichsmustern mit dem Wirkstoff Folinsäure (mit den jeweils höchsten und niedrigsten deklarierten Wirkstoffinhalten sowie gelagert bei Raum- und Kühltemperatur) ergeben, dass die Stabilitätsvergleichsproben nach 13 Tagen alle einen nahezu unveränderten Wirkstoffgehalt aufgewiesen haben. Eine Abnahme des Wirkstoffgehaltes auf die Größenordnung des Mindergehaltes der Probe sei nicht festzustellen. Ein solcher könne sich auch nicht durch eine andere Lagerung (Raum- statt Kühltemperatur oder andersherum) erklären.
1407Tat 61.920 der Anklage:
1408Zum Infusionsbeutel der Patientin führte der Sachverständige L aus,
1409dass sich aus der Deklaration auf dem Etikett eine Befüllung mit 725,00 mg des Wirkstoffs Folinsäure in einer 0,9 %-igen NaCl-Trägerlösung ergeben habe. Die Identität des Wirkstoffs Folinsäure habe sich bestätigt. Bei der ersten Prüfung mittels HPLC/DAD habe sich ein Befund von 121,6 mg des Wirkstoffs Folinsäure, mithin ein Wirkstoffmindergehalt von 83,2 % bei einer Messunsicherheit von 3,0 % ergeben. Die zweite Prüfung mittels HPLC/DAD habe einen Befund von 121,5 mg und mithin ebenfalls einen Wirkstoffmindergehalt von 83,2 % bei einer Messunsicherheit von 3,0 % ergeben.
1410Die Stabilität des Wirkstoffs sei gesichert gewesen. Die erste Untersuchung mittels HPLC/DAD am 08.12.2016 habe noch innerhalb des durch die STABIL-LISTE® ausgewiesenen physikalisch-chemisch stabilen Zeitfensters von 28 Tagen durchgeführt werden können. Auszugehen sei insoweit aufgrund der Kennziffer des Herstellungsprotokolls von „20161125127“ von einer Herstellung nicht vor dem 25.11.2016. Die
1411725
1412Lagerung der Probe sei durchweg temperaturkontrolliert und lichtgeschützt erfolgt. Für die Prüfung mittels HPLC/DAD habe sich anhand von vier erstellten Stabilitätsver-gleichsmustern mit dem Wirkstoff Folinsäure (mit den jeweils höchsten und niedrigsten deklarierten Wirkstoffinhalten sowie gelagert bei Raum- und Kühltemperatur) ergeben, dass die Stabilitätsvergleichsproben nach 13 Tagen alle einen nahezu unveränderten Wirkstoffgehalt aufgewiesen haben. Eine Abnahme des Wirkstoffgehaltes auf die Größenordnung des Mindergehaltes der Probe sei nicht festzustellen. Ein solcher könne sich auch nicht durch eine andere Lagerung (Raum- statt Kühltemperatur oder andersherum) erklären.
1413Tat 61.921 der Anklage:
1414Zum Infusionsbeutel der Patientin führte der Sachverständige L aus, dass
1415sich aus der Deklaration auf dem Etikett eine Befüllung mit 160,00 mg des Wirkstoffs Paclitaxel in einer 0,9 %-igen NaCl-Trägerlösung ergeben habe. Die Identität des Wirkstoffs Paclitaxel habe sich bestätigt. Bei der ersten Prüfung mittels HPLC/DAD habe sich ein Befund von 88,7 mg des Wirkstoffs Paclitaxel, mithin ein Wirkstoffminderge-halt von 44,6 % bei einer Messunsicherheit von 3,2 % ergeben. Die zweite Prüfung mittels HPLC/DAD habe einen Befund von 85,8 mg und mithin einen Wirkstoffminder-gehalt von 46,3 % bei einer Messunsicherheit von 3,0 % ergeben.
1416Die Stabilität des Wirkstoffs sei gesichert gewesen. Die erste Untersuchung mittels HPLC/DAD am 08.12.2016 habe noch innerhalb des durch die STABIL-LISTE® ausgewiesenen physikalisch-chemisch stabilen Zeitfensters von 14 Tagen durchgeführt werden können. Auszugehen sei insoweit aufgrund der Kennziffer des Herstellungsprotokolls von „20161125162“ von einer Herstellung nicht vor dem 25.11.2016. Die Lagerung der Probe sei durchweg temperaturkontrolliert und lichtgeschützt erfolgt. Für die Prüfung mittels HPLC/DAD habe sich anhand des erstellten Stabilitätsvergleichs-musters ergeben, dass die Stabilitätsvergleichsproben nach 15 Tagen einen nahezu unveränderten Wirkstoffgehalt aufgewiesen haben. Eine Abnahme des Wirkstoffgehal-tes auf die Größenordnung des Mindergehaltes der Probe sei nicht festzustellen.
1417Tat 61.922 der Anklage:
1418726
1419Zum weiteren Infusionsbeutel des Patienten führte der Sachverständige L
1420aus, dass sich aus der Deklaration auf dem Etikett eine Befüllung mit 1.000,00 mg des Wirkstoffs Folinsäure in einer 0,9 %-igen NaCl-Trägerlösung ergeben habe. Die Identität des Wirkstoffs Folinsäure habe sich bestätigt. Bei der ersten Prüfung mittels HPLC/DAD habe sich ein Befund von 499,0 mg des Wirkstoffs Folinsäure, mithin ein Wirkstoffmindergehalt von 50,1 % bei einer Messunsicherheit von 3,0 % ergeben. Die zweite Prüfung mittels HPLC/DAD habe einen Befund von 494,6 mg und mithin einen Wirkstoffmindergehalt von 50,5 % bei einer Messunsicherheit von 3,0 % ergeben.
1421Die Stabilität des Wirkstoffs sei gesichert gewesen. Die erste Untersuchung mittels HPLC/DAD am 08.12.2016 habe noch innerhalb des durch die STABIL-LISTE® ausgewiesenen physikalisch-chemisch stabilen Zeitfensters von 28 Tagen durchgeführt werden können. Auszugehen sei insoweit aufgrund der Kennziffer des Herstellungsprotokolls von „20161125131“ von einer Herstellung nicht vor dem 25.11.2016. Die Lagerung der Probe sei durchweg temperaturkontrolliert und lichtgeschützt erfolgt. Für die Prüfung mittels HPLC/DAD habe sich anhand von vier erstellten Stabilitätsver-gleichsmustern mit dem Wirkstoff Folinsäure (mit den jeweils höchsten und niedrigsten deklarierten Wirkstoffinhalten sowie gelagert bei Raum- und Kühltemperatur) ergeben, dass die Stabilitätsvergleichsproben nach 13 Tagen alle einen nahezu unveränderten Wirkstoffgehalt aufgewiesen haben. Eine Abnahme des Wirkstoffgehaltes auf die Größenordnung des Mindergehaltes der Probe sei nicht festzustellen. Ein solcher könne sich auch nicht durch eine andere Lagerung (Raum- statt Kühltemperatur oder andersherum) erklären.
1422Bei dieser Probe habe zudem der visuelle Vergleich der Farbgebung des Beutels Hinweise auf eine Unterdosierung ergeben. So sei der Beutel allenfalls leicht gelblich verfärbt gewesen. Ein weiterer Beutel mit dem Wirkstoff Folinsäure zu Proben-Nummer 97, der ebenfalls mit einem Gehalt von 1.000,00 mg deklariert gewesen sei und der als ordnungsgemäß geprobt worden sei, sei deutlich gelblicher gewesen. Hintergrund sei die gelbliche Färbung des Wirkstoffs Folinsäure beim Hersteller
1423![]() Tat 61.923 der Anklage:
Tat 61.923 der Anklage:
Zum weiteren Infusionsbeutel der Patientin führte der Sachverständige L aus, dass sich aus der Deklaration auf dem Etikett eine Befüllung mit 372,00 mg des
1425727
1426Wirkstoffs Folinsäure in einer 0,9 %-igen NaCl-Trägerlösung ergeben habe. Die Identität des Wirkstoffs Folinsäure habe sich bestätigt. Bei der ersten Prüfung mittels HPLC/DAD habe sich ein Befund von 136,7 mg des Wirkstoffs Folinsäure, mithin ein Wirkstoffmindergehalt von 63,2 % bei einer Messunsicherheit von 3,0 % ergeben. Die zweite Prüfung mittels HPLC/DAD habe einen Befund von 132,6 mg und mithin einen Wirkstoffmindergehalt von 64,4 % bei einer Messunsicherheit von 3,0 % ergeben.
1427Die Stabilität des Wirkstoffs sei gesichert gewesen. Die erste Untersuchung mittels HPLC/DAD am 08.12.2016 habe noch innerhalb des durch die STABIL-LISTE® ausgewiesenen physikalisch-chemisch stabilen Zeitfensters von 28 Tagen durchgeführt werden können. Auszugehen sei insoweit aufgrund der Kennziffer des Herstellungsprotokolls von „20161125129“ von einer Herstellung nicht vor dem 25.11.2016. Die Lagerung der Probe sei durchweg temperaturkontrolliert und lichtgeschützt erfolgt. Für die Prüfung mittels HPLC/DAD habe sich anhand von vier erstellten Stabilitätsver-gleichsmustern mit dem Wirkstoff Folinsäure (mit den jeweils höchsten und niedrigsten deklarierten Wirkstoffinhalten sowie gelagert bei Raum- und Kühltemperatur) ergeben, dass die Stabilitätsvergleichsproben nach 13 Tagen alle einen nahezu unveränderten Wirkstoffgehalt aufgewiesen haben. Eine Abnahme des Wirkstoffgehaltes auf die Größenordnung des Mindergehaltes der Probe sei nicht festzustellen. Ein solcher könne sich auch nicht durch eine andere Lagerung (Raum- statt Kühltemperatur oder andersherum) erklären.
1428Tat 61.924 der Anklage:
1429Zum weiteren Infusionsbeutel der Patientin führte der Sachverständige
1430L aus, dass sich aus der Deklaration auf dem Etikett eine Befüllung mit
1431800,00 mg des Wirkstoffs Fluorouracil in einer 0,9 %-igen NaCl-Trägerlösung ergeben habe. Die Identität des Wirkstoffs Fluorouracil habe sich bestätigt. Bei der ersten Prüfung mittels HPLC/DAD habe sich ein Befund von 544,1 mg des Wirkstoffs Fluoroura-cil, mithin ein Wirkstoffmindergehalt von 32,0 % bei einer Messunsicherheit von 3,6 % ergeben. Die zweite Prüfung mittels HPLC/DAD habe einen Befund von 579,5 mg und mithin einen Wirkstoffmindergehalt von 27,6 % bei einer Messunsicherheit von 3,7 % ergeben.
1432728
1433Die Stabilität des Wirkstoffs sei gesichert gewesen. Die erste Untersuchung mittels HPLC/DAD am 23.12.2016 habe noch innerhalb des durch die STABIL-LISTE® ausgewiesenen physikalisch-chemisch stabilen Zeitfensters von 28 Tagen durchgeführt werden können. Auszugehen sei insoweit aufgrund der Kennziffer des Herstellungsprotokolls von „20161125145“ von einer Herstellung nicht vor dem 25.11.2016. Die Lagerung der Probe sei durchweg temperaturkontrolliert und lichtgeschützt erfolgt. Für die Prüfung mittels HPLC/DAD habe sich anhand von zwei erstellten Stabilitätsver-gleichsmustern mit dem Wirkstoff Fluorouracil ergeben, dass die Stabilitätsvergleichs-proben nach 14 Tagen einen nahezu unveränderten Wirkstoffgehalt aufgewiesen haben. Nach 27 Tagen habe der Wirkstoffgehalt zwar leicht abgenommen, sich aber noch im Spezifikationsintervall von +/- 10 % bewegt. Eine Abnahme des Wirkstoffgehaltes auf die Größenordnung des Mindergehaltes der Probe sei nicht festzustellen gewesen.
1434Tat 61.925 der Anklage:
1435Zum weiteren Infusionsbeutel des Patienten führte der Sachverständige L
1436aus, dass sich aus der Deklaration auf dem Etikett eine Befüllung mit 780,00 mg des Wirkstoffs Fluorouracil in einer 0,9 %-igen NaCl-Trägerlösung ergeben habe. Die Identität des Wirkstoffs Fluorouracil habe sich bestätigt. Bei der ersten Prüfung mittels HPLC/DAD habe sich ein Befund von 535,6 mg des Wirkstoffs Fluorouracil, mithin ein Wirkstoffmindergehalt von 31,3 % bei einer Messunsicherheit von 3,5 % ergeben. Die zweite Prüfung mittels HPLC/DAD habe einen Befund von 568,4 mg und mithin einen Wirkstoffmindergehalt von 27,1 % bei einer Messunsicherheit von 3,8 % ergeben.
1437Die Stabilität des Wirkstoffs sei gesichert gewesen. Die erste Untersuchung mittels HPLC/DAD am 23.12.2016 habe noch innerhalb des durch die STABIL-LISTE® ausgewiesenen physikalisch-chemisch stabilen Zeitfensters von 28 Tagen durchgeführt werden können. Auszugehen sei insoweit aufgrund der Kennziffer des Herstellungsprotokolls von „20161125148“ von einer Herstellung nicht vor dem 25.11.2016. Die Lagerung der Probe sei durchweg temperaturkontrolliert und lichtgeschützt erfolgt. Für die Prüfung mittels HPLC/DAD habe sich anhand von zwei erstellten Stabilitätsver-gleichsmustern mit dem Wirkstoff Fluorouracil ergeben, dass die Stabilitätsvergleichs-proben nach 14 Tagen einen nahezu unveränderten Wirkstoffgehalt aufgewiesen haben. Nach 27 Tagen habe der Wirkstoffgehalt der Stabilitätsvergleichsproben zwar
1438729
1439leicht abgenommen, sich aber noch im Spezifikationsintervall von +/- 10 % bewegt. Eine Abnahme des Wirkstoffgehaltes auf die Größenordnung des Mindergehaltes der Probe sei nicht festzustellen gewesen.
1440Tat 61.926 der Anklage:
1441Zum Infusionsbeutel des Patienten führte der Sachverständige LM aus,
1442dass sich aus der Deklaration auf dem Etikett eine Befüllung mit 145,00 mg des Wirkstoffs Paclitaxel in einer 0,9 %-igen NaCI-Trägerlösung ergeben habe. Die Identität des Wirkstoffs Paclitaxel habe sich bestätigt. Bei der ersten Prüfung mittels HPLC/DAD habe sich ein Befund von 75,63 mg des Wirkstoffs Paclitaxel, mithin ein Wirkstoffmin-dergehalt von 47,8 % bei einer Messunsicherheit von 3,4 % ergeben. Die zweite Prüfung mittels HPLC/DAD habe einen Befund von 75,2 mg und mithin einen Wirkstoff-mindergehalt von 48,1 % bei einer Messunsicherheit von 3,0 % ergeben.
1443Die Stabilität des Wirkstoffs sei gesichert gewesen. Die erste Untersuchung mittels HPLC/DAD am 08.12.2016 habe noch innerhalb des durch die STABIL-LISTE® ausgewiesenen physikalisch-chemisch stabilen Zeitfensters von 14 Tagen durchgeführt werden können. Auszugehen sei insoweit aufgrund der Kennziffer des Herstellungsprotokolls von „20161128020" von einer Herstellung nicht vor dem 28.11.2016. Die Lagerung der Probe sei durchweg temperaturkontrolliert und lichtgeschützt erfolgt. Für die Prüfung mittels HPLC/DAD habe sich anhand des erstellten Stabilitätsvergleichs-musters ergeben, dass die Stabilitätsvergleichsproben nach 15 Tagen einen nahezu unveränderten Wirkstoffgehalt aufgewiesen haben. Eine Abnahme des Wirkstoffgehal-tes auf die Größenordnung des Mindergehaltes der Probe sei nicht festzustellen gewesen.
1444Tat 61.927 der Anklage:
1445Zum Infusionsbeutel der Patientin führte der Sachverständige LM aus,
1446dass sich aus der Deklaration auf dem Etikett eine Befüllung mit 150,00 mg des Wirkstoffs Doxetacel in einer 0,9 %-igen NaCI-Trägerlösung ergeben habe. Die Identität des Wirkstoffs Doxetacel habe sich bestätigt. Bei der ersten Prüfung mittels HPLC/DAD habe sich ein Befund von 70,9 mg des Wirkstoffs Doxetacel, mithin ein
1447730
1448Wirkstoffmindergehalt von 52,7 % bei einer Messunsicherheit von 3,0 % ergeben. Die zweite Prüfung mittels HPLC/DAD habe einen Befund von 68,4 mg und mithin einen Wirkstoffmindergehalt von 54,4 % bei einer Messunsicherheit von 3,0 % ergeben.
1449Die Stabilität des Wirkstoffs sei gesichert gewesen. Die erste Untersuchung mittels HPLC/DAD am 27.12.2016 habe unmittelbar nach Ablauf des durch die STABIL-LISTE® ausgewiesenen physikalisch-chemisch stabilen Zeitfensters von 28 Tagen durchgeführt werden können. Auszugehen sei insoweit aufgrund der Kennziffer des Herstellungsprotokolls von „20161128005“ von einer Herstellung nicht vor dem 28.11.2016. Die Lagerung der Probe sei durchweg temperaturkontrolliert und lichtgeschützt erfolgt. Zur Ausflockung der Stabilitätsvergleichsmuster zum Wirkstoff Do-xetacel wird auf die Ausführungen zur Tat 61.912 Bezug genommen. Für die Probe aus dem Labor des Angeklagten gelte auch insoweit, dass diese Probe deutlich vor dem Ablauf von 42 Tagen untersucht worden sei, eine Ausflockung sei gerade nicht festzustellen gewesen, dies auch nicht nach dem Ablauf von 45 Tagen. Zudem spreche auch der geprüfte nahezu unveränderte Mindergehalt von 52,7 % und 54,4 % für die Stabilität. Eine Abnahme des Wirkstoffgehaltes auf die Größenordnung des Mindergehaltes der Probe sei nicht durch eine Ausflockung oder Abnahme der Stabilität zu erklären.
1450Tat 61.928 der Anklage:
1451Zum Infusionsbeutel des Patienten führte der Sachverständige L aus,
1452dass sich aus der Deklaration auf dem Etikett eine Befüllung mit 300,00 mg des Wirkstoffs Etoposid in einer 0,9 %-igen NaCl-Trägerlösung ergeben habe. Die Identität des Wirkstoffs Etoposid habe sich bestätigt. Bei der ersten Prüfung mittels HPLC/DAD habe sich ein Befund von 98,6 mg des Wirkstoffs Etoposid, mithin ein Wirkstoffminder-gehalt von 67,1 % bei einer Messunsicherheit von 3,0 % ergeben. Die zweite Prüfung mittels HPLC/DAD habe einen Befund von 102,1 mg und mithin einen Wirkstoffmin-dergehalt von 66,0 % bei einer Messunsicherheit von 3,0 % ergeben.
1453Zudem habe die Prüfung mittels HPLC/DAD auf Benzylalkohol ergeben, dass insoweit ein Gehalt von 98,5 mg und mithin ein Wirkstoffmindergehalt von 67,2 % bei einer Messunsicherheit von 3,0 % (1. Durchgang nach 28 Tagen) bzw. ein Gehalt von 101,2 mg und mithin ein Wirkstoffmindergehalt von 66,3 % bei einer Messunsicherheit
1454731
1455von 3,0 % (2. Durchgang nach 46 Tagen) festzustellen sei. Benzylalkohol ist dem Wirk-
1456stoff Etoposid des Herstellers als Konservierungsstoff in gleicher Konzentrationzugesetzt ist. Auch dies bestätige aufgrund der nahezu identischen Ergebnisse die erstgenannte Prüfung.
1457Die Stabilität des Wirkstoffs sei gesichert gewesen. Die erste Untersuchung mittels HPLC/DAD am 22.12.2016 habe – ebenso wie die Sicherstellung – nicht innerhalb des durch die STABIL-LISTE® ausgewiesenen physikalisch-chemisch stabilen Zeitfensters von 48 Stunden durchgeführt werden können. Auszugehen sei insoweit aufgrund der Kennziffer des Herstellungsprotokolls von „20161125144“ von einer Herstellung nicht vor dem 25.11.2016. Die Lagerung der Probe sei auf Grundlage der Angaben auf dem Etikett bei Raumtemperatur erfolgt. Anhand von vier erstellten Stabilitätsver-gleichsmustern (jeweils zwei zur Testung des Wirkstoffs Etoposid und des Benzylal-kohols) habe sich ergeben, dass am 28. Tag zwar Auskristallisationen feststellbar gewesen seien, die Wirkstoffgehalte der Stabilitätsvergleichsproben hinsichtlich Etoposid und Benzylalkohol aber einen nahezu unveränderten Wirkstoffgehalt aufgewiesen haben. Eine Abnahme des Wirkstoffgehaltes auf die Größenordnung des Mindergehaltes der Probe sei nicht festzustellen gewesen. Auch die Konstanz der Werte der Probe aus dem Labor des Angeklagten hinsichtlich Etoposid und Benzylalkohol nach 27 bzw. 28 Tagen und nach 46 Tagen spreche für den festgestellten Mindergehalt, da kein Abbau festzustellen gewesen sei.
1458Tat 61.929 der Anklage:
1459Zum weiteren Infusionsbeutel des Patienten führte der Sachverständige
1460L aus, dass sich aus der Deklaration auf dem Etikett eine Befüllung mit
1461975,00 mg des Wirkstoffs Folinsäure in einer 0,9 %-igen NaCl-Trägerlösung ergeben habe. Die Identität des Wirkstoffs Folinsäure habe sich bestätigt. Bei der ersten Prüfung mittels HPLC/DAD habe sich ein Befund von 249,2 mg des Wirkstoffs Folinsäure, mithin ein Wirkstoffmindergehalt von 74,4 % bei einer Messunsicherheit von 3,0 % ergeben. Die zweite Prüfung mittels HPLC/DAD habe einen Befund von 244,5 mg und mithin einen Wirkstoffmindergehalt von 74,9 % bei einer Messunsicherheit von 3,0 % ergeben.
1462732
1463Die Stabilität des Wirkstoffs sei gesichert gewesen. Die erste Untersuchung mittels HPLC/DAD am 08.12.2016 habe noch innerhalb des durch die STABIL-LISTE® ausgewiesenen physikalisch-chemisch stabilen Zeitfensters von 28 Tagen durchgeführt werden können. Auszugehen sei insoweit aufgrund der Kennziffer des Herstellungsprotokolls von „20161125132“ von einer Herstellung nicht vor dem 25.11.2016. Die Lagerung der Probe sei durchweg temperaturkontrolliert und lichtgeschützt erfolgt. Für die Prüfung mittels HPLC/DAD habe sich anhand von vier erstellten Stabilitätsver-gleichsmustern mit dem Wirkstoff Folinsäure (mit den jeweils höchsten und niedrigsten deklarierten Wirkstoffinhalten sowie gelagert bei Raum- und Kühltemperatur) ergeben, dass die Stabilitätsvergleichsproben nach 13 Tagen alle einen nahezu unveränderten Wirkstoffgehalt aufgewiesen haben. Eine Abnahme des Wirkstoffgehaltes auf die Größenordnung des Mindergehaltes der Probe sei nicht festzustellen. Ein solcher könne sich auch nicht durch eine andere Lagerung (Raum- statt Kühltemperatur oder andersherum) erklären.
1464Tat 61.930 der Anklage:
1465Zum Infusionsbeutel der Patientin führte der Sachverständige L aus, dass
1466sich aus der Deklaration auf dem Etikett eine Befüllung mit 20,00 mg des Wirkstoffs Dexamethason in einer 0,9 %-igen NaCl--Trägerlösung ergeben habe. Aus der Therapieinformation aus dem Programm Zenzy habe sich wiederum wie auch bei der Probe 77a (Tat 61.911) ergeben, dass insoweit das Fertigarzneimittel Dexahexal verwendet worden sei mit dem Wirkstoff Dexamethason-21-(dihydrogen)phosphat in einer Konzentration von 4 mg/ml. Auch insoweit sei unter Zugrundelegung der Therapieinformation eine Wirkstoffmenge von 20,00 mg Dexamethason-21-(dihydrogen)phosphat zu erwarten gewesen. Die Identität des Wirkstoffs Dexamethason-21-(dihydrogen)phos-phat habe sich bestätigt, der deklarierte Wirkstoff Dexamethason sei hingegen zunächst nicht festzustellen gewesen. Bei der ersten Prüfung mittels HPLC/DAD habe sich ein Befund von 4,52 mg des Wirkstoffs Dexamethason-21-(dihydrogen)phosphat, mithin ein Wirkstoffmindergehalt von 77,4 % bei einer Messunsicherheit von 3,8 % ergeben. Die zweite Prüfung mittels HPLC/DAD habe einen Befund von 4,37 mg von Dexamethason-21-(dihydrogen)phosphat und als Abbauprodukt 0,06 mg Dexame-thason (umgerechnet 0,07 mg Dexamethason-21-(dihydrogen)phosphat), insgesamt
1467733
1468somit 4,44 mg und mithin einen Wirkstoffmindergehalt von 77,8 % bei einer Messunsicherheit von 6,5 % ergeben.
1469Die Stabilität des Wirkstoffs sei gesichert gewesen. Auszugehen sei insoweit aufgrund der Kennziffer des Herstellungsprotokolls von „20161125116“ von einer Herstellung nicht vor dem 25.11.2016. Die Beprobung sei am 06.01.2017 wie auch bei der Probe 77a (Tat 61.911) nach 39 Tagen erfolgt. Für die Prüfungen mittels HPLC/DAD habe sich anhand der erstellten Stabilitätsvergleichsmuster ergeben, dass alle Stabilitäts-vergleichsproben in dem untersuchten Zeitraum von 39 Tagen einen nahezu unveränderten Wirkstoffgehalt aufgewiesen hätten. Eine Abnahme des Wirkstoffgehaltes sei hierbei nicht zu beobachten gewesen.
1470(3) Würdigung der Analysen des Sachverständigen L
1471Die Kammer folgte den nachvollziehbaren und plausibel dargestellten Analyseergeb-
1472nissen des Sachverständigen L .
1473Sachkunde des Sachständigen
1474Der Sachverständige L ist uneingeschränkt sachkundig, wie sich aus seinen ein-
1475schlägigen und langjährigen Erfahrungen in der Untersuchung von Arzneimitteln ergibt. Er ist von Beruf Apotheker. Er ist seit rund fünfzehn Jahren im Bereich der Arzneimitteluntersuchungen tätig. Dort ist es auch Teil seiner Tätigkeit, Arzneimittelproben auf Gehalt, Identität und Kennzeichnung zu untersuchen, die von Amtsapothekern bei Herstellern – Apotheken und Pharmaherstellern – gezogen worden sind. Auch die Untersuchung von Zytostatika war bereits Teil seiner beruflichen Tätigkeit, sowohl in einem größeren Forschungsprojekt, als auch im Zusammenhang mit eingesandten Proben von Pharmaunternehmen.
1476Bei seinen Ausführungen in der Hauptverhandlung wurden die fundierten wissenschaftlichen Kenntnisse und die langjährige berufliche Erfahrung deutlich. Jeden Ver-
1477fahrensschritt hat der Sachverständige L nachvollziehbar und anschaulich erläu-tert. Hierbei setzte er sich mit Nachfragen und Vorhalten zu Einzelheiten der von ihm untersuchten Proben und den jeweiligen Untersuchungsergebnissen differenziert auseinander und erläuterte seine Analyseergebnisse.
1478![]() Neutralität des Sachverständigen
Neutralität des Sachverständigen
Der Sachverständige L ist neutral. Zu den Verfahrensbeteiligten steht er in kei-
1480nerlei Verbindung. Als Angestellter einer öffentlichen Einrichtung hat er kein persönliches Interesse am Verfahrensausgang.
1481Methodisches Vorgehen des Sachverständigen
1482Der ordnungsgemäße Transport und die ordnungsgemäße Lagerung der Proben wur-
1483den vom Sachverständigen L detailliert und nachvollziehbar, auch anhand hand-schriftlicher Kontrollunterlagen vom Tag der Durchsuchung und aus dem LZG, belegt.
1484Der Sachverständige L hat es bei keiner Probe bei einer einzigen Messung be-
1485lassen. Jede Probe ist mindestens zweifach analysiert worden, einzelne Proben darüber hinaus mit weiteren Messverfahren (vgl. oben). Die von einem Verteidiger in öffentlicher Hauptverhandlung aufgestellte Behauptung, es habe „ja keine B-Probe gegeben“, ist daher objektiv falsch. Zur Absicherung seiner Ergebnisse hat der Sachverständige weitere Untersuchungen durchgeführt, insbesondere mit großem Aufwand Stabilitätsvergleichsmuster angesetzt.
1486Die Kammer ist überzeugt, dass die angewandten Messverfahren ordnungsgemäß durchgeführt worden sind. Das LZG ist ein akkreditiertes staatliches Institut, welches hoheitliche Aufgaben der Arzneimitteluntersuchung wahrnimmt. Sowohl der Sachver-
1487ständige L als auch die von ihm betreuten Mitarbeiter sind ausgebildet und ge-schult. Sie unterliegen einem geprüften Qualitätsmanagementsystem, welches sicherstellt, dass Proben, wie die Proben aus dem Labor des Angeklagten, ordnungsgemäß gelagert und beprobt werden.
1488Gegen eine ordnungsgemäße Arbeitsweise des Sachverständigen spricht nicht, dass er einzelne Werte aus seinen vorab übersandten schriftlichen Gutachten in der Hauptverhandlung korrigierte. Bei einer Tabelle, die die Analyseergebnisse zusammenfassend darstelle, hatten sich einzelne Fehler bei Nachkommastellen der Ergebnisse bzw. der Messunsicherheit ergeben. Der Sachverständige hat auf die Fehler auf eigene Veranlassung hingewiesen und sie korrigiert. Sie seien ihm bei nochmaliger Kontrolle der Ergebnisse aufgefallen.
1489735
1490Diese Fehler vermögen keine Zweifel der Kammer zu begründen. Es handelt sich dabei um nicht um Fehler der schriftlichen Gutachten zu den einzelnen Proben, sondern Übertragungsfehler aus den Einzelgutachten in die zusammenfassende Tabelle. Fehlerhafte Werte, die ein Analyseergebnis grundlegend änderten (oder einen Mindergeh-
1491alt ausschlossen), lagen nicht vor. Der Sachverständige L bestätigte mit der er-neuten Überprüfung seiner Analyseergebnisse und der vorab übersandten Gutachten seine besonders gründliche Arbeitsweise, die der gesamten Analyse und Begutachtung zugrunde lag.
1492Schlüssigkeit der Analyseergebnisse
1493Die Analyseergebnisse sind auch in sich schlüssig: Bei allen Proben, bei denen Mindergehalte festgestellt wurden, waren die Ergebnisse der diversen Analysen zu unterschiedlichen Zeitpunkten, teils mit unterschiedlichen Messverfahren, nahezu identisch bzw. schwankten allenfalls im Rahmen der zu erwartenden Messunsicherheit. Wenn also für die Probe Oxaliplatin (Tat 61.893) die beiden HPLC/DAD-Messungen an unterschiedlichen Tagen Mindergehalte von 39 % bzw. 39,6 % ergeben und das vollständig andere Messverfahren ICP/OES einen Mindergehalt von 39,9 %, dann nimmt die Kammer nicht an, dass diese drei Messungen alle zufällig zu demselben falschen Ergebnis kommen. Vielmehr zieht sie den Schluss (wie auch in allen Fällen), dass der ermittelte Wert von rund 39 % zutrifft und die untersuchte Arzneimittelzubereitung nicht den erforderlichen Wirkstoffgehalt aufwies.
1494Keine Zweifel aufgrund der Ausführungen der Sachverständigen Prof. Dr. S , Dr.
1495K und Prof. B
1496Die tragfähigen Ausführungen des Sachverständigen L werden durch die Anga-
1497ben der vom Angeklagten beauftragten Sachverständigen Prof. Dr. S , Dr. K
1498und Prof. Dr. B nicht in Zweifel gezogen. Diese weiteren Sachverständigen habenkeine eigenen Analysen der Wirkstoffproben durchgeführt, sondern sind methodenkritisch vorgegangen. Im Einzelnen:
1499Ausführungen des Sachverständigen Prof. S
1500736
1501![]() Der Sachverständige Prof. Dr. S ist Pharmazeut und Leiter des privaten
Der Sachverständige Prof. Dr. S ist Pharmazeut und Leiter des privaten
![]() , das sich mit der Analyse von Arzneistoffen und der Wirkung von Arzneistoffen auf den Organismus beschäftigt. In Zusammenarbeit mit Kliniken ist das Institut auch mit der Medikamentenzulassung befasst.
, das sich mit der Analyse von Arzneistoffen und der Wirkung von Arzneistoffen auf den Organismus beschäftigt. In Zusammenarbeit mit Kliniken ist das Institut auch mit der Medikamentenzulassung befasst.
Gegenstand der Beauftragung des Sachverständigen durch den Angeklagten bereits während des Ermittlungsverfahrens war die methodenkritische Bewertung der Prüfun-
1504gen der Sachverständigen L und Dr. G und die Feststellung, ob diese demaktuellen Stand der pharmazeutischen Wissenschaft entsprechen. Dazu hatte der
1505Sachverständige Prof. S vor Anklageerhebung zunächst eine allgemeine Stel-lungnahme verfasst. Die detaillierten schriftlichen Vorabgutachten des
1506Sachverständi-gen L waren dem Sachverständigen Prof. S zu diesemZeitpunkt nicht bekannt.
1507Nach Beiziehung der Dokumentations- und Arbeitsunterlagen des LZG und des PEI durch die Kammer auf Anregung der Verteidigung hatte der Sachverständige Prof. Dr.
1508S gemeinsam mit seiner Mitarbeiterin, der Sachverständigen Dr. K , die Un-terlagen an drei Tagen durchgesehen. Insoweit war ihm persönlich eine vollständige Durchsicht der Unterlagen nach seinen eigenen Angaben nicht möglich, er habe rund 10 % des Datenmaterials angesehen.
1509Zu den Prüfungen des LZG führte der Sachverständige Prof. S in der Hauptver-
1510handlung aus, dass er die vom LZG verwandte Methode der Messung mittels HPLC kenne und als geeignet für die vorliegende Beprobung ansehe; es handele sich um ein Standardverfahren. Auch bei der weiteren Methode der ICP/OES-Messung handele es sich um eine Standardtechnik. Weitere Angaben zu diesem Messverfahren konnte der Sachverständige mangels eigener Erfahrungen nicht machen.
1511Die Anfertigung von Stabilitätsvergleichsmustern durch das LZG wurde vom
1512Sachverständigen Prof. S als zutreffender Weg beschrieben, um einehinreichende Sicherheit im Hinblick auf die Entwicklung eines Wirkstoffes und die Validität der angewandten Testverfahren zu erhalten.
1513Konkrete Fehler des LZG bei der Testung der Proben aus dem Labor des Angeklagten
1514vermochte der Sachverständige Prof. S nicht zu benennen. Er könne nur bei voll-ständiger Durchsicht aller Unterlagen eine Bewertung vornehmen, diese vollständige
1515737
1516Durchsicht habe er aber aus zeitlichen Gründen nicht vorgenommen. Zu den durchge-
1517sehenen Unterlagen führte der Sachverständige Prof. S weiter aus, dass er Vor-gänge gesehen habe, die er persönlich anders gemacht hätte. Eine Konkretisierung erfolgte insoweit nicht. Er gab weiter an, dass sich seine Kritikpunkte bei einer vollständigen Durchsicht der Unterlagen möglicherweise erledigt hätten.
1518Der Sachverständige Prof. S erklärte weiter, dass allgemein eine lückenlose Do-
1519kumentation aller Arbeitsschritte und -vorgänge erforderlich sei, um valide Ergebnisse zu erhalten. Insoweit habe er keine Dokumente zu den Temperaturen der Proben beim Transport bzw. der Lagerung gefunden. Er habe auch nicht erkennen können, welche Mitarbeiter konkret welchen Arbeitsschritt durchgeführt hätten. Auf Vorhalt, dass die entsprechenden Unterlagen vorhanden seien, führte der Sachverständige Prof. S weiter aus, dass dies für ihn „nicht nachvollziehbar“ gewesen sei. Indes stehen der Kammer insgesamt 22 Stehordner mit Daten, SOP’s und Prüfergebnissen des LZG zur Verfügung, in die ihm Einsicht gewährt wurde.
1520Die Ausführungen des Sachverständigen Prof. S sind damit nicht geeignet, das
1521Gutachten des Sachverständigen L mit seinen Prüfergebnissen in Zweifel zu zie-
1522hen. Prof. S gibt selbst an, die verwendeten Methoden als geeignet zur Ermittlung
1523valider Prüfergebnisse zu qualifizieren.
1524Der weitere Einwand der (fehlenden) hinreichenden Dokumentation konnte von ihm
1525nicht näher untermauert werden (zu den Ausführungen von Dr. K sogleich). Erkonnte keine konkreten Angaben dazu machen, dass ein Prüfschritt, der erforderlich
1526gewesen wäre, fehlte oder jedenfalls nicht dokumentiert wurde. Dass Prof. S zu-dem nicht ausschließen konnte, dass bei einer Durchsicht aller Unterlagen seine (nicht näher konkretisierte) Kritik ausgeräumt worden wäre, zeigt die Unergiebigkeit seines
1527Gutachtens zu der Qualität der Analyse des Sachverständigen L .
1528Ausführungen der Sachverständigen Dr. K
1529Die Sachverständige Dr. K ist Chemikerin und im Institut des Sachverständigen
1530Prof. S als Laborleiterin tätig. Im Rahmen dieser Tätigkeit am Institut habe sie
1531verschiedene Audits und Inspektionen durchlaufen. Die Untersuchung von Arzneimitteln gehöre auch zu ihrem Arbeitsbereich. Gemäß ihrer Beauftragung durch den Angeklagten habe sie die Sichtung der Unterlagen vorgenommen, die der Kammer vom
1532738
1533LZG und vom PEI zur Verfügung gestellt wurden.
1534Die Sachverständige Dr. K führte aus, dass sie bei den genannten Unterlagen zu
1535einem Messgerät eine Qualifizierung vermisse, es sei nur die aktuelle Qualifizierung vom 15.02.2017, nicht aber die vorherige Qualifizierung vorhanden. Es fehlten zudem Wiegeprotokolle für drei Proben, die als ordnungsgemäß getestet worden seien. Weiter fehlten Unterlagen zur monatlichen Verifizierung von Waagen und zu eingesetzten pH-Metern.
1536Die Sachverständige Dr. K hat die von ihr angebrachte Kritik nach drei Schwere-
1537graden unterteilt. Fehler des Schweregrades 1 (unkritisch) seien nicht zu verzeichnen. Sie habe zwei Fehler des Schweregrades 2 (weniger kritisch) und 30 Fehler des Schweregrades 3 (kritisch) bemerkt. Im Einzelnen:
1538Die Sachverständige Dr. K führte aus, dass es aus ihrer Sicht als Fehler eines
1539Grades 2 anzusehen sei, dass es bei einer Ablichtung eines Wiegeprotokolls an einem Copy-Stempel fehle, also an einem Stempel, der erkennen lasse, dass es sich bei dem fraglichen Dokument um eine Kopie handele.
1540Zudem habe sie einzelne Dokumentationsfehler erkannt: Bei Fehleintragungen oder Schreibfehlern sei aus ihrer Sicht eine unzutreffende Berichtigung erfolgt. So sei bei Schreibfehlern keine Angabe erfolgt, warum die Korrektur erfolgt sei, wann und durch wen. So sei z.B. bei einer ordnungsgemäßen Probe mit dem Wirkstoff Granisetron fehlerhaft die Bezeichnung als „Ganaisetron“ erfolgt. Allein die Korrektur des Wortes sei nicht ausreichend gewesen, es hätten die genannten Angaben zu Grund, Datum und Urheber gefehlt.
1541Weiterhin sei es aus ihrer Sicht als Fehler des Grades 3 zu qualifizieren, dass Messgeräte, deren Überprüfungsintervalle im Zeitpunkt der Prüfung überschritten gewesen seien, namentlich die Geräte „Kalle Blomqvist“ und „Einstein“, verwendet worden seien. Jedenfalls sei eine Freigabe des Gerätes zu dokumentieren. Auch hätten sog. Corrective and Preventive Actions (sog. CAPA) erfolgen müssen. Damit sind Maßnahmen zur Korrektur und Vorbeugung des Fehlers innerhalb eines Qualitätsmanage-mentsystems gemeint.
1542Weiter beanstandete die Sachverständige Dr. K , dass das Datum von Wägungen
1543vor dem eingetragenen Prüfungsbeginn liege. Aus ihrer Sicht sei der Beginn der Prü-
1544739
1545fungen die Wägung. Zudem seien verschiedenartige Formulare für die Wiegeproto-kolle verwendet worden, nur auf einem Formular werde das Datum abgefragt.
1546Bei einer Probe, die der Sachverständige Dr. G im Auftrag des Sachverständigen
1547L untersucht habe, sei weiterhin im schriftlichen Vorabgutachten des Sachver-
1548ständigen L eine Aufkonzentration der Probe angegeben, dies ergebe sich hin-
1549gegen nicht aus dem Prüfbericht des Sachverständigen Dr. G .
1550Beanstandet wurde von der Sachverständigen Dr. K als Fehler des Schweregra-
1551des 3 weiterhin, dass bei den verwendeten Pipetten nur eine externe Überprüfung vorgenommen, auf eine weitere interne Prüfung aber verzichtet werde. Die jährlichen Prüfungsintervalle von zwei der verwendeten Pipetten seien zudem zweimal um einen Monat überschritten worden.
1552Als weiterer Mangel des Schweregrades 3 wurde von der Sachverständigen Dr. K bemängelt, dass eine fortlaufende Dokumentation der Lagerung der Proben nicht vorliege: Es sei nicht dokumentiert, wann Proben zwecks Durchführung einer Messung oder Analyse vom Lagerort entnommen bzw. wieder zurückgeführt worden seien.
1553Zudem seien die für den Tag der Durchsuchung vermerkten Lagertemperaturen erst nachträglich mit einem Datum versehen worden, außerdem seien dabei Stifte verschiedener Farben verwendet worden. Auch sei die Inventarnummer eines Tempera-turloggers fehlerhaft bezeichnet („10359198“ statt „10359188“) .
1554Schließlich sei für eine Probe, die vom Sachverständigen Dr. G untersucht wurde,
1555bei der Abfassung des Vorabgutachtens durch den Sachverständigen Dr. L ein
1556zweiter Prüfbericht des PEI nicht beachtet worden.
1557Bewertung der Sachverständigen L und Dr. H
1558Die Kammer hat insoweit erneut den Sachverständigen L und ergänzend den
1559Sachverständigen und Zeugen Dr. H befragt, der als stellvertreten-der Leiter des LZG und Leiter des Fachbereiches 4 (Arzneimittel, Produkt- und Anwendungssicherheit), der auch die Arzneimitteluntersuchungsstelle umfasst, der Vorge-
1560setzte des Sachverständigen L ist.
1561Dr. H führte zunächst überzeugend aus, dass die angeblich fehlenden
1562Unterlagen vorhanden seien. Bei den Qualifizierungsunterlagen eines Messgerätes
1563740
1564handele es sich um systemübergreifende Unterlagen, die den übersandten Unterlagen nicht beigefügt worden seien. Die Unterlagen lägen aber im LZG vor. Sofern nur die aktuellste Qualifizierung übersandt worden sei, sei dies aber auch ausreichend, da das Bestehen des letzten Funktionstests den Rückschluss zulasse, dass auch die vorherigen Prüfungen ordnungsgemäß verlaufen seien.
1565Auch die Dokumentation der monatlichen Verifizierung der Waagen und die Daten der pH-Meter lägen vor, seien aber nicht übersendet worden. Daraus hätten sich keine Fehler der Waagen oder pH-Meter, die arbeitstäglich überprüft würden, ergeben. Seinen überzeugenden Ausführungen folgt die Kammer.
1566Zu den angeblich fehlenden Wiegeprotokollen ergab ein Hinweis des Sachverständi-
1567gen L auf deren Standort, dass sie von der Sachverständigen Dr. K in denUnterlagen übersehen worden waren. Sie hielt diesen Kritikpunkt nicht aufrecht.
1568Zu den monierten fehlenden Copy-Stempeln führte der Sachverständige L nach-
1569vollziehbar aus, dass auf einem Wiegeprotokoll mehrere Wägungen verzeichnet seien, das Originalprotokoll finde sich immer bei der Wägung zu der Probe mit der niedrigsten Nummer. Dass es sich bei den Unterlagen zu den anderen Proben um Ablichtungen des Wiegeprotokolls handele, sei erkennbar, ein Copy-Stempel sei insoweit auch nicht von der Qualitätssicherung des LZG gefordert. Diesen Ausführungen folgt die Kammer: Die Anbringung eines Copy-Stempels auf einer offensichtlich als Kopie einzustufenden Ablichtung ist nicht erforderlich.
1570Auch hinsichtlich der Monierung der fehlerhaften Korrektur von Einträgen und Zahlen
1571kann die Kammer den Ausführungen der Sachverständigen Dr. K nicht folgen. DerGrund der Korrektur ergibt sich aus der fehlerhaften Angabe. Die Angabe von Datum und Urheber ist entbehrlich.
1572Zu dem eingesetzten Messgerät, dessen Prüfungsintervall überschritten gewesen sei,
1573gab der Sachverständige Dr. H nachvollziehbar an, dass die Freigabe desGerätes durch ihn mündlich erfolgt sei. Die Überschreitung des Prüfungsintervalls sei unerheblich, da die folgende Systemüberprüfung und das Bestehen des Funktionstests den Rückschluss zuließen, dass auch die vorherigen Prüfungen ordnungsgemäß verlaufen sind. Diesen überzeugenden und nachvollziehbaren Ausführungen schließt sich die Kammer an. Insoweit ist es aus Sicht der Kammer auch unerheblich, dass die Freigabe nicht schriftlich dokumentiert wurde, da die Kammer jedenfalls überzeugt ist,
1574741
1575dass die Freigabe erfolgt ist.
1576Die Kammer schließt sich auch den weiteren Ausführungen des Sachverständigen
1577Dr. H an, dass es eines "CAPA" nicht bedurfte, da eine Abweichung oderein Fehler nicht bestehe, wenn die Vorgehensweise mit der Qualitätssicherung abgesprochen gewesen sei, wie es bei den Prüfungen erfolgt sei.
1578Hinsichtlich der Wägungen vor dem angegebenen Prüfungsbeginn folgt die Kammer den überzeugenden und nachvollziehbaren Ausführungen des Sachverständigen
1579L , dass er als Prüfungsbeginn den Tag der eigentlichen Analytik vermerkt habe.Die Wägung der Proben zur Nettogewichtsbestimmung habe er als Vorbereitungshandlung qualifiziert, dies habe auf die Analytik und Testergebnisse aber ohnehin keinen Einfluss. Dieser Einschätzung schließt sich die Kammer an.
1580Soweit die unterschiedlichen Wiegeprotokolle moniert würden, gaben die Sachver-
1581ständigen L und Dr. H übereinstimmend an, dass es für diesen Vor-gang keiner einheitlichen, sog. gelenkten, Dokumente bedürfe. Die Erstellung eines einheitlichen Formulars hätte einen erhöhten Zeitaufwand erfordert, der nicht zur Verfügung gestanden habe. Auch insoweit seien keine Auswirkungen auf die Analytik und die Testergebnisse denkbar. Auch dieser plausiblen Einschätzung schließt sich die Kammer an.
1582Hinsichtlich des Widerspruchs zwischen einem Vorabgutachten des LZG und dem
1583Prüfbericht des PEI räumte der Sachverständige L nachvollziehbar ein, dass derWiderspruch in der Darstellung zutreffend sei, dies aber keine Auswirkungen auf das Messergebnis habe. Maßgeblich sind insoweit ohnehin die überzeugenden Ausfüh-
1584rungen des Sachverständigen Dr. G in der Hauptverhandlung, der die Prüfungselbst durchgeführt hat (dazu sogleich). Auch die bemängelte Angabe einer Aufkonzentration, die sich nicht aus den Prüfberichten des PEI ergebe, räumte der
1585Sachverständige L nachvollziehbar als Fehler ein, der ihm unterlaufen sei.Auswirkungen auf das Analyseergebnis gingen damit nicht einher.
1586Hinsichtlich der nur externen Überprüfung von Pipetten führte der Sachverständige Dr.
1587H aus, dass die externen Untersuchungen ausreichend seien. Eine interneÜberprüfung von Pipetten sei weniger valide als die externe Überprüfung. Sofern eine Pipette nicht ordnungsgemäß arbeite, würde dies auffallen. Im Falle einer Beanstan-
1588742
1589dung bei einer externen Überprüfung, die hinsichtlich der für das vorliegende Verfahren verwendeten Pipetten ohnehin nicht erfolgt sei, würde eine Nachkontrolle erfolgen. Hinsichtlich der zweimaligen Überschreitung des Prüfungsintervalls von zwei der ver-
1590wendeten Pipetten führte der Sachverständige Dr. H aus, dass das nach-trägliche Bestehen der Überprüfung den Rückschluss zulasse, dass die Pipetten zuvor ordnungsgemäß gearbeitet hätten. Diesen überzeugenden und nachvollziehbaren Ausführungen folgt die Kammer.
1591Zur fehlenden Dokumentation von Einlagerung, Entnahme und Rückführung von Pro-
1592ben aus dem Kühlschrank führte der Sachverständige Dr. H aus, dass einesolche Dokumentation unüblich und nicht erforderlich sei. Diese Anforderung bestehe nur bei der Prüfung von Medikamenten im Zulassungsverfahren. Die Proben seien hier ordnungsgemäß erfasst und gekennzeichnet worden, zudem sei die Anweisung erfolgt, dass Entnahmen und Rückführungen nur in Anwesenheit des Sachverständigen
1593L erfolgen dürften. Damit sei eine Verwechslung oder unsachgemäße Handha-bung der Proben ausgeschlossen gewesen. Diesen überzeugenden Ausführungen folgt die Kammer.
1594Zur Dokumentation der Temperaturen beim Transport am 29.11.2016 von der Apo-
1595theke nach Münster gab der Sachverständige L nachvollziehbar an, dass erin der Apotheke einen Zettel verwendet habe, den er während der Fahrt nicht griffbereit gehabe habe. Aus diesem Grund habe er die Temperaturen während der Fahrt auf einem anderen Zettel notiert und zu einem späteren Zeitpunkt - mit einem anderen Stift mit anderer Farbe - umgetragen. Die Werte seien aber
1596zutreffend, wie der Sachverständige L ausführte. Zum fehlerhaft bezeichneten
1597Temperaturlogger räumte der Sachverständige L die fehlerhafte Bezeichnung
1598ein, erklärte dies aber nachvollziehbar damit, dass intern nur die Bezeichnung „Logger E“ verwendet werde, die Inventarnummer spiele keine Rolle, es existiere aber ohnehin kein Temperaturlogger mit der angegebenen Inventarnummer.
1599Zu dem bei einer Probe nicht beachteten zweiten Prüfbericht des Sachverständigen
1600Dr. G (Tat 61.887 der Anklage, dazu sogleich) gab der Sachverständige L nachvollziehbar an, dass er sein Gutachten bereits vor Eingang des zweiten Prüfberichtes, der auf den 13.03.2017 datiere, am 03.03.2017 abgefasst habe. Die Ergänzung seines vorab erstellten und übersandten Gutachtens habe er dann versäumt.
1601743
1602Würdigung der Ausführungen der Sachverständigen Dr. K
1603Die Gesamtheit der von der Sachverständigen Dr. K genannten Kritikpunkte kann
1604die Überzeugung der Kammer vom Gutachten des Sachverständigen L nicht im
1605![]() Ansatz erschüttern. Ein großer Teil der Kritikpunkte konnte von L und Dr. H ohnehin ausgeräumt werden; im Übrigen haben die echten oder vermeintlichen Fehler keine Auswirkungen auf die Ergebnisse der Untersuchungen des Sachverstän-
Ansatz erschüttern. Ein großer Teil der Kritikpunkte konnte von L und Dr. H ohnehin ausgeräumt werden; im Übrigen haben die echten oder vermeintlichen Fehler keine Auswirkungen auf die Ergebnisse der Untersuchungen des Sachverstän-
digen L .
1607Insbesondere hat die Sachverständige Dr. K keinerlei Einwände gegen die vom
1608Sachverständigen L genutzten Methoden und Arbeitsschritte vorgebracht. Ana-
1609lytik und Ergebnisse wurden von ihr nicht in Frage gestellt. Ihre Kritikpunkte beziehen sich auf Randfragen der Dokumentation und der Gewährleistung ordnungsgemäßer Arbeitsmittel. Im Rahmen der freien richterlichen Beweiswürdigung berücksichtigt die Kammer auch, dass sich die 32 (vermeintlichen) Fehler auf ein Material von 22 Stehordnern zu insgesamt 88 untersuchten Proben verteilen.
1610Ausführungen des Sachverständigen Prof. Dr. B
1611Prof. Dr. B ist ebenfalls Pharmazeut und war über viele Jahre Leiter des Zentral-
1612laboratoriums Deutscher Apotheker. Seit 1997 ist er Inhaber eines Unternehmens, das sich mit klinischen Prüfungen, dem Datenmanagement und der Auswertung klinischer Studien befasst. Mittlerweile ist er in diesem Unternehmen nur noch beratend tätig. Gegenstand seiner Beauftragung durch den Angeklagten sei nach seinen Angaben die Beurteilung der angewandten analytischen Methoden gewesen.
1613Nach den Ausführungen des Sachverständigen Prof. Dr. B seien die vom LZG
1614gewählten Methoden als grundsätzlich geeignet anzusehen. Die Dokumentation müsse sich nach seiner Ansicht an den Vorgaben der DIN-Norm 17025 ausrichten. Er führte aus, dass im Rahmen einer methodenkritischen Betrachtung sicherzustellen sei, dass alle durchgeführten Vorgänge und Prüfungen ordnungsgemäß - unter Anwendung der DIN 17025 - dokumentiert worden seien. Ob eine solche Dokumentation entsprechend der DIN-Norm 17025 vorliege, könne er aber nicht beantworten, die Unterlagen habe er nicht durchgesehen, die einzelnen Prüfungen habe er nicht nachvollzogen. Dies habe nicht seiner Beauftragung durch den Angeklagten entsprochen. Angaben zu den einzelnen Prüfungen könne er mithin nicht machen.
1615744
1616Diese Ausführungen des Sachverständigen Prof. Dr. B sind nicht geeignet, Zwei-
1617fel der Kammer an den überzeugenden Ausführungen und Ergebnissen des Sachver-
1618ständigen L zu begründen. Die DIN-Norm 17025 betrifft „Allgemeine Anforderun-gen an die Kompetenz von Prüf- und Kalibrierlaboratorien“, primärer Anwendungsbereich ist die Zulassung von Medikamenten, wie auch der Sachverständige Prof. B
1619angab. Der Sachverständige Dr. H gab insoweit an, dass die Vorgaben derDIN-Norm im LZG beachtet würden. Dass ein konkreter Verstoß gegen die Vorgaben
1620der DIN-Norm vorliegt, vermochte der Sachverständige Prof. B nicht zu belegen.
1621(4) Analyse des Sachverständigen Dr. G (Paul-Ehrlich-Institut)
1622Die Feststellungen zu den 28 Unterdosierungen bei den Taten 61.864 bis 61.890 sowie 61.892 der Anklage beruhen auf der plausiblen und in sich schlüssigen
1623Darstellung des Sachverständigen Dr. G , der als Zeuge ergänzende Informa-
1624tionen gegeben hat. Der Sachverständige Dr. G hat die Untersuchung der 29
1625parenteralen Arzneimittelzubereitungen übernommen, die als Wirkstoffe monoklonale Antikörper enthalten sollten. Davon waren 28 unterdosiert:
1626Qualifikation und Tätigkeit des Sachverständigen Dr. G
1627Der Sachverständige Dr. G war bis zu seinem Eintritt in den Ruhestand im Jahr
16282017 als Biochemiker im Paul-Ehrlich-Institut (im Folgenden: „PEI“) Fachgebietsleiter des Fachgebiets 3/1 (Produktprüfung immunologischer Arzneimittel). Das PEI ist das Bundesinstitut für Impfstoffe und biomedizinische Arzneimittel, dessen Aufgabe die Prüfung und Zulassung von Arzneimitteln ist, darunter insbesondere die Zulassung monoklonaler Antikörper. Dabei nimmt das PEI auch Aufgaben im Rahmen eines europaweiten Zulassungsverfahrens für die Europäische Arzneimittelbehörde wahr. In diesem Zusammenhang ist das Institut bei der Zulassung von Medikamenten auch mit Verfahren der Experimentalprüfung sowie der Prüfung auf Wirksamkeit und Identität von Arzneistoffen befasst. Das PEI ist akkreditiert für die Mehrzahl der durchgeführten Testverfahren (zu den Ausnahmen sogleich).
1629Prüfungen/Messverfahren des Sachverständigen Dr. G
1630745
1631Der Sachverständige Dr. G führte aus, dass die zu untersuchenden Proben dem
1632PEI am 01.12.2016 und die benötigen Referenzmaterialien am 06.12., 09.12., und 23.12.2016 überbracht worden seien. Alle Zubereitungen bzw. Wirkstoffe seien in Kühlgefäßen mit Temperaturloggern transportiert und sodann im PEI in temperaturüberwachten Kühlschränken gelagert worden.
1633Der Sachverständige Dr. G führte aus, dass er die folgenden Messmethoden an-
1634gewendet habe:
1635Bei allen Zubereitungen habe er zunächst eine Sichtkontrolle entsprechend den Vorgaben der Standard Operating Procedures (SOP) des PEI durchgeführt. Mit Ausnahme weniger kleiner „Fusseln“ in wenigen Infusionsbeuteln sei diese Kontrolle unauffällig verlaufen.
1636Proteinbestimmung bei 280 nm
1637Weiter führte der Sachverständige Dr. G aus, dass er die 29 Zubereitungen mit
1638monoklonalen Antikörpern zunächst mit der Methode der Proteinbestimmung bei 280 nm nach Vorgabe der Europäischen Pharmacopoeia 2.5.33. „Total Protein Methode 1“ untersucht habe, da es sich bei monoklonalen Antikörpern um Proteine handele. Die Methode selbst entstamme dem Europäischen Arzneibuch und sei für eine Vielzahl von Antikörpern, auch für die vorliegenden monoklonalen Antikörper, anwendbar. Die Akkreditierung des PEI umfasse eine ähnliche Methode des Europäischen Arzneibuches. Für die konkrete Anwendung der Methode liege eine Validierung des PEI vor. Die Beschreibung des Europäischen Arzneibuches sei für die Anwendung der Methode auch ausreichend. Der Umstand, dass die monoklonalen Antikörper als pa-renterale Arzneimittelzubereitungen untersucht würden, ändere nichts an den Vorgaben und erfordere auch nicht deren Konkretisierung, da es sich bei der Arzneimittelzubereitung nur um eine Verdünnung des Wirkstoffes handele. Eine weitergehende Arbeitsanweisung sei mithin entbehrlich.
1639Die Methode der Proteinbestimmung bei 280 nm sei eine photometrische Methode unter Verwendung von Ultraviolettstrahlung, bei der der Proteingehalt der Probe durch Vergleich mit einer Referenzsubstanz bei 280 nm (nm = Nanometer; dieser Wert bezeichnet die Wellenlänge der Strahlung) bestimmt werde. In das Photometer werde UV-Licht eingestrahlt; die Absorption durch die Wirkstoffe werde sodann gemessen.
1640746
1641Zu allen Proben erstellte der Sachverständige Dr. G - wie auch der Sachverstän-
1642dige L - Referenzproben, die die auf dem Herstellungsetikett der Apothekedeklarierte Menge an Wirkstoff enthielten. Dabei sei jeweils das Präparat verwendet worden, welches laut Herstellungsprotokoll bzw. Therapieinformation auch im Labor des Angeklagten zur Herstellung der jeweiligen Probe verwendet worden sei. Dass es sich dabei um die identische Charge zur Probe aus dem Labor des Angeklagten handele, sei nicht erforderlich. Auch die Erstellung von Stabilitätsvergleichsmustern sei
1643(anders als bei den Messmethoden des Sachverständigen L ) nicht erforderlichgewesen, da auch auf Fragmente/Bruchstücke und Polymere, die im Falle einer Instabilität erkennbar seien, untersucht worden sei.
1644Er habe die Werte der Referenzprobe und die bei deren Messung erzielten Ergebnisse verglichen mit den Ergebnissen der Proben aus dem Labor des Angeklagten. Anhand der ermittelten Werte sei ihm die Ermittlung der Wirkstoffmenge durch Umrechnung möglich gewesen.
1645Size exclusion chromatography
1646Zur weiteren Prüfung, ob die Proben Polymere oder Fragmente anderer Proteine aufwiesen, habe er dann die sensitive physikochemische Untersuchungsmethode der Größenausschlusschromatographie (engl. „size exclusion chromatography“, im Folgenden SEC) eingesetzt. Für diese und die nachfolgend beschriebenen Messverfahren sei eine Aufkonzentrierung der Proben erfolgt. Bei der SEC-Methode werde eine Säule, in der sich Kügelchen mit Löchern befinden, verwandt. Beim Durchlassen der Flüssigkeit würden die Moleküle aufgetrennt und am Ende der Säule durch einen Detektor gemessen. Der Vergleich mit einer Referenzprobe ermöglicht die Feststellung des Monomergehalts und des Vorhandenseins von Polymeren. Das Vorhandensein von Fragmenten oder Polymeren könne wiederum Rückschlüsse auf eine unsachgemäße Lagerung oder Zersetzung des Wirkstoffes liefern. Die Akkreditierung des PEI umfasse diese Methode.
1647SDS-Kapillarelektrophorese
1648Mit der SDS-Kapillarelektrophorese, mit der die Bewegung geladener Ionen in einem (meist flüssigen) Medium unter Einfluss eines elektrischen Feldes gemessen werde,
1649747
1650habe er eine dritte Messung durchgeführt. Dieses Verfahren ermögliche die Ge-winnung weiterer Informationen zur Molekulargewichtsverteilung, zum Mole-kulargewicht und zu den leichten und schweren Ketten monoklonaler Antikörper. Anhand der Wanderungsgeschwindigkeiten verschiedener Ionen, die abhängig sind von deren Ladung, Form und effektiver Größe sowie von der Lösungsumgebung und von der Stärke des elektrischen Feldes, werden die Moleküle nach ihrer Nettoladung aufgetrennt, so dass es zum Aufbau eines elektrischen Feldes kommt. Anhand der Position eines Moleküls werde die Bestimmung des Wirkstoffes wiederum anhand eines Vergleichs mit der Referenzprobe ermöglicht. Die Akkreditierung des PEI umfasse auch diese Methode.
1651Kapillarisoelektrische Fokussierung
1652Ergänzend habe er eine Prüfung der Identität der deklarierten monoklonalen Antikörper mittels kapillarisoelektrischer Fokussierung (im Folgenden cIEF) vorgenommen. Für diese Methode habe im Zeitpunkt der Durchführung noch keine Akkreditierung bestanden, diese sei mittlerweile aber erfolgt. Die Vorgaben an die Methode seien unverändert geblieben. Bei der Methode cIEF werde der Antikörper im pH-Gradienten untersucht, dies ermögliche auch eine Untersuchung der Feinstruktur des Präparates. Für Präparate entstünden spezifische Bandenmuster, die wiederum mit den Bandenmustern des Referenzmusters verglichen werden könnten.
1653Peptide-Mapping
1654Aufgrund des Umstandes, dass teilweise zwar anhand der Proteinbestimmungsme-thode ein Wirkstoffgehalt habe festgestellt werden können, die weiteren Testverfahren aber die Identität des Wirkstoffs von Referenzmuster und Probe aus dem Labor des Angeklagten nicht ergeben hätten, sei zudem die Methode des sog. Peptide-Mapping angewendet worden. Für diese Methode habe im Zeitpunkt der Durchführung ebenfalls noch keine Akkreditierung bestanden, diese sei mittlerweile aber erfolgt. Auch insoweit seien die Vorgaben an die Methode unverändert geblieben. Bei der Methode des Pep-tide-Mapping komme es zu einer Enzymverdauung des monoklonalen Antikörpers (Zerlegung). Über die entstehenden Aminosäuren entstehe wiederum ein typisches Muster, welches mittels eines Chromatographen eine Untersuchung ermögliche. Bei
1655748
1656einem Teil der Infusionsbeutel, in denen sich gemäß der Angaben auf dem Herstelleretikett des Angeklagten der Wirkstoff Trastuzumab (Handelsname: Herceptin) befinden sollte, habe die Prüfung allein die Existenz des Wirkstoffs Pertuzumab (Handelsname: Perjeta) in geringerer Dosis als deklariert ergeben. Auch bei Durchführung des weiteren Verfahrens der Flüssigchromatographie mit Massenspektrometrie-Kopplung (nano-LC-MS) , einer ähnlichen Methode, die auf dem enzymatischen Verdau und der dadurch bedingten Entstehung spezifischer Peptide aufbaue, habe die Prüfung zu einem Muster geführt, welches als Pertuzumab (Perjeta) und nicht Trastuzumab (Her-ceptin) identifiziert worden sei. Die beiden vorgenannten Testungen seien bei allen Infusionsbeuteln mit den deklarierten Wirkstoffen Pertuzumab und Trastuzumab durchgeführt worden.
1657Festlegung von Messunsicherheiten
1658Der Sachverständige Dr. G führte weiter aus, dass er jeweils für jede Prüfung der
1659quantitativen Methoden einen eigenen Wert der Messunsicherheit zugrunde gelegt habe. Bei der Proteinbestimmung liege die Messunsicherheit bei 10 % und bei der Molekulargewichtsverteilung bei um 1 %. Bei der SDS-Kapillarelektrophorese bedürfe es keiner Angabe einer Messunsicherheit, da es sich nicht um eine quantitative Methode handele.
1660Mitwirkung von Mitarbeitern
1661Weiter führte der Sachverständige Dr. G aus, dass er jeweils einen Prüfauftrag
1662erstellt habe, dessen Ausführung dann geschulten und erfahrenen Labormitarbeitern des PEI oblegen habe. Er sei aber bei Rückfragen stets ansprechbar gewesen. Es sei dann eine gemeinsame Auswertung und Besprechung der Ergebnisse erfolgt. Die Überprüfung der Ergebnisse habe allein ihm in seiner Funktion als Prüfleiter oblegen.
1663Ergänzende Berechnung des Sachverständigen L
1664Ergänzend zu den Untersuchungen im Paul-Ehrlich-Institut führte der Sachverständige
1665L überzeugend aus, dass er wirkstofffreie 0,9 % NaCI -Infusionsbeutel der Fa.
1666749
1667mit einem Nennvolumen von 250 ml hinsichtlich des tatsächlichen Füllvolumens untersucht habe. Hierbei habe sich gezeigt, dass die Infusionsbeutel tatsächlich ein um ca. 15,8 ml größeres Füllvolumen aufgewiesen hätten als in der Kenn-zeichnung als Nennvolumen (hier 250 ml) ausgewiesen sei. Dies habe er bei einer Nachberechnung des Wirkstoffgehaltes zugunsten des Angeklagten noch berücksichtigt. Der Sachverständige Dr. CM hat bei seiner Gutachtenerstattung auf diese neu berechneten Werte Bezug genommen (siehe sogleich).
1668Ergebnisse des Sachverständigen Dr. GM
1669Im Einzelnen hätten die Prüfungen - so der Sachverständige Dr. C. - anhand der vorgenannten Testverfahren zu den nachfolgend aufgeführten Ergebnissen geführt:
1670Im Rahmen der Feststellungen hat die Kammer zugunsten des Angeklagten die Ergebnisse unter Berücksichtigung des vom Sachverständigen M ermittelten erhöhten Füllvolumens der Infusionsbeutel zugrunde gelegt. Sofern ein anderer Wirkstoff verwendet wurde, als der auf dem Etikett deklarierte Wirkstoff, hat die Kammer einen Wirkstoffmindergehalt von 100 % zugrunde gelegt. Denn nach den Ausführungen des Sachverständigen Prof. ScIM waren die Wirkstoffe Trastuzumab und Pertuzumab wegen ihrer unterschiedlichen Wirkmechanismen innerhalb einer bestimmten ärztlich verordneten Therapie keinesfalls gegeneinander austauschbar.
1671Anklage |
PEI |
Patient |
Wirkstoff |
Ergebnis |
Bemerkungen |
![]()
![]()
![]()
![]()
![]() 750
750
![]()
![]()
![]()
![]()
![]() -
-
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() Im Einzelnen:
Im Einzelnen:
Tat 61.864 der Anklage:
1676Der Sachverständige Dr. CM führte aus, dass der Infusionsbeutel der Patientin nach der Deklaration des Etiketts einen Gehalt des Wirkstoffs Nivolumab von 282,00 mg in einer 0,9 %-igen NaCI-Trägerlösung ausgewiesen habe. Die Sichtkontrolle habe keine Auffälligkeiten ergeben. Anhand der Proteinbestimmungsmethode bei 280 nm habe sich ein Befund von 36,4 mg Wirkstoffgehalt ergeben, dies entspreche einem Wirkstoffmindergehalt von 87,1 % bei einer Messunsicherheit von 10 %. Bei Berücksichtigung des erhöhten Füllvolumens der Trägerlösungsbeutel ergebe sich nach den Angaben des Sachverständigen LM ein Wirkstoffgehalt von 38,0 mg und ein Wirkstoffmindergehalt von 86,5 %.
1677Die Prüfung der Molekulargewichtsverteilung anhand der Größenausschlusschroma-tographie (SEC) habe ergeben, dass keine bzw. nur wenige Polymere/Fragmente und keine anderen Proteine nachweisbar seien. Die Proteinzusammensetzung anhand der
1678751
1679SDS-Kapillarelektrophorese habe ergeben, dass es sich bei dem festgestellten Proteingehalt um den Wirkstoff Nivolumab gehandelt habe. Dieses Ergebnis habe sich auch durch das Bandenmuster, welches sich aus der Methode der kapillarisoelektro-phoretischen Fokussierung (ciEF) entstanden sei, bestätigt.
1680Tat 61.865 der Anklage:
1681Der Sachverständige Dr. G führte aus, dass der Infusionsbeutel der Patientin
1682nach der Deklaration des Etiketts einen Gehalt des Wirkstoffs Pertuzumab von 420,00 mg in einer 0,9 %-igen NaCl-Trägerlösung ausgewiesen habe. Die Sichtkontrolle habe keine Auffälligkeiten ergeben. Anhand der Proteinbestimmungsmethode bei 280 nm habe sich ein Befund von 48,6 mg Wirkstoffgehalt ergeben, dies entspreche einem Wirkstoffmindergehalt von 88,4 % bei einer Messunsicherheit von 10 %. Bei Berücksichtigung des erhöhten Füllvolumens der Trägerlösungsbeutel ergebe sich
1683nach den Angaben des Sachverständigen L ein Wirkstoffgehalt von 51,5 mg undein Wirkstoffmindergehalt von 87,7 %.
1684Die Prüfung der Molekulargewichtsverteilung anhand der Größenausschlusschroma-tographie (SEC) habe ergeben, dass keine bzw. nur wenige Polymere/Fragmente und keine anderen Proteine nachweisbar seien. Die Proteinzusammensetzung anhand der SDS-Kapillarelektrophorese habe ergeben, dass es sich bei dem festgestellten Proteingehalt um den Wirkstoff Pertuzumab gehandelt habe. Dieses Ergebnis habe sich auch durch das Bandenmuster, welches sich aus der Methode der kapillarisoelektro-phoretischen Fokussierung (ciEF) entstanden sei, bestätigt.
1685Tat 61.866 der Anklage:
1686Der Sachverständige Dr. G führte aus, dass der Infusionsbeutel der Patientin
1687nach der Deklaration des Etiketts einen Gehalt des Wirkstoffs Trastuzumab von 370,00 mg in einer 0,9 %-igen NaCl-Trägerlösung ausgewiesen habe. Die Sichtkontrolle habe keine Auffälligkeiten ergeben. Anhand der Proteinbestimmungsmethode bei 280 nm habe sich ein Befund von 45,5 mg Wirkstoffgehalt ergeben, dies entspreche einem Wirkstoffmindergehalt von 87,7 % bei einer Messunsicherheit von 10 %.
1688752
1689Die Prüfung der Molekulargewichtsverteilung anhand der Größenausschlusschroma-tographie (SEC) habe ergeben, dass keine bzw. nur wenige Polymere/Fragmente und keine anderen Proteine nachweisbar seien. Die Prüfung der Proteinzusammensetzung anhand der SDS-Kapillarelektrophorese habe hingegen ergeben, dass es sich bei dem festgestellten Proteingehalt nicht um den Wirkstoff Trastuzumab gehandelt habe. Die Probe aus dem Labor des Angeklagten und das Referenzmuster seien nicht vergleichbar: Unter reduzierenden Bedingungen liege die Immunglobulinbande etwas unterhalb der Referenzbande, die Bande der leichten Kette liege unter reduzierenden Bedingungen etwas oberhalb der Referenzbande und sei breiter als diese, zudem gebe es Unterschiede bei den detektierbaren Verunreinigungen. Dieses Ergebnis habe sich auch durch das Bandenmuster, welches aus der Methode der kapillarisoelektrophoretischen Fokussierung (ciEF) entstanden sei, bestätigt. Auch insoweit seien die Probe aus dem Labor des Angeklagten und das Referenzmuster nicht vergleichbar gewesen. Anhand der Methoden des Peptide-Mapping und des nano-LC-MS sei festgestellt worden, dass sich in dem Infusionsbeutel tatsächlich der Wirkstoff Pertuzumab in der gemessenen Menge befunden habe. Der deklarierte Wirkstoff Trastuzumab sei in der Probe aus dem Labor des Angeklagten nicht enthalten gewesen.
1690Tat 61.867 der Anklage:
1691Der Sachverständige Dr. G führte aus, dass der Infusionsbeutel der Patientin
1692![]() nach der Deklaration des Etiketts einen Gehalt des Wirkstoffs Trastuzumab von 504,00 mg in einer 0,9 %-igen NaCl-Trägerlösung ausgewiesen habe. Die Sichtkontrolle habe keine Auffälligkeiten ergeben. Anhand der Proteinbestimmungsme-thode bei 280 nm habe sich ein Befund von 52,1 mg Wirkstoffgehalt ergeben, dies entspreche einem Wirkstoffmindergehalt von 89,7 % bei einer Messunsicherheit von 10 %. Bei Berücksichtigung des erhöhten Füllvolumens der Trägerlösungsbeutel er-
nach der Deklaration des Etiketts einen Gehalt des Wirkstoffs Trastuzumab von 504,00 mg in einer 0,9 %-igen NaCl-Trägerlösung ausgewiesen habe. Die Sichtkontrolle habe keine Auffälligkeiten ergeben. Anhand der Proteinbestimmungsme-thode bei 280 nm habe sich ein Befund von 52,1 mg Wirkstoffgehalt ergeben, dies entspreche einem Wirkstoffmindergehalt von 89,7 % bei einer Messunsicherheit von 10 %. Bei Berücksichtigung des erhöhten Füllvolumens der Trägerlösungsbeutel er-
gebe sich nach den Angaben des Sachverständigen L ein Wirkstoffgehalt von55,1 mg und ein Wirkstoffmindergehalt von 89,1 %.
1694Die Prüfung der Molekulargewichtsverteilung anhand der Größenausschlusschroma-tographie (SEC) habe ergeben, dass keine bzw. nur wenige Polymere/Fragmente und keine anderen Proteine nachweisbar seien. Die Proteinzusammensetzung anhand der
1695753
1696SDS-Kapillarelektrophorese habe ergeben, dass es sich bei dem festgestellten Proteingehalt um den Wirkstoff Trastuzumab gehandelt habe. Dieses Ergebnis habe sich auch durch das Bandenmuster, welches sich aus der Methode der kapillarisoelektro-phoretischen Fokussierung (ciEF) entstanden sei, bestätigt.
1697Tat 61.868 der Anklage:
1698Der Sachverständige Dr. G führte aus, dass der Infusionsbeutel des Patienten
1699![]() nach der Deklaration des Etiketts einen Gehalt des Wirkstoffs Cetuximab von 500,00 mg in einer 0,9 %-igen NaCl-Trägerlösung ausgewiesen habe. Die Sichtkontrolle habe keine Auffälligkeiten ergeben. Anhand der Proteinbestimmungsmethode bei 280 nm habe sich ein Befund von 258,0 mg Wirkstoffgehalt ergeben, dies entspreche einem Wirkstoffmindergehalt von 48,4 % bei einer Messunsicherheit von 10 %. Bei Berücksichtigung des erhöhten Füllvolumens der Trägerlösungsbeutel ergebe sich
nach der Deklaration des Etiketts einen Gehalt des Wirkstoffs Cetuximab von 500,00 mg in einer 0,9 %-igen NaCl-Trägerlösung ausgewiesen habe. Die Sichtkontrolle habe keine Auffälligkeiten ergeben. Anhand der Proteinbestimmungsmethode bei 280 nm habe sich ein Befund von 258,0 mg Wirkstoffgehalt ergeben, dies entspreche einem Wirkstoffmindergehalt von 48,4 % bei einer Messunsicherheit von 10 %. Bei Berücksichtigung des erhöhten Füllvolumens der Trägerlösungsbeutel ergebe sich
nach den Angaben des Sachverständigen L ein Wirkstoffgehalt von 268,1 mgund ein Wirkstoffmindergehalt von 46,4 %.
1701Die Prüfung der Molekulargewichtsverteilung anhand der Größenausschlusschroma-tographie (SEC) habe ergeben, dass keine bzw. nur wenige Polymere/Fragmente und keine anderen Proteine nachweisbar seien. Die Proteinzusammensetzung anhand der SDS-Kapillarelektrophorese habe ergeben, dass es sich bei dem festgestellten Proteingehalt um den Wirkstoff Cetuximab gehandelt habe. Dieses Ergebnis habe sich auch durch das Bandenmuster, welches sich aus der Methode der kapillarisoelektro-phoretischen Fokussierung (ciEF) entstanden sei, bestätigt.
1702Tat 61.869 der Anklage:
1703Der Sachverständige Dr. G führte aus, dass der Infusionsbeutel der Patientin
1704![]() nach der Deklaration des Etiketts einen Gehalt des Wirkstoffs Trastuzumab von 456,00 mg in einer 0,9 %-igen NaCl-Trägerlösung ausgewiesen habe. Die Sichtkontrolle habe wenige kleine Fusseln ergeben. Anhand der Proteinbestimmungsmethode bei 280 nm habe sich ein Befund von 29,9 mg Wirkstoffgehalt ergeben, dies entspreche einem Wirkstoffmindergehalt von 93,4 % bei einer Messunsicherheit von 10 %. Bei Berücksichtigung des erhöhten Füllvolumens der Trägerlösungsbeutel ergebe sich
nach der Deklaration des Etiketts einen Gehalt des Wirkstoffs Trastuzumab von 456,00 mg in einer 0,9 %-igen NaCl-Trägerlösung ausgewiesen habe. Die Sichtkontrolle habe wenige kleine Fusseln ergeben. Anhand der Proteinbestimmungsmethode bei 280 nm habe sich ein Befund von 29,9 mg Wirkstoffgehalt ergeben, dies entspreche einem Wirkstoffmindergehalt von 93,4 % bei einer Messunsicherheit von 10 %. Bei Berücksichtigung des erhöhten Füllvolumens der Trägerlösungsbeutel ergebe sich
754
1706nach den Angaben des Sachverständigen L ein Wirkstoffgehalt von 31,6 mg und
1707ein Wirkstoffmindergehalt von 93,1 %.
1708Die Prüfung der Molekulargewichtsverteilung anhand der Größenausschlusschroma-tographie (SEC) habe ergeben, dass keine bzw. nur wenige Polymere/Fragmente und keine anderen Proteine nachweisbar seien. Die Proteinzusammensetzung anhand der SDS-Kapillarelektrophorese habe ergeben, dass es sich bei dem festgestellten Proteingehalt um den Wirkstoff Trastuzumab gehandelt habe. Dieses Ergebnis habe sich auch durch das Bandenmuster, welches sich aus der Methode der kapillarisoelektro-phoretischen Fokussierung (ciEF) entstanden sei, bestätigt.
1709Tat 61.870 der Anklage:
1710Der Sachverständige Dr. G führte aus, dass der Infusionsbeutel des Patienten
1711![]() nach der Deklaration des Etiketts einen Gehalt des Wirkstoffs Nivolumab von 276,00 mg in einer 0,9 %-igen NaCl-Trägerlösung ausgewiesen habe. Die Sichtkontrolle habe keine Auffälligkeiten ergeben. Anhand der Proteinbestimmungsme-thode bei 280 nm habe sich ein Befund von 42,2 mg Wirkstoffgehalt ergeben, dies entspreche einem Wirkstoffmindergehalt von 84,7 % bei einer Messunsicherheit von 10 %. Bei Berücksichtigung des erhöhten Füllvolumens der Trägerlösungsbeutel er-
nach der Deklaration des Etiketts einen Gehalt des Wirkstoffs Nivolumab von 276,00 mg in einer 0,9 %-igen NaCl-Trägerlösung ausgewiesen habe. Die Sichtkontrolle habe keine Auffälligkeiten ergeben. Anhand der Proteinbestimmungsme-thode bei 280 nm habe sich ein Befund von 42,2 mg Wirkstoffgehalt ergeben, dies entspreche einem Wirkstoffmindergehalt von 84,7 % bei einer Messunsicherheit von 10 %. Bei Berücksichtigung des erhöhten Füllvolumens der Trägerlösungsbeutel er-
gebe sich nach den Angaben des Sachverständigen L ein Wirkstoffgehalt von44,1 mg und ein Wirkstoffmindergehalt von 84,0 %.
1713Die Prüfung der Molekulargewichtsverteilung anhand der Größenausschlusschroma-tographie (SEC) habe ergeben, dass keine bzw. nur wenige Polymere/Fragmente und keine anderen Proteine nachweisbar seien. Die Proteinzusammensetzung anhand der SDS-Kapillarelektrophorese habe ergeben, dass es sich bei dem festgestellten Proteingehalt um den Wirkstoff Nivolumab gehandelt habe. Dieses Ergebnis habe sich auch durch das Bandenmuster, welches sich aus der Methode der kapillarisoelektro-phoretischen Fokussierung (ciEF) entstanden sei, bestätigt.
1714Tat 61.871 der Anklage:
1715Der Sachverständige Dr. G führte aus, dass der Infusionsbeutel des Patienten
1716![]() nach der Deklaration des Etiketts einen Gehalt des Wirkstoffs Ramucirumab
nach der Deklaration des Etiketts einen Gehalt des Wirkstoffs Ramucirumab
755
1718von 600,00 mg in einer 0,9 %-igen NaCl-Trägerlösung ausgewiesen habe. Die Sichtkontrolle habe keine Auffälligkeiten ergeben. Anhand der Proteinbestimmungsme-thode bei 280 nm habe sich ein Befund von 88,5 mg Wirkstoffgehalt ergeben, dies entspreche einem Wirkstoffmindergehalt von 85,2 % bei einer Messunsicherheit von 10 %. Bei Berücksichtigung des erhöhten Füllvolumens der Trägerlösungsbeutel er-
1719gebe sich nach den Angaben des Sachverständigen L ein Wirkstoffgehalt von93,0 mg und ein Wirkstoffmindergehalt von 84,5 %.
1720Die Prüfung der Molekulargewichtsverteilung anhand der Größenausschlusschroma-tographie (SEC) habe ergeben, dass keine bzw. nur wenige Polymere/Fragmente und keine anderen Proteine nachweisbar seien. Die Proteinzusammensetzung anhand der SDS-Kapillarelektrophorese habe ergeben, dass es sich bei dem festgestellten Proteingehalt um den Wirkstoff Ramucirumab gehandelt habe. Dieses Ergebnis habe sich auch durch das Bandenmuster, welches sich aus der Methode der kapillarisoelektro-phoretischen Fokussierung (ciEF) entstanden sei, bestätigt.
1721Tat 61.872 der Anklage:
1722Der Sachverständige Dr. G führte aus, dass der Infusionsbeutel der Patientin
1723![]() nach der Deklaration des Etiketts einen Gehalt des Wirkstoffs Daratu-mumab von 1.025,00 mg in einer 0,9 %-igen NaCl-Trägerlösung ausgewiesen habe. Die Sichtkontrolle habe keine Auffälligkeiten ergeben. Anhand der Proteinbestim-mungsmethode bei 280 nm habe sich ein Befund von 334,6 mg Wirkstoffgehalt ergeben, dies entspreche einem Wirkstoffmindergehalt von 67,4 % bei einer Messunsicherheit von 10 %. Bei Berücksichtigung des erhöhten Füllvolumens der Trägerlösungs-
nach der Deklaration des Etiketts einen Gehalt des Wirkstoffs Daratu-mumab von 1.025,00 mg in einer 0,9 %-igen NaCl-Trägerlösung ausgewiesen habe. Die Sichtkontrolle habe keine Auffälligkeiten ergeben. Anhand der Proteinbestim-mungsmethode bei 280 nm habe sich ein Befund von 334,6 mg Wirkstoffgehalt ergeben, dies entspreche einem Wirkstoffmindergehalt von 67,4 % bei einer Messunsicherheit von 10 %. Bei Berücksichtigung des erhöhten Füllvolumens der Trägerlösungs-
beutel ergebe sich nach den Angaben des Sachverständigen L ein Wirkstoffge-halt von 348,8 mg und ein Wirkstoffmindergehalt von 66,0 %.
1725Die Prüfung der Molekulargewichtsverteilung anhand der Größenausschlusschroma-tographie (SEC) habe ergeben, dass keine bzw. nur wenige Polymere/Fragmente und keine anderen Proteine nachweisbar seien. Die Proteinzusammensetzung anhand der SDS-Kapillarelektrophorese habe ergeben, dass es sich bei dem festgestellten Proteingehalt um den Wirkstoff Daratumumab gehandelt habe. Dieses Ergebnis habe sich auch durch das Bandenmuster, welches sich aus der Methode der kapillarisoelektro-phoretischen Fokussierung (ciEF) entstanden sei, bestätigt.
1726756
1727Tat 61.873 der Anklage:
1728Der Sachverständige Dr. G führte aus, dass der Infusionsbeutel der Patientin
1729![]() nach der Deklaration des Etiketts einen Gehalt des Wirkstoffs Bevacizumab von 730,00 mg in einer 0,9 %-igen NaCl-Trägerlösung ausgewiesen habe. Die Sichtkontrolle habe keine Auffälligkeiten ergeben. Anhand der Proteinbestimmungsmethode bei 280 nm habe sich ein Befund von 24,0 mg Wirkstoffgehalt ergeben, dies entspreche einem Wirkstoffmindergehalt von 96,7 % bei einer Messunsicherheit von 10 %. Bei Berücksichtigung des erhöhten Füllvolumens der Trägerlösungsbeutel ergebe sich
nach der Deklaration des Etiketts einen Gehalt des Wirkstoffs Bevacizumab von 730,00 mg in einer 0,9 %-igen NaCl-Trägerlösung ausgewiesen habe. Die Sichtkontrolle habe keine Auffälligkeiten ergeben. Anhand der Proteinbestimmungsmethode bei 280 nm habe sich ein Befund von 24,0 mg Wirkstoffgehalt ergeben, dies entspreche einem Wirkstoffmindergehalt von 96,7 % bei einer Messunsicherheit von 10 %. Bei Berücksichtigung des erhöhten Füllvolumens der Trägerlösungsbeutel ergebe sich
nach den Angaben des Sachverständigen L ein Wirkstoffgehalt von 25,4 mg undein Wirkstoffmindergehalt von 96,5 %.
1731Die Prüfung der Molekulargewichtsverteilung anhand der Größenausschlusschroma-tographie (SEC) habe ergeben, dass keine bzw. nur wenige Polymere/Fragmente und keine anderen Proteine nachweisbar seien. Die Proteinzusammensetzung anhand der SDS-Kapillarelektrophorese habe ergeben, dass es sich bei dem festgestellten Proteingehalt um den Wirkstoff Bevacizumab gehandelt habe. Dieses Ergebnis habe sich auch durch das Bandenmuster, welches sich aus der Methode der kapillarisoelektro-phoretischen Fokussierung (ciEF) entstanden sei, bestätigt.
1732Tat 61.874 der Anklage:
1733Der Sachverständige Dr. G führte aus, dass der Infusionsbeutel des Patienten
1734![]() nach der Deklaration des Etiketts einen Gehalt des Wirkstoffs Bevacizumab von 430,00 mg in einer 0,9 %-igen NaCl-Trägerlösung ausgewiesen habe. Die Sichtkontrolle habe keine Auffälligkeiten ergeben. Anhand der Proteinbestimmungsme-thode bei 280 nm habe sich ein Befund von 42,8 mg Wirkstoffgehalt ergeben, dies entspreche einem Wirkstoffmindergehalt von 90,1 % bei einer Messunsicherheit von 10 %. Bei Berücksichtigung des erhöhten Füllvolumens der Trägerlösungsbeutel er-
nach der Deklaration des Etiketts einen Gehalt des Wirkstoffs Bevacizumab von 430,00 mg in einer 0,9 %-igen NaCl-Trägerlösung ausgewiesen habe. Die Sichtkontrolle habe keine Auffälligkeiten ergeben. Anhand der Proteinbestimmungsme-thode bei 280 nm habe sich ein Befund von 42,8 mg Wirkstoffgehalt ergeben, dies entspreche einem Wirkstoffmindergehalt von 90,1 % bei einer Messunsicherheit von 10 %. Bei Berücksichtigung des erhöhten Füllvolumens der Trägerlösungsbeutel er-
gebe sich nach den Angaben des Sachverständigen L ein Wirkstoffgehalt von45,3 mg und ein Wirkstoffmindergehalt von 89,5 %.
1736Die Prüfung der Molekulargewichtsverteilung anhand der Größenausschlusschroma-tographie (SEC) habe ergeben, dass keine bzw. nur wenige Polymere/Fragmente und
1737757
1738keine anderen Proteine nachweisbar seien. Die Proteinzusammensetzung anhand der SDS-Kapillarelektrophorese habe ergeben, dass es sich bei dem festgestellten Proteingehalt um den Wirkstoff Bevacizumab gehandelt habe. Dieses Ergebnis habe sich auch durch das Bandenmuster, welches sich aus der Methode der kapillarisoelektro-phoretischen Fokussierung (ciEF) entstanden sei, bestätigt.
1739Tat 61.875 der Anklage:
1740![]() Der Sachverständige Dr. G führte aus, dass die Injektionsspritze der Patientin nach der Deklaration des Etiketts einen Gehalt des Wirkstoffs Denosumab von 120,00 mg ausgewiesen habe. Die Sichtkontrolle habe keine Auffälligkeiten ergeben. Anhand der Proteinbestimmungsmethode bei 280 nm habe sich kein Befund mit einem Wirkstoffgehalt ergeben, dies bei einer Nachweisgrenze von < 0,04 mg. Dies entspreche einem Wirkstoffmindergehalt von mindestens 99,9 % bei einer Messunsicherheit von 10 %. Wegen der geringen Probenmenge von 1,7 ml hätten keine weiteren Untersuchungen durchgeführt werden können.
Der Sachverständige Dr. G führte aus, dass die Injektionsspritze der Patientin nach der Deklaration des Etiketts einen Gehalt des Wirkstoffs Denosumab von 120,00 mg ausgewiesen habe. Die Sichtkontrolle habe keine Auffälligkeiten ergeben. Anhand der Proteinbestimmungsmethode bei 280 nm habe sich kein Befund mit einem Wirkstoffgehalt ergeben, dies bei einer Nachweisgrenze von < 0,04 mg. Dies entspreche einem Wirkstoffmindergehalt von mindestens 99,9 % bei einer Messunsicherheit von 10 %. Wegen der geringen Probenmenge von 1,7 ml hätten keine weiteren Untersuchungen durchgeführt werden können.
Tat 61.876 der Anklage:
1742Der Sachverständige Dr. G führte aus, dass der Infusionsbeutel der Patientin
1743![]() nach der Deklaration des Etiketts einen Gehalt des Wirkstoffs Trastuzumab von 336,00 mg in einer 0,9 %-igen NaCl-Trägerlösung ausgewiesen habe. Die Sichtkontrolle habe keine Auffälligkeiten ergeben. Anhand der Proteinbestimmungsmethode bei 280 nm habe sich ein Befund von 95,8 mg Wirkstoffgehalt ergeben, dies entspreche einem Wirkstoffmindergehalt von 71,5 % bei einer Messunsicherheit von 10 %.
nach der Deklaration des Etiketts einen Gehalt des Wirkstoffs Trastuzumab von 336,00 mg in einer 0,9 %-igen NaCl-Trägerlösung ausgewiesen habe. Die Sichtkontrolle habe keine Auffälligkeiten ergeben. Anhand der Proteinbestimmungsmethode bei 280 nm habe sich ein Befund von 95,8 mg Wirkstoffgehalt ergeben, dies entspreche einem Wirkstoffmindergehalt von 71,5 % bei einer Messunsicherheit von 10 %.
Die Prüfung der Molekulargewichtsverteilung anhand der Größenausschlusschroma-tographie (SEC) habe ergeben, dass keine bzw. nur wenige Polymere/Fragmente und keine anderen Proteine nachweisbar seien. Die Prüfung der Proteinzusammensetzung anhand der SDS-Kapillarelektrophorese habe hingegen ergeben, dass es sich bei dem festgestellten Proteingehalt nicht um den Wirkstoff Trastuzumab gehandelt habe. Die Probe aus dem Labor des Angeklagten und das Referenzmuster seien nicht vergleichbar: Unter reduzierenden Bedingungen liege die Immunglobulinbande etwas unterhalb
1745758
1746der Referenzbande, die Bande der leichten Kette liege unter reduzierenden Bedingungen etwas oberhalb der Referenzbande und sei breiter als diese, zudem gebe es Unterschiede bei den detektierbaren Verunreinigungen. Dieses Ergebnis habe sich auch durch das Bandenmuster, welches aus der Methode der kapillarisoelektrophoretischen Fokussierung (ciEF) entstanden sei, bestätigt. Auch insoweit seien die Probe aus dem Labor des Angeklagten und das Referenzmuster nicht vergleichbar gewesen. Anhand der Methoden des Peptide-Mapping und des nano-LC-MS sei sodann festgestellt worden, dass sich in dem Infusionsbeutel tatsächlich der Wirkstoff Pertuzumab in der gemessenen Menge befunden habe. Der deklarierte Wirkstoff Trastuzumab sei in der Probe aus dem Labor des Angeklagten nicht enthalten gewesen.
1747Tat 61.877 der Anklage:
1748Der Sachverständige Dr. G führte aus, dass der Infusionsbeutel der Patientin
1749![]() nach der Deklaration des Etiketts einen Gehalt des Wirkstoffs Pertuzumab von 420,00 mg in einer 0,9 %-igen NaCl-Trägerlösung ausgewiesen habe. Die Sichtkontrolle habe keine Auffälligkeiten ergeben. Anhand der Proteinbestimmungsmethode bei 280 nm habe sich ein Befund von 21,1 mg Wirkstoffgehalt ergeben, dies entspreche einem Wirkstoffmindergehalt von 95,0 % bei einer Messunsicherheit von 10 %. Bei Berücksichtigung des erhöhten Füllvolumens der Trägerlösungsbeutel ergebe sich
nach der Deklaration des Etiketts einen Gehalt des Wirkstoffs Pertuzumab von 420,00 mg in einer 0,9 %-igen NaCl-Trägerlösung ausgewiesen habe. Die Sichtkontrolle habe keine Auffälligkeiten ergeben. Anhand der Proteinbestimmungsmethode bei 280 nm habe sich ein Befund von 21,1 mg Wirkstoffgehalt ergeben, dies entspreche einem Wirkstoffmindergehalt von 95,0 % bei einer Messunsicherheit von 10 %. Bei Berücksichtigung des erhöhten Füllvolumens der Trägerlösungsbeutel ergebe sich
nach den Angaben des Sachverständigen L ein Wirkstoffgehalt von 22,4 mg undein Wirkstoffmindergehalt von 94,7 %.
1751Die Prüfung der Molekulargewichtsverteilung anhand der Größenausschlusschroma-tographie (SEC) habe ergeben, dass keine bzw. nur wenige Polymere/Fragmente und keine anderen Proteine nachweisbar seien. Die Proteinzusammensetzung anhand der SDS-Kapillarelektrophorese habe ergeben, dass es sich bei dem festgestellten Proteingehalt um den Wirkstoff Pertuzumab gehandelt habe. Dieses Ergebnis habe sich auch durch das Bandenmuster, welches sich aus der Methode der kapillarisoelektro-phoretischen Fokussierung (ciEF) entstanden sei, bestätigt.
1752Tat 61.878 der Anklage:
1753759
1754![]()
![]() Der Sachverständige Dr. G führte aus, dass der Infusionsbeutel der Patientin nach der Deklaration des Etiketts einen Gehalt des Wirkstoffs Bevacizumab von 1.095,00 mg in einer 0,9 %-igen NaCl-Trägerlösung ausgewiesen habe. Die Sichtkontrolle habe keine Auffälligkeiten ergeben. Anhand der Proteinbestimmungsmethode bei 280 nm habe sich ein Befund von 85,5 mg Wirkstoffgehalt ergeben, dies entspreche einem Wirkstoffmindergehalt von 92,2 % bei einer Messunsicherheit von 10 %. Bei Berücksichtigung des erhöhten Füllvolumens der Trägerlösungsbeutel ergebe sich
Der Sachverständige Dr. G führte aus, dass der Infusionsbeutel der Patientin nach der Deklaration des Etiketts einen Gehalt des Wirkstoffs Bevacizumab von 1.095,00 mg in einer 0,9 %-igen NaCl-Trägerlösung ausgewiesen habe. Die Sichtkontrolle habe keine Auffälligkeiten ergeben. Anhand der Proteinbestimmungsmethode bei 280 nm habe sich ein Befund von 85,5 mg Wirkstoffgehalt ergeben, dies entspreche einem Wirkstoffmindergehalt von 92,2 % bei einer Messunsicherheit von 10 %. Bei Berücksichtigung des erhöhten Füllvolumens der Trägerlösungsbeutel ergebe sich
nach den Angaben des Sachverständigen L ein Wirkstoffgehalt von 90,1 mg undein Wirkstoffmindergehalt von 91,8 %.
1756Die Prüfung der Molekulargewichtsverteilung anhand der Größenausschlusschroma-tographie (SEC) habe ergeben, dass keine bzw. nur wenige Polymere/Fragmente und keine anderen Proteine nachweisbar seien. Die Proteinzusammensetzung anhand der SDS-Kapillarelektrophorese habe ergeben, dass es sich bei dem festgestellten Proteingehalt um den Wirkstoff Bevacizumab gehandelt habe. Dieses Ergebnis habe sich auch durch das Bandenmuster, welches sich aus der Methode der kapillarisoelektro-phoretischen Fokussierung (ciEF) entstanden sei, bestätigt.
1757Tat 61.879 der Anklage:
1758Der Sachverständige Dr. G führte aus, dass der Infusionsbeutel der Patientin
1759![]() nach der Deklaration des Etiketts einen Gehalt des Wirkstoffs Trastuzu-mab Emtansine von 201,60 mg in einer 0,9 %-igen NaCl-Trägerlösung ausgewiesen habe. Die Sichtkontrolle habe keine Auffälligkeiten ergeben. Anhand der Proteinbe-stimmungsmethode bei 280 nm habe sich ein Befund von 158,6 mg Wirkstoffgehalt ergeben, dies entspreche einem Wirkstoffmindergehalt von 21,3 % bei einer Messunsicherheit von 10 %. Bei Berücksichtigung des erhöhten Füllvolumens der Trägerlö-
nach der Deklaration des Etiketts einen Gehalt des Wirkstoffs Trastuzu-mab Emtansine von 201,60 mg in einer 0,9 %-igen NaCl-Trägerlösung ausgewiesen habe. Die Sichtkontrolle habe keine Auffälligkeiten ergeben. Anhand der Proteinbe-stimmungsmethode bei 280 nm habe sich ein Befund von 158,6 mg Wirkstoffgehalt ergeben, dies entspreche einem Wirkstoffmindergehalt von 21,3 % bei einer Messunsicherheit von 10 %. Bei Berücksichtigung des erhöhten Füllvolumens der Trägerlö-
sungsbeutel ergebe sich nach den Angaben des Sachverständigen L ein Wirk-stoffgehalt von 168,2 mg und ein Wirkstoffmindergehalt von 16,6 %.
1761Die Prüfung der Molekulargewichtsverteilung anhand der Größenausschlusschroma-tographie (SEC) habe ergeben, dass keine bzw. nur wenige Polymere/Fragmente und keine anderen Proteine nachweisbar seien. Die Proteinzusammensetzung anhand der SDS-Kapillarelektrophorese habe ergeben, dass es sich bei dem festgestellten Proteingehalt um den Wirkstoff Trastuzumab Emtansine gehandelt habe. Dieses Ergebnis
1762760
1763habe sich auch durch das Bandenmuster, welches sich aus der Methode der kapilla-risoelektrophoretischen Fokussierung (ciEF) entstanden sei, bestätigt.
1764Tat 61.880 der Anklage:
1765Der Sachverständige Dr. G führte aus, dass der Infusionsbeutel der Patientin
1766![]() nach der Deklaration des Etiketts einen Gehalt des Wirkstoffs Trastu-zumab von 498,00 mg in einer 0,9 %-igen NaCl-Trägerlösung ausgewiesen habe. Die Sichtkontrolle habe keine Auffälligkeiten ergeben. Anhand der Proteinbestimmungs-methode bei 280 nm habe sich ein Befund von 21,9 mg Wirkstoffgehalt ergeben, dies entspreche einem Wirkstoffmindergehalt von 95,6 % bei einer Messunsicherheit von 10 %. Bei Berücksichtigung des erhöhten Füllvolumens der Trägerlösungsbeutel er-
nach der Deklaration des Etiketts einen Gehalt des Wirkstoffs Trastu-zumab von 498,00 mg in einer 0,9 %-igen NaCl-Trägerlösung ausgewiesen habe. Die Sichtkontrolle habe keine Auffälligkeiten ergeben. Anhand der Proteinbestimmungs-methode bei 280 nm habe sich ein Befund von 21,9 mg Wirkstoffgehalt ergeben, dies entspreche einem Wirkstoffmindergehalt von 95,6 % bei einer Messunsicherheit von 10 %. Bei Berücksichtigung des erhöhten Füllvolumens der Trägerlösungsbeutel er-
gebe sich nach den Angaben des Sachverständigen L ein Wirkstoffgehalt von23,2 mg und ein Wirkstoffmindergehalt von 95,3 %.
1768Die Prüfung der Molekulargewichtsverteilung anhand der Größenausschlusschroma-tographie (SEC) habe ergeben, dass keine bzw. nur wenige Polymere/Fragmente und keine anderen Proteine nachweisbar seien. Die Proteinzusammensetzung anhand der SDS-Kapillarelektrophorese habe ergeben, dass es sich bei dem festgestellten Proteingehalt um den Wirkstoff Trastuzumab gehandelt habe. Dieses Ergebnis habe sich auch durch das Bandenmuster, welches sich aus der Methode der kapillarisoelektro-phoretischen Fokussierung (ciEF) entstanden sei, bestätigt.
1769Tat 61.881 der Anklage:
1770Der Sachverständige Dr. G führte aus, dass der Infusionsbeutel der Patientin
1771![]() nach der Deklaration des Etiketts einen Gehalt des Wirkstoffs Trastuzumab von 490,00 mg in einer 0,9 %-igen NaCl-Trägerlösung ausgewiesen habe. Die Sichtkontrolle habe mit Ausnahme weniger kleiner Fussel keine Auffälligkeiten ergeben. Anhand der Proteinbestimmungsmethode bei 280 nm habe sich ein Befund von 24,6 mg Wirkstoffgehalt ergeben, dies entspreche einem Wirkstoffmindergehalt von 95,0 % bei einer Messunsicherheit von 10 %. Bei Berücksichtigung des erhöhten Füll-
nach der Deklaration des Etiketts einen Gehalt des Wirkstoffs Trastuzumab von 490,00 mg in einer 0,9 %-igen NaCl-Trägerlösung ausgewiesen habe. Die Sichtkontrolle habe mit Ausnahme weniger kleiner Fussel keine Auffälligkeiten ergeben. Anhand der Proteinbestimmungsmethode bei 280 nm habe sich ein Befund von 24,6 mg Wirkstoffgehalt ergeben, dies entspreche einem Wirkstoffmindergehalt von 95,0 % bei einer Messunsicherheit von 10 %. Bei Berücksichtigung des erhöhten Füll-
761
1773volumens der Trägerlösungsbeutel ergebe sich nach den Angaben des Sachverstän-
1774digen L ein Wirkstoffgehalt von 26,0 mg und ein Wirkstoffmindergehalt von94,7 %.
1775Die Prüfung der Molekulargewichtsverteilung anhand der Größenausschlusschroma-tographie (SEC) habe ergeben, dass keine bzw. nur wenige Polymere/Fragmente und keine anderen Proteine nachweisbar seien. Die Proteinzusammensetzung anhand der SDS-Kapillarelektrophorese habe ergeben, dass es sich bei dem festgestellten Proteingehalt um den Wirkstoff Trastuzumab gehandelt habe. Dieses Ergebnis habe sich auch durch das Bandenmuster, welches sich aus der Methode der kapillarisoelektro-phoretischen Fokussierung (ciEF) entstanden sei, bestätigt.
1776Tat 61.882 der Anklage
1777Der Sachverständige Dr. G führte aus, dass der Infusionsbeutel der Patientin
1778![]() nach der Deklaration des Etiketts einen Gehalt des Wirkstoffs Trastuzu-mab von 300,00 mg in einer 0,9 %-igen NaCl-Trägerlösung ausgewiesen habe. Die Sichtkontrolle habe keine Auffälligkeiten ergeben. Anhand der Proteinbestimmungs-methode bei 280 nm habe sich ein Befund von 55,5 mg Wirkstoffgehalt ergeben, dies entspreche einem Wirkstoffmindergehalt von 81,5 % bei einer Messunsicherheit von 10 %.
nach der Deklaration des Etiketts einen Gehalt des Wirkstoffs Trastuzu-mab von 300,00 mg in einer 0,9 %-igen NaCl-Trägerlösung ausgewiesen habe. Die Sichtkontrolle habe keine Auffälligkeiten ergeben. Anhand der Proteinbestimmungs-methode bei 280 nm habe sich ein Befund von 55,5 mg Wirkstoffgehalt ergeben, dies entspreche einem Wirkstoffmindergehalt von 81,5 % bei einer Messunsicherheit von 10 %.
Die Prüfung der Molekulargewichtsverteilung anhand der Größenausschlusschroma-tographie (SEC) habe ergeben, dass keine bzw. nur wenige Polymere/Fragmente und keine anderen Proteine nachweisbar seien. Die Prüfung der Proteinzusammensetzung anhand der SDS-Kapillarelektrophorese habe hingegen ergeben, dass es sich bei dem festgestellten Proteingehalt nicht um den Wirkstoff Trastuzumab gehandelt habe. Die Probe aus dem Labor des Angeklagten und das Referenzmuster seien nicht vergleichbar: unter reduzierenden Bedingungen liege die Immunglobulinbande etwas unterhalb der Referenzbande, die Bande der leichten Kette liege unter reduzierenden Bedingungen etwas oberhalb der Referenzbande und sei breiter als diese, zudem gebe es Unterschiede bei den detektierbaren Verunreinigungen. Dieses Ergebnis habe sich auch durch das Bandenmuster, welches sich aus der Methode der kapillarisoelektrophore-tischen Fokussierung (ciEF) entstanden sei, bestätigt. Auch insoweit seien die Probe aus dem Labor des Angeklagten und das Referenzmuster nicht vergleichbar gewesen.
1780762
1781Anhand der Methoden des Peptide-Mapping und des nano-LC-MS sei sodann festgestellt worden, dass sich in dem Infusionsbeutel tatsächlich der Wirkstoff Pertuzumab in der gemessenen Menge befunden habe. Der deklarierte Wirkstoff Trastuzumab sei in der Probe aus dem Labor des Angeklagten nicht enthalten gewesen.
1782Tat 61.883 der Anklage:
1783Der Sachverständige Dr. G führte aus, dass der Infusionsbeutel der Patientin
1784![]() nach der Deklaration des Etiketts einen Gehalt des Wirkstoffs Pertuzumab von 420,00 mg in einer 0,9 %-igen NaCl-Trägerlösung ausgewiesen habe. Die Sichtkontrolle habe keine Auffälligkeiten ergeben. Anhand der Proteinbestimmungsme-thode bei 280 nm habe sich ein Befund von 43,4 mg Wirkstoffgehalt ergeben, dies entspreche einem Wirkstoffmindergehalt von 89,7 % bei einer Messunsicherheit von 10 %. Bei Berücksichtigung des erhöhten Füllvolumens der Trägerlösungsbeutel er-
nach der Deklaration des Etiketts einen Gehalt des Wirkstoffs Pertuzumab von 420,00 mg in einer 0,9 %-igen NaCl-Trägerlösung ausgewiesen habe. Die Sichtkontrolle habe keine Auffälligkeiten ergeben. Anhand der Proteinbestimmungsme-thode bei 280 nm habe sich ein Befund von 43,4 mg Wirkstoffgehalt ergeben, dies entspreche einem Wirkstoffmindergehalt von 89,7 % bei einer Messunsicherheit von 10 %. Bei Berücksichtigung des erhöhten Füllvolumens der Trägerlösungsbeutel er-
gebe sich nach den Angaben des Sachverständigen L ein Wirkstoffgehalt von46,0 mg und ein Wirkstoffmindergehalt von 89,0 %.
1786Die Prüfung der Molekulargewichtsverteilung anhand der Größenausschlusschroma-tographie (SEC) habe ergeben, dass keine bzw. nur wenige Polymere/Fragmente und keine anderen Proteine nachweisbar seien. Die Proteinzusammensetzung anhand der SDS-Kapillarelektrophorese habe ergeben, dass es sich bei dem festgestellten Proteingehalt um den Wirkstoff Pertuzumab gehandelt habe. Dieses Ergebnis habe sich auch durch das Bandenmuster, welches sich aus der Methode der kapillarisoelektro-phoretischen Fokussierung (ciEF) entstanden sei, bestätigt. Hinweise auf Fragmente (Bruchstücke) oder Polymere des Wirkstoffes hätten nicht vorgelegen.
1787Tat 61.884 der Anklage:
1788![]() Der Sachverständige Dr. G führte aus, dass der Infusionsbeutel der Patientin nach der Deklaration des Etiketts einen Gehalt des Wirkstoffs Trastuzumab von 120,00 mg in einer 0,9 %-igen NaCl-Trägerlösung ausgewiesen habe. Die Sichtkontrolle habe keine Auffälligkeiten ergeben. Anhand der Proteinbestimmungsme-thode bei 280 nm habe sich ein Befund von 91,0 mg Wirkstoffgehalt ergeben, dies
Der Sachverständige Dr. G führte aus, dass der Infusionsbeutel der Patientin nach der Deklaration des Etiketts einen Gehalt des Wirkstoffs Trastuzumab von 120,00 mg in einer 0,9 %-igen NaCl-Trägerlösung ausgewiesen habe. Die Sichtkontrolle habe keine Auffälligkeiten ergeben. Anhand der Proteinbestimmungsme-thode bei 280 nm habe sich ein Befund von 91,0 mg Wirkstoffgehalt ergeben, dies
763
1790entspreche einem Wirkstoffmindergehalt von 24,2 % bei einer Messunsicherheit von 10 %.
1791Die Prüfung der Molekulargewichtsverteilung anhand der Größenausschlusschroma-tographie (SEC) habe ergeben, dass keine bzw. nur wenige Polymere/Fragmente und keine anderen Proteine nachweisbar seien. Die Prüfung der Proteinzusammensetzung anhand der SDS-Kapillarelektrophorese habe hingegen ergeben, dass es sich bei dem festgestellten Proteingehalt nicht um den Wirkstoff Trastuzumab gehandelt habe. Die Probe aus dem Labor des Angeklagten und das Referenzmuster seien nicht vergleichbar: unter reduzierenden Bedingungen liege die Immunglobulinbande etwas unterhalb der Referenzbande, die Bande der leichten Kette liege unter reduzierenden Bedingungen etwas oberhalb der Referenzbande und sei breiter als diese, zudem gebe es Unterschiede bei den detektierbaren Verunreinigungen. Dieses Ergebnis habe sich auch durch das Bandenmuster, welches aus der Methode der kapillarisoelektrophoretischen Fokussierung (ciEF) entstanden sei, bestätigt. Auch insoweit seien die Probe aus dem Labor des Angeklagten und das Referenzmuster nicht vergleichbar gewesen. Anhand der Methoden des Peptide-Mapping und des nano-LC-MS sei sodann festgestellt worden, dass sich in dem Infusionsbeutel tatsächlich der Wirkstoff Pertuzumab in der gemessenen Menge befunden habe. Der deklarierte Wirkstoff Trastuzumab sei in der Probe aus dem Labor des Angeklagten nicht enthalten gewesen.
1792Tat 61.885 der Anklage:
1793Der Sachverständige Dr. G führte aus, dass der Infusionsbeutel der Patientin
1794![]() nach der Deklaration des Etiketts einen Gehalt des Wirkstoffs Bevacizumab von 1.050,00 mg in einer 0,9 %-igen NaCl-Trägerlösung ausgewiesen habe. Die Sichtkontrolle habe keine Auffälligkeiten ergeben. Anhand der Proteinbestimmungsmethode bei 280 nm habe sich ein Befund von 286,7 mg Wirkstoffgehalt ergeben, dies entspreche einem Wirkstoffmindergehalt von 72,7 % bei einer Messunsicherheit von 10 %. Bei Berücksichtigung des erhöhten Füllvolumens der Trägerlösungsbeutel ergebe sich
nach der Deklaration des Etiketts einen Gehalt des Wirkstoffs Bevacizumab von 1.050,00 mg in einer 0,9 %-igen NaCl-Trägerlösung ausgewiesen habe. Die Sichtkontrolle habe keine Auffälligkeiten ergeben. Anhand der Proteinbestimmungsmethode bei 280 nm habe sich ein Befund von 286,7 mg Wirkstoffgehalt ergeben, dies entspreche einem Wirkstoffmindergehalt von 72,7 % bei einer Messunsicherheit von 10 %. Bei Berücksichtigung des erhöhten Füllvolumens der Trägerlösungsbeutel ergebe sich
nach den Angaben des Sachverständigen L ein Wirkstoffgehalt von 302,2 mgund ein Wirkstoffmindergehalt von 71,1 %.
1796Die Prüfung der Molekulargewichtsverteilung anhand der Größenausschlusschroma-tographie (SEC) habe ergeben, dass keine bzw. nur wenige Polymere/Fragmente und
1797764
1798keine anderen Proteine nachweisbar seien. Die Proteinzusammensetzung anhand der SDS-Kapillarelektrophorese habe ergeben, dass es sich bei dem festgestellten Proteingehalt um den Wirkstoff Bevacizumab gehandelt habe. Dieses Ergebnis habe sich auch durch das Bandenmuster, welches sich aus der Methode der kapillarisoelektro-phoretischen Fokussierung (ciEF) entstanden sei, bestätigt.
1799Tat 61.886 der Anklage:
1800Der Sachverständige Dr. G führte aus, dass der Infusionsbeutel der Patientin
1801![]() nach der Deklaration des Etiketts einen Gehalt des Wirkstoffs Trastuzumab von 378,00 mg in einer 0,9 %-igen NaCl-Trägerlösung ausgewiesen habe. Die Sichtkontrolle habe keine Auffälligkeiten ergeben. Anhand der Proteinbestimmungsmethode bei 280 nm habe sich ein Befund von 289,4 mg Wirkstoffgehalt ergeben, dies entspreche einem Wirkstoffmindergehalt von 23,4 % bei einer Messunsicherheit von 10 %.
nach der Deklaration des Etiketts einen Gehalt des Wirkstoffs Trastuzumab von 378,00 mg in einer 0,9 %-igen NaCl-Trägerlösung ausgewiesen habe. Die Sichtkontrolle habe keine Auffälligkeiten ergeben. Anhand der Proteinbestimmungsmethode bei 280 nm habe sich ein Befund von 289,4 mg Wirkstoffgehalt ergeben, dies entspreche einem Wirkstoffmindergehalt von 23,4 % bei einer Messunsicherheit von 10 %.
Die Prüfung der Molekulargewichtsverteilung anhand der Größenausschlusschroma-tographie (SEC) habe ergeben, dass keine bzw. nur wenige Polymere/Fragmente und keine anderen Proteine nachweisbar seien. Die Prüfung der Proteinzusammensetzung anhand der SDS-Kapillarelektrophorese habe hingegen ergeben, dass es sich bei dem festgestellten Proteingehalt nicht um den Wirkstoff Trastuzumab gehandelt habe. Die Probe aus dem Labor des Angeklagten und das Referenzmuster seien nicht vergleichbar: unter reduzierenden Bedingungen liege die Immunglobulinbande etwas unterhalb der Referenzbande, die Bande der leichten Kette liege unter reduzierenden Bedingungen etwas oberhalb der Referenzbande und sei breiter als diese, zudem gebe es Unterschiede bei den detektierbaren Verunreinigungen. Dieses Ergebnis habe sich auch durch das Bandenmuster, welches sich aus der Methode der kapillarisoelektrophore-tischen Fokussierung (ciEF) entstanden sei, bestätigt. Auch insoweit seien die Probe aus dem Labor des Angeklagten und das Referenzmuster nicht vergleichbar gewesen. Anhand der Methoden des Peptide-Mapping und des nano-LC-MS sei festgestellt worden, dass sich in dem Infusionsbeutel tatsächlich der Wirkstoff Pertuzumab in der gemessenen Menge befunden habe. Der deklarierte Wirkstoff Trastuzumab sei in der Probe aus dem Labor des Angeklagten nicht enthalten gewesen.
1803765
1804Tat 61.887 der Anklage:
1805Der Sachverständige Dr. G führte aus, dass der Infusionsbeutel der Patientin
1806![]() nach der Deklaration des Etiketts einen Gehalt des Wirkstoffs Pertuzumab von 420,00 mg in einer 0,9 %-igen NaCl-Trägerlösung ausgewiesen habe. Die Sichtkontrolle habe keine Auffälligkeiten ergeben. Anhand der Proteinbestimmungsmethode bei 280 nm habe sich ein Befund von 34,3 mg Wirkstoffgehalt ergeben, dies entspreche einem Wirkstoffmindergehalt von 91,8 % bei einer Messunsicherheit von 10 %. Bei Berücksichtigung des erhöhten Füllvolumens der Trägerlösungsbeutel ergebe sich
nach der Deklaration des Etiketts einen Gehalt des Wirkstoffs Pertuzumab von 420,00 mg in einer 0,9 %-igen NaCl-Trägerlösung ausgewiesen habe. Die Sichtkontrolle habe keine Auffälligkeiten ergeben. Anhand der Proteinbestimmungsmethode bei 280 nm habe sich ein Befund von 34,3 mg Wirkstoffgehalt ergeben, dies entspreche einem Wirkstoffmindergehalt von 91,8 % bei einer Messunsicherheit von 10 %. Bei Berücksichtigung des erhöhten Füllvolumens der Trägerlösungsbeutel ergebe sich
nach den Angaben des Sachverständigen L ein Wirkstoffgehalt von 36,4 mg undein Wirkstoffmindergehalt von 91,3 %.
1808Die Prüfung der Molekulargewichtsverteilung anhand der Größenausschlusschroma-tographie (SEC) habe ergeben, dass keine bzw. nur wenige Polymere/Fragmente und keine anderen Proteine nachweisbar seien. Die Proteinzusammensetzung anhand der SDS-Kapillarelektrophorese habe ergeben, dass es sich bei dem festgestellten Proteingehalt um den Wirkstoff Pertuzumab gehandelt habe. Dieses Ergebnis habe sich auch durch das Bandenmuster, welches sich aus der Methode der kapillarisoelektro-phoretischen Fokussierung (ciEF) entstanden sei, bestätigt.
1809Tat 61.888 der Anklage:
1810Der Sachverständige Dr. G führte aus, dass der Infusionsbeutel der Patientin
1811![]() nach der Deklaration des Etiketts einen Gehalt des Wirkstoffs Rituximab von 700,00 mg in einer 0,9 %-igen NaCl-Trägerlösung ausgewiesen habe. Die Sichtkontrolle habe keine Auffälligkeiten ergeben. Anhand der Proteinbestimmungsmethode bei 280 nm habe sich ein Befund von 473,1 mg Wirkstoffgehalt ergeben, dies entspreche einem Wirkstoffmindergehalt von 32,4 % bei einer Messunsicherheit von 10 %. Bei Berücksichtigung des erhöhten Füllvolumens der Trägerlösungsbeutel ergebe sich
nach der Deklaration des Etiketts einen Gehalt des Wirkstoffs Rituximab von 700,00 mg in einer 0,9 %-igen NaCl-Trägerlösung ausgewiesen habe. Die Sichtkontrolle habe keine Auffälligkeiten ergeben. Anhand der Proteinbestimmungsmethode bei 280 nm habe sich ein Befund von 473,1 mg Wirkstoffgehalt ergeben, dies entspreche einem Wirkstoffmindergehalt von 32,4 % bei einer Messunsicherheit von 10 %. Bei Berücksichtigung des erhöhten Füllvolumens der Trägerlösungsbeutel ergebe sich
nach den Angaben des Sachverständigen L ein Wirkstoffgehalt von 495,2 mgund ein Wirkstoffmindergehalt von 29,3 %.
1813Die Prüfung der Molekulargewichtsverteilung anhand der Größenausschlusschroma-tographie (SEC) habe ergeben, dass keine bzw. nur wenige Polymere/Fragmente und keine anderen Proteine nachweisbar seien. Die Proteinzusammensetzung anhand der
1814766
1815SDS-Kapillarelektrophorese habe ergeben, dass es sich bei dem festgestellten Proteingehalt um den Wirkstoff Pertuzumab gehandelt habe. Dieses Ergebnis habe sich auch durch das Bandenmuster, welches sich aus der Methode der kapillarisoelektro-phoretischen Fokussierung (ciEF) entstanden sei, bestätigt.
1816Tat 61.889 der Anklage:
1817![]() Der Sachverständige Dr. G führte aus, dass der Infusionsbeutel der Patientin nach der Deklaration des Etiketts einen Gehalt des Wirkstoffs Trastuzumab von 480,00 mg in einer 0,9 %-igen NaCl-Trägerlösung ausgewiesen habe. Die Sichtkontrolle habe Ausflockung im Tropf ergeben. Anhand der Proteinbestimmungsmethode bei 280 nm habe sich ein Befund von 41,8 mg Wirkstoffgehalt ergeben, dies entspreche einem Wirkstoffmindergehalt von 91,3 % bei einer Messunsicherheit von 10 %.
Der Sachverständige Dr. G führte aus, dass der Infusionsbeutel der Patientin nach der Deklaration des Etiketts einen Gehalt des Wirkstoffs Trastuzumab von 480,00 mg in einer 0,9 %-igen NaCl-Trägerlösung ausgewiesen habe. Die Sichtkontrolle habe Ausflockung im Tropf ergeben. Anhand der Proteinbestimmungsmethode bei 280 nm habe sich ein Befund von 41,8 mg Wirkstoffgehalt ergeben, dies entspreche einem Wirkstoffmindergehalt von 91,3 % bei einer Messunsicherheit von 10 %.
Die Prüfung der Molekulargewichtsverteilung anhand der Größenausschlusschroma-tographie (SEC) habe ergeben, dass keine bzw. nur wenige Polymere/Fragmente und keine anderen Proteine nachweisbar seien. Die Prüfung der Proteinzusammensetzung anhand der SDS-Kapillarelektrophorese habe hingegen ergeben, dass es sich bei dem festgestellten Proteingehalt nicht um den Wirkstoff Trastuzumab gehandelt habe. Die Probe aus dem Labor des Angeklagten und das Referenzmuster seien nicht vergleichbar: unter reduzierenden Bedingungen liege die Immunglobulinbande etwas unterhalb der Referenzbande, die Bande der leichten Kette liege unter reduzierenden Bedingungen etwas oberhalb der Referenzbande und sei breiter als diese, zudem gebe es Unterschiede bei den detektierbaren Verunreinigungen. Dieses Ergebnis habe sich auch durch das Bandenmuster, welches sich aus der Methode der kapillarisoelektrophore-tischen Fokussierung (ciEF) entstanden sei, bestätigt. Auch insoweit seien die Probe aus dem Labor des Angeklagten und das Referenzmuster nicht vergleichbar gewesen. Anhand der Methoden des Peptide-Mapping und des nano-LC-MS sei sodann festgestellt worden, dass sich in dem Infusionsbeutel tatsächlich der Wirkstoff Pertuzumab in der gemessenen Menge befunden habe. Der deklarierte Wirkstoff Trastuzumab sei in der Probe aus dem Labor des Angeklagten nicht enthalten gewesen.
1819Tat 61.890 der Anklage:
1820767
1821![]()
![]() Der Sachverständige Dr. G führte aus, dass der Infusionsbeutel der Patientin nach der Deklaration des Etiketts einen Gehalt des Wirkstoffs Pertuzumab von 420,00 mg in einer 0,9 %-igen NaCl-Trägerlösung ausgewiesen habe. Die Sichtkontrolle habe keine Auffälligkeiten ergeben. Anhand der Proteinbestimmungsmethode bei 280 nm habe sich ein Befund von 60,7 mg Wirkstoffgehalt ergeben, dies entspreche einem Wirkstoffmindergehalt von 85,5 % bei einer Messunsicherheit von 10 %. Bei Berücksichtigung des erhöhten Füllvolumens der Trägerlösungsbeutel ergebe sich
Der Sachverständige Dr. G führte aus, dass der Infusionsbeutel der Patientin nach der Deklaration des Etiketts einen Gehalt des Wirkstoffs Pertuzumab von 420,00 mg in einer 0,9 %-igen NaCl-Trägerlösung ausgewiesen habe. Die Sichtkontrolle habe keine Auffälligkeiten ergeben. Anhand der Proteinbestimmungsmethode bei 280 nm habe sich ein Befund von 60,7 mg Wirkstoffgehalt ergeben, dies entspreche einem Wirkstoffmindergehalt von 85,5 % bei einer Messunsicherheit von 10 %. Bei Berücksichtigung des erhöhten Füllvolumens der Trägerlösungsbeutel ergebe sich
nach den Angaben des Sachverständigen L ein Wirkstoffgehalt von 64,3 mg undein Wirkstoffmindergehalt von 84,7 %.
1823Die Prüfung der Molekulargewichtsverteilung anhand der Größenausschlusschroma-tographie (SEC) habe ergeben, dass keine bzw. nur wenige Polymere/Fragmente und keine anderen Proteine nachweisbar seien. Die Proteinzusammensetzung anhand der SDS-Kapillarelektrophorese habe ergeben, dass es sich bei dem festgestellten Proteingehalt um den Wirkstoff Pertuzumab gehandelt habe. Dieses Ergebnis habe sich auch durch das Bandenmuster, welches sich aus der Methode der kapillarisoelektro-phoretischen Fokussierung (ciEF) entstanden sei, bestätigt.
1824Tat 61.892 der Anklage:
1825Der Sachverständige Dr. G führte aus, dass der Infusionsbeutel der Patientin
1826![]() nach der Deklaration des Etiketts einen Gehalt des Wirkstoffs Trastuzumab von 414,00 mg in einer 0,9 %-igen NaCl-Trägerlösung ausgewiesen habe. Die Sichtkontrolle habe mit Ausnahme weniger kleiner Fusseln keine Auffälligkeiten ergeben. Anhand der Proteinbestimmungsmethode bei 280 nm habe sich ein Befund von 16,2 mg Wirkstoffgehalt ergeben, dies entspreche einem Wirkstoffmindergehalt von 96,1 % bei einer Messunsicherheit von 10 %. Bei Berücksichtigung des erhöhten Füllvolumens der Trägerlösungsbeutel ergebe sich nach den Angaben des Sachverstän-
nach der Deklaration des Etiketts einen Gehalt des Wirkstoffs Trastuzumab von 414,00 mg in einer 0,9 %-igen NaCl-Trägerlösung ausgewiesen habe. Die Sichtkontrolle habe mit Ausnahme weniger kleiner Fusseln keine Auffälligkeiten ergeben. Anhand der Proteinbestimmungsmethode bei 280 nm habe sich ein Befund von 16,2 mg Wirkstoffgehalt ergeben, dies entspreche einem Wirkstoffmindergehalt von 96,1 % bei einer Messunsicherheit von 10 %. Bei Berücksichtigung des erhöhten Füllvolumens der Trägerlösungsbeutel ergebe sich nach den Angaben des Sachverstän-
digen L ein Wirkstoffgehalt von 17,1 mg und ein Wirkstoffmindergehalt von95,9 %.
1828Die Prüfung der Molekulargewichtsverteilung anhand der Größenausschlusschroma-tographie (SEC) habe ergeben, dass keine bzw. nur wenige Polymere/Fragmente und keine anderen Proteine nachweisbar seien. Die Proteinzusammensetzung anhand der
1829768
1830SDS-Kapillarelektrophorese habe ergeben, dass es sich bei dem festgestellten Proteingehalt um den Wirkstoff Trastuzumab gehandelt habe. Dieses Ergebnis habe sich auch durch das Bandenmuster, welches sich aus der Methode der kapillarisoelektro-phoretischen Fokussierung (ciEF) entstanden sei, bestätigt.
1831(5) Würdigung der Analysen des Sachverständigen Dr. G
1832Die Kammer folgt den nachvollziehbaren und plausibel dargestellten Analyseergebnis-
1833sen des Sachverständigen Dr. G .
1834Sachkunde des Sachverständigen
1835Der Sachverständige Dr. G ist uneingeschränkt sachkundig, wie sich aus seinen
1836einschlägigen und langjährigen Erfahrungen in der Untersuchung von Arzneimitteln ergibt. Als Biochemiker war er Fachgebietsleiter an einem renommierten Institut, das in Deutschland führend in der Untersuchung und Zulassung monoklonaler Antikörper ist. Er ist seit vielen Jahren international in diesem Bereich tätig.
1837Bei seinen Ausführungen in der Hauptverhandlung wurden die fundierten wissenschaftlichen Kenntnisse und die langjährige berufliche Erfahrung deutlich. Jeden Ver-
1838fahrensschritt hat der Sachverständige Dr. G nachvollziehbar und anschaulich er-läutert. Hierbei setzte er sich mit Nachfragen und Vorhalten zu Einzelheiten der von ihm untersuchten Proben und den jeweiligen Untersuchungsergebnissen differenziert auseinander und erläuterte seine Analyseergebnisse.
1839Neutralität des Sachverständigen
1840Der Sachverständige Dr. G ist neutral. Zu den Verfahrensbeteiligten steht er in
1841keinerlei Verbindung. Als Angestellter einer öffentlichen Einrichtung hat er kein persönliches Interesse am Verfahrensausgang.
1842Methodisches Vorgehen des Sachverständigen
1843769
1844Die ordnungsgemäße Lagerung der Proben wurde vom Sachverständigen Dr. G
1845detailliert und nachvollziehbar belegt. Der Sachverständige Dr. G hat die Probenmit unterschiedlichen Messverfahren analysiert und zur Absicherung seiner Ergeb-
1846nisse weitere Untersuchungen durchgeführt. Der Sachverständige Dr. G hat dieMethoden und deren Zielsetzung nachvollziehbar beschrieben und erläutert. Die Vergleichsmessung mit der Referenzprobe ermöglichte die Überprüfung der Zuverlässigkeit der Messverfahren.
1847Die Kammer ist auch überzeugt, dass die einzelnen Messungen ordnungsgemäß durchgeführt worden sind. Eingesetzt waren beim PEI neben dem Sachverständigen
1848Dr. G erfahrene und qualifizierte Mitarbeiter, deren regelmäßige Tätigkeit geradedie Bedienung der verwendeten Geräte umfasst. Dabei handelt es sich - wie neben
1849dem Sachverständigen Dr. G auch der Sachverständige Prof. Dr. S ausge-führt hat - um Standardarbeitsgeräte, die seit vielen Jahren in der Forschung eingesetzt werden und die zur Standardausstattung eines Instituts wie des PEI gehören.
1850Die Kammer ist überzeugt, dass auch mit den Messverfahren, die nicht Teil der Akkre-ditierung des PEI sind bzw. im Zeitpunkt der Messung noch nicht akkreditiert waren, valide Testergebnisse erzielt worden sind. Dafür spricht bereits der Umstand, dass die spätere Akkreditierung ohne eine Veränderung der Messverfahren erfolgen konnte.
1851Schlüssigkeit der Analyseergebnisse
1852Die Analyseergebnisse sind in sich schlüssig. Anhand der Untersuchung der (vom Sachverständigen hergestellten) Referenzproben ergab sich die Zuverlässigkeit der Messverfahren, indem bei diesen Proben der hinzugefügte Gehalt des Wirkstoffs tatsächlich gemessen wurde. Neben den vorgenannten 28 Proben untersuchte Dr. G überdies eine weitere (29.) Probe, bei der ein ordnungsgemäßer Wirkstoffgehalt nachgewiesen werden konnte. Dabei handelte es sich um eine Zubereitung unter Verwendung so genannter Studienware. Diese Zubereitung sollte im Rahmen einer wissenschaftlichen Studie verwendet werden. Eine Unterdosierung unterlag damit einem erhöhten Entdeckungsrisiko.
1853770
1854Keine Zweifel aufgrund der Ausführungen Prof. S , Dr. K und Prof. B
1855Die tragfähigen Ausführungen des Sachverständigen Dr. G werden durch die An-
1856gaben der Sachverständigen Prof. S , Dr. K und Prof. B nicht inZweifel gezogen. Diese weiteren Sachverständigen haben auch in den Fällen der monoklonalen Antikörper keine eigenen Analysen der Wirkstoffproben durchgeführt, sondern sind methodenkritisch vorgegangen. Im Einzelnen:
1857Ausführungen des Sachverständigen Prof. S
1858Der Sachverständige Prof. S führte zunächst aus, dass es sich beim PEI um ein
1859Institut mit einem exzellenten Ruf für die Zulassung von Arzneistoffen auf nationaler und internationaler Ebene handele. Er selbst habe mit der Analyse monoklonaler Antikörper indes keine Erfahrung. Im Hinblick auf die Ausführungen des Sachverständi-
1860gen Dr. G führte er weiter aus, dass er auch diese Unterlagen nicht im Detail an-gesehen habe. Einzelheiten - auch zu den von der Sachverständigen Dr. K (dazu sogleich) angeführten Kritikpunkten - seien ihm nicht bekannt.
1861Zu den Methoden gab der Sachverständige Prof. Dr. S weiter an, dass er die
1862vom Sachverständigen Dr. G verwendeten Methoden zweifelsfrei als geeignet
1863ansehe. Bei den Methoden der Proteinbestimmung, Molekulargewichtsverteilung und der SDS-Elektrophorese handele sich um klassische Standardmethoden, die keine Schwierigkeiten im Umgang mit Geräten oder auf andere Weise begründeten. Auch die Verfahren ciEF, Peptide-Mapping und nano-LC-MS seien jedenfalls für das PEI Standardverfahren.
1864Gegenstand seiner Beauftragung sei es gewesen, die Anwendung dieser Methoden und die Dokumentation zu überprüfen. Um spezifische Fragen der Untersuchung mo-noklonaler Antikörper sei es ihm nicht gegangen. Da aus seiner Sicht das PEI kein Institut sei, welches grundsätzlich mit der Entwicklung von Methoden zur Untersuchung von Wirkstoffen befasst sei, sei es im PEI zwingend erforderlich, dass es Standard-Arbeitsanweisungen (sog. SOP) gebe, welche die Arbeitsschritte darlegten und deren Einhaltung dokumentiert sei. Dies sei insbesondere auch für die Methode der Proteinbestimmung - unabhängig davon, dass diese im Europäischen Arzneibuch beschrieben sei - erforderlich.
1865Allein der Umstand einer Akkreditierung sei für ihn nicht ausreichend. Vielmehr sei
1866771
1867erforderlich, dass eine vollständige Dokumentation aller Arbeitsschritte vorliege. Ob eine solche Dokumentation vorliege, könne er nicht beurteilen, da er sich die entsprechenden Unterlagen des PEI, die die Kammer zur Einsichtnahme zur Verfügung gestellt hat, selbst nur teilweise eingesehen habe. Soweit er Kenntnis von
1868den Kritikpunkten der Sachverständigen Dr. K habe, lasse dies aus seiner Sichtden Rückschluss zu, dass eine sorgfältige Arbeitsweise nicht vorliege. Eine Gesamtbewertung könne er nicht vornehmen, da er allenfalls 10 % des Datenmaterials untersucht habe. Dabei könne er auch nicht ausschließen, dass sich vermeintliche Fehler oder Kritikpunkte bei einer vollständigen Durchsicht des Datenmaterials erledigt bzw. geklärt hätten. Er habe jedenfalls nicht alle Unterlagen zur Doku-mentation des Transportes und zur Ausbildung der beteiligten Mitarbeiter gefunden.
1869Die Ausführungen des Sachverständigen Prof. S sind nicht geeignet, die
1870Ausführungen des Sachverständigen Dr. G und dessen Prüfergebnisse in Zweifel
1871zu ziehen. Der Sachverständige Prof. S gibt selbst an, die Methoden als
1872geeignet zur Ermittlung valider Prüfergebnisse zu qualifizieren. Der weitere
1873Einwand der (fehlenden) hinreichenden Dokumentation konnte vom Sachver-
1874ständigen Prof. S nicht im Detail untermauert werden (zu den Ausführungen
1875der Sachverständigen Dr. K sogleich). Der Kammer standen insoweit 14 Steh-
1876ordner mit Rohdaten, SOPs und Prüfergebnissen zur Verfügung, die der
1877Sachverständige Prof. S nicht ausgewertet hatte.
1878Dabei hat die Kammer weiter berücksichtigt, dass der Sachverständige Prof. S zudem keine konkreten Angaben machen konnte, dass ein Prüfschritt, der erforderlich gewesen wäre, fehlte oder jedenfalls nicht dokumentiert wurde. Dass einer der ihm bekannten Kritikpunkte - insbesondere die vermeintlich fehlerhafte Korrektur von Zahlen in der Niederschrift wie von der Sachverständigen Dr. K benannt (im Einzelnen sogleich) - Auswirkungen auf ein Prüfergebnis gehabt haben oder gehabt haben könnten, konnte der Sachverständige nicht beantworten. Dass
1879Prof. S zudem nicht ausschließen konnte, dass bei einer Durchsicht allerUnterlagen seine (nicht näher konkretisierte) Kritik ausgeräumt worden wäre, zeigt die Unergiebigkeit seines Gutachtens zu der Qualität der Analyse des
1880Sachverständigen Dr. G .
1881Ausführungen der Sachverständigen Dr. K
1882772
1883Die Sachverständige Dr. K führte zunächst aus, dass sie weder über Erfahrungen
1884in der Wirkstoffbestimmung monoklonaler Antikörper verfüge noch an Inspektionen von Laboreinrichtungen in diesem Bereich teilgenommen habe. Sie habe allein ge-
1885prüft, ob die vom Sachverständigen Dr. G bereitgestellten Unterlagen des PEI -ausgehend von den Standards, die für die Verfahren der Zulassung von Medikamenten verlangt werden - vollständig seien.
1886Die Sachverständige Dr. K erklärte weiter, sie halte die vom Sachverständigen Dr.
1887G verwendeten Methoden grundsätzlich für geeignet. Soweit sie sich die Doku-
1888mentation angesehen habe, habe sie festgestellt, dass die Methoden auch richtig angewendet worden seien. Auch soweit sie eine Nachberechnung von Ergebnissen vorgenommen habe, seien diese zutreffend gewesen. Nur für das Verfahren der kapilla-risoelektrischen Fokussierung (cIEF) habe sie keine Unterlagen zur Validierung gefunden. Zudem fehle es an Stabilitätsvergleichsmustern, die aus ihrer Sicht erforderlich seien. Auch sei nicht erkennbar, ob hinreichend beachtet worden sei, dass die Methoden für Fertigarzneimittel konzipiert seien. Bei der Anwendung der Methoden auf die Arzneimittelzubereitungen aus dem Labor des Angeklagten könne es zu so genannten Matrixeffekten kommen.
1889Insgesamt habe sie fünf Fehler gefunden, die sie als unkritisch bewerte (Grad 1), zehn Fehler bewerte sie als weniger kritisch (Grad 2) und 34 Fehler bewerte sie als kritisch (Grad 3).
1890Die Sachverständige Dr. K monierte ferner (vermeintlich) fehlende Unterlagen.
1891Sie gab insoweit an, dass für ein Thermostat das Logbuch fehle, weiter fehle für einen Kühlschrank die Dokumentation für September 2017. Sie gehe aber davon aus, dass diese Unterlagen beim PEI vorhanden seien. Die Unterlagen zu der Qualifizierung der Mitarbeiter seien teilweise erst am 26.04.2018 ausgestellt worden, die schriftliche Begründung für die Qualifizierung sei unzureichend. Teilweise seien lose Unterlagen in den Ordnern, insoweit bedürfe es eines gebundenen Laborjournals mit durchlaufender Nummerierung, auch an anderen Stellen hätte es bei fortlaufenden Blättern einer Paginierung bedurft. Weiter fehle die Dokumentation der Aufkonzentrierung von Proben.
1892Weiter sei - entsprechend der Kritik am LZG bzw. dem Sachverständigen L - die
1893Lagerung der Proben nicht hinreichend nachvollziehbar, insbesondere sei nicht erkennbar, wie Entnahmen aus dem Kühlschrank und spätere Rückführungen dokumentiert worden seien.
1894773
1895Die Sachverständige Dr. K führte weiter aus, dass sie an verschiedenen Stellen
1896der Dokumentation festgestellt habe, dass Zahlen durchgestrichen bzw. überschrieben worden seien. Nach ihrer Auffassung sei es aber erforderlich, dass die ursprüngliche Zahl weiterhin lesbar sei, der Grund der Korrektur und deren Urheber notiert werde, schließlich die Korrektur durch einen weiteren Mitarbeiter abgezeichnet werde.
1897Sie habe weiterhin festgestellt, dass eine Grafik in der Dokumentation fehlerhaft beschriftet sei, ein Prüfpräparat sei dort nicht genannt. Vereinzelt seien die Bezifferungen von Proben fehlerhaft. Es seien bei einer Probe verschiedene Volumina für die NaCl-Lösung verwendet worden. Bei einem Chromatographen fehle eine Freigabe. Pipetten seien nicht mit Kennziffern oder Namen individualisierbar benannt. Das Inhaltsverzeichnis eines Ordners sei mit dem Datum „02.06.2018“ versehen, welches im Zeitpunkt des Eingangs bei Gericht noch nicht verstrichen gewesen sei, das Datum sei mithin fehlerhaft. Auch an anderen Stellen seien Daten fehlerhaft, so seien Messungen auf den 09.10.2016 oder Freigaben auf den 04.01.2016 datiert, mithin vor Eingang der Proben aus dem Labor des Angeklagten im PEI. Arbeitsanweisungen seien als Entwurf gekennzeichnet und nicht freigegeben. Auch seien die Temperaturwerte von Kühlschrank und Gefriergerät vertauscht in eine Tabelle eingetragen worden.
1898Weiter führte die Sachverständige Dr. K aus, dass in den Prüfberichten vermerkt
1899sei, dass aufkonzentrierte Proben verwendet worden seien, es fehle aber teilweise die Information, ob wieder eine Verdünnung erfolgt sei. Es gebe auch keine Dokumentation des möglichen Einflusses der Aufkonzentrierung auf die Stabilität, auch dabei handele es sich aus ihrer Sicht um einen Dokumentationsmangel, eine Verfälschung des Analyseergebnisses gehe damit nicht einher.
1900Eine chronologische Liste zu den pH-Elektroden sei nicht chronologisch geführt, der Eintrag vom 29.04.2014 befinde sich hinter dem Eintrag vom 30.04.2016. Allein die Kennzeichnung am Rande mit einem Pfeil sei insoweit nicht ausreichend, der Grund der Fehleintragung müsse benannt werden. Die Dokumentation zu einer Säule sei nicht nachvollziehbar. Teilweise seien - wie auch beim LZG - Wartungs- bzw. Prüfintervalle für Geräte nicht eingehalten worden.
1901Hinsichtlich der Tat 61.887 der Anklage habe es zwei Prüfberichte gegeben, einen Prüfbericht vom 05.01.2017 und einen Prüfbericht, der auf den 13.03.2013 datiert sei. Es habe beim zweiten Prüfbericht der nach der SOP erforderliche Hinweis gefehlt, welches Dokument ersetzt werde. Ein CAPA (vgl. näher dazu oben) sei ebenfalls nicht
1902774
1903vorhanden.
1904Bewertung
1905Die Ausführungen der Sachverständigen Dr. K begründen keine Zweifel der Kam-
1906mer an den überzeugenden Ausführungen des Sachverständigen Dr. G und an
1907der Zuverlässigkeit der Testergebnisse des PEI. Im Einzelnen:
1908Der Sachverständige Dr. G führte glaubhaft aus, dass für das Verfahren der kapil-
1909larisoelektrischen Fokussierung (cIEF) im Zeitpunkt der Anwendung noch keine Ak-kreditierung vorgelegen habe. Mittlerweile sei das Verfahren akkreditiert, und zwar einschließlich der SOPs und sonstigen Vorgaben, die er bei der Analyse der verfahrensgegenständlichen Proben angewendet habe. Die Kammer ist daher davon überzeugt, dass auch dieses Messverfahren zu zuverlässigen Ergebnissen geführt hat, zumal Hinweise auf Mängel der SOPs oder Zweifel an den Testergebnissen weder von der
1910Sachverständigen Dr. K geltend gemacht worden noch sonst ersichtlich sind.
1911Für die Anfertigung von identischen Stabilitätsvergleichsmustern habe es nach den
1912überzeugenden Ausführungen des Sachverständigen Dr. G keine Veranlassunggegeben. Für die von ihm verwandten Methoden, deren Untersuchungsgegenstand nicht die Wirksamkeit einer Probe sei, sei ein Stabilitätsvergleichsmuster nicht erforderlich, die Referenzprobe sei ausreichend gewesen. Im Rahmen der Prüfungen der Identität und Unversehrtheit wären Vorgänge der Denaturierung durch das Vorhandensein von Bruchstücken bzw. Polymere hinreichend erkennbar gewesen. Dies sei aber bei keiner der untersuchten Proben beobachtet worden. Diese Ausführungen folgt die Kammer. So genannte Matrixeffekte (Auswirkungen unterschiedlicher Hilfsstoffe der Probe und der Referenzprobe auf das Messergebnis) seien nicht zu berücksichtigen, da jeweils Wirkstoffe des gleichen Herstellers mit identischen Hilfsstoffen verwendet worden seien.
1913Zu den von der Sachverständigen Dr. K monierten vermeintlich fehlenden Doku-
1914mentations-Unterlagen ist folgendes festzuhalten: Das PEI hatte zunächst auf Anforderung der Kammer Unterlagen übersandt, die Daten zu den einzelnen Analysen ent-
1915hielten. Nachdem Dr. K in ihrer ersten Vernehmung in der Hauptverhandlung er-klärt hatte, sie benötige weitere "übergreifende" Daten, etwa Dokumentationen zu den verwendeten Geräten, übersandte das PEI weitere Unterlagen, so dass letztlich 14
1916775
1917Stehordner mit Rohdaten, SOPs und Prüfergebnissen zur Verfügung standen. Der
1918Sachverständige Dr. G gab an, dass die vermeintlich fehlenden Unterlagen jeden-falls im PEI vorhanden seien. Unterlagen zur Schulung von Mitarbeitern führte er mit sich. Die Mitarbeiter seien qualifiziert ausgebildet und verfügten zudem über eine Schulung für jedes von ihnen bediente Gerät. Auf die Dokumentation des Kühlschranks für September 2017 komme es nicht an, da dieser Zeitraum zeitlich nach der Begutachtung liege.
1919Der Sachverständige Dr. G führte weiter aus, dass für alle angewandten Methoden
1920SOPs vorhanden seien, die bei den Prüfungen auch eingehalten worden seien. Soweit sich Entwürfe in den Unterlagen fänden, habe er diese der Vollständigkeit halber beigefügt. Es gebe aber in jedem Fall eine formale Arbeitsanweisung mit einer Freigabe gegenüber dem tätigen Mitarbeiter.
1921Zum Einwand, dass keine Namens-Bezeichnung von verwendeten Pipetten erfolgt sei,
1922führte der Sachverständige Dr. G aus, dass dies im PEI nicht üblich sei, da einPipettensatz verwendet werde, der einer regelmäßigen Überprüfung unterliege. Es sei auch unschädlich, dass Prüfungsintervalle überschritten worden seien, da das nachfolgende Bestehen eines Funktionstests - so hat es auch der Sachverständige L überzeugend dargelegt - den Rückschluss zulasse, dass das Gerät durchgehend ordnungsgemäß gearbeitet habe. Die Freigabe der Prüfberichte sei erst nach Bestehen der Funktionstests erfolgt.
1923Mit der Lagerung der Proben im Kühlschrank verhalte es sich so, dass die Proben jeweils bei Ankunft sofort auf ihre Temperatur kontrolliert und dann in den Kühlraum verbracht würden. Es erfolge durchgehend eine Temperaturkontrolle, die Kühlschränke würden täglich kontrolliert und anhand der Thermometer sei auch erkennbar, ob Ausfälle vorlägen. Eine weitere Dokumentation für jede einzelne Probe sei vor diesem Hintergrund nicht mehr erforderlich. Diesen überzeugenden Ausführungen des
1924Sachverständigen Dr. G schließt sich die Kammer an. Hinweise auf eine unsach-gemäße Behandlung, insbesondere bei Transport, Lagerung oder Entnahmen, bestehen nicht.
1925Zu der vermeintlich nicht nachvollziehbaren Dokumentation einer Säule sei es nach
1926den plausiblen Ausführungen des Sachverständigen Dr. G so gewesen, dass dieSäule in den Reports falsch bezeichnet gewesen sei. Die zutreffende Angabe sei dann vermerkt worden, auch in elektronischer Form. Jedoch habe seine Fachkraft auf einen
1927776
1928erneuten Ausdruck aller Reports verzichtet. Insoweit sei aus seiner Sicht der handschriftliche Vermerk ausreichend. Dieser Einschätzung schließt sich die Kammer an. Die Unterlagen sind anhand des Vermerks nachvollziehbar. Ein Neuausdruck aller Reports würde eine reine Förmelei darstellen, derer es für den verständigen Leser der Unterlagen nicht bedarf.
1929Zu den vermeintlich fehlenden Angaben zur konkreten Durchführung der Aufkonzent-
1930rierung führte der Sachverständige Dr. G aus, dass diese Angaben nicht erforder-lich seien. Die Aufkonzentrierung habe keine Auswirkungen auf das Analyseergebnis. Sie sei erst nach der Wirkstoffgehaltsbestimmung durch die Proteinbestimmung mit 280 nm erfolgt. Unregelmäßigkeiten wären zudem anhand der Peaks im Messergebnis erkennbar gewesen. Die Kammer schließt sich insoweit den Ausführungen des Sachverständigen an, dass die Dokumentation von Werten, die ohne Ergebnis auf das Ana-lyseergebnis bleiben, entbehrlich ist.
1931Zu den vermeintlichen Mängeln bei der Korrektur von Schreibfehlern führte der Sach-
1932verständige Dr. G aus, dass diese Schreibfehler vorhanden seien, auf die Qualitätder Messergebnisse aber keinen Einfluss hätten. Der von der Sachverständigen Dr.
1933K angeführten Korrekturmethode durch lesbares Durchstreichen und Angabe vonGrund und Urheber der Korrektur bedürfe es vorliegend nicht. Diese Vorgabe entstamme der DIN-Norm für die Verfahren der Zulassung von Medikamenten und betreffe tatsächliche Fehler. Vorliegend handele es sich aber gerade nicht um ein solches Verfahren der Zulassung, welches auch eine vollkommen andere Zielrichtung, namentlich die Anwendung von Medikamenten beim Menschen, habe. Zudem sei diese Vorgabe auch nur bei tatsächlichen Fehlern statthaft, wenn also zunächst ein fehlerhafter Wert eingetragen worden sei, nicht aber, wenn sich - wie vorliegend - der Eintragende schon bei der Eintragung verschreibe. Diesen überzeugenden Ausführungen
1934des Sachverständigen Dr. G folgt die Kammer.
1935Zu den weiteren benannten Mängeln (fehlerhafte Beschriftung einer Grafik, Angabe eines anderen Volumens, fehlerhafte Chronologie, lose Unterlagen ohne Bindung, fehlende Paginierung, vertauschte Einträge, fehlender Hinweis auf zu ersetzenden Prüfbericht und fehlendes CAPA): Es handelt sich nach den überzeugenden Ausführungen
1936des Sachverständigen Dr. G , denen die Kammer folgt, zwar um Ungenauigkeiten,die sich aber bei einer Gesamtschau der jeweiligen Unterlagen aus dem Zusammen-
1937777
1938hang erklären ließen. Auswirkungen auf die Messergebnisse seien nicht zu verzeich-
1939nen. Insoweit räumte der Sachverständige Dr. G nachvollziehbar ein, dass die Prü-fungen einer besonderen Eilbedürftigkeit unterlegen hätten, da sich der Angeklagte in Untersuchungshaft befunden habe.
1940Weiter hat die Kammer berücksichtigt, dass eine Vielzahl der Kritikpunkte sich nicht auf Vorkommnisse oder Fehleintragungen bezieht, die in einem zeitlichen Zusammen-hang mit den vorliegenden Messungen, die die Proben aus dem Labor des Angeklagten betreffen, liegen. Diese Messungen fanden in einem Zeitraum zwischen Dezember 2016 und April 2017 statt. Die Kammer kann zweifelsfrei ausschließen, dass z.B. Fehleintragungen in einer chronologischen Liste aus April 2014 oder Schimmelbildung in einem Kühlschrank im Januar 2018 Auswirkungen
1941auf die Analyseergebnisse des Sachverständigen Dr. G gehabt haben. Auch diefehlerhafte Datierung eines Inhaltsverzeichnisses hatte keine Auswirkungen auf die Analyseergebnisse.
1942Bei einer Gesamtschau der von der Sachverständigen Dr. K aufgeführten Kritik-
1943punkte und Mängel lassen sich Zweifel der Kammer an den überzeugenden Ausfüh-
1944rungen des Sachverständigen Dr. G und seine Analyseergebnisse nicht begrün-den. Denn der Kern der Untersuchung des Sachverständigen, nämlich die Analyse-Methoden und ihre Anwendung, ist nicht berührt. Die vermeintlichen Mängel sind im Wesentlichen in der Dokumentation zu finden. Sie verteilen sich auf insgesamt 29 Proben und insgesamt 14 Stehordner an Unterlagen. Regelmäßig sind sie überdies als bloße Flüchtigkeitsfehler einzustufen. Auf die Zuverlässigkeit der Ergebnisse haben sie keinen Einfluss.
1945Ausführungen des Sachverständigen Prof. B
1946Der Sachverständige Prof. B hat - ähnlich wie zum Gutachten L auch zu den
1947Ausführungen des Sachverständigen Dr. G - Ausführungen allgemeiner Art ohneKenntnis der Einzelheiten der durchgeführten Untersuchungen gemacht. Seine Angaben waren unergiebig.
1948
![]()
![]()


![]()
![]()
![]()
![]()
![]()
![]()

![]()

779
1950die sonstigen Labormitarbeiter zur Zeit der Herstellung Ende November 2016 nicht mit einer polizeilichen Durchsuchung des Labors und der Sicherstellung ihrer Arbeitsergebnisse. Denn dann hätten sie die Zubereitungen gewiss "ordnungsgemäß" produziert.
1951Ebenso schließt die Kammer eine versehentliche Falschzuordnung aus. Die fraglichen Herstellungsprotokolle sind zeitnah erstellt worden. Die Zahl der Mitarbeiter, die Zubereitungen zur Auslieferung am 29.11.2016 hergestellt hat, war überschaubar: In den
1952Protokollen sind ausschließlich der Angeklagte sowie J S und Gals Hersteller markiert, so dass Verwechselungen nicht naheliegen. Schließlich ist die Zuordnung auch inhaltlich schlüssig: Danach sind sämtliche Zubereitungen mit den besonders teuren monoklonalen Antikörpern durch den Angeklagten hergestellt worden.
1953Der Angeklagte hatte auch die (zeitliche) Gelegenheit, eine Anzahl von 27 Zubereitungen eigenhändig herzustellen. Der Angeklagte gab gegenüber dem Sachverständigen
1954Prof. S zunächst an, am Vortag der Durchsuchung (28.11.2016) gar nicht in derApotheke gewesen zu sein. Die Dokumentation in den Herstellungsprotokollen „sei anzuzweifeln“. Im weiteren Verlauf des Gesprächs mit dem Sachverständigen korrigierte er sich. Er sei bis mittags in der Apotheke gewesen und habe Therapien für den gleichen Tag hergestellt. Auf einen Beweisantrag der Verteidigung hat die Kammer als wahr unterstellt, dass der Angeklagte am Vormittag des 28.11.2016 zwischen 10.30
1955Uhr und 11.30 Uhr in der Praxis der Ärztin Dr. in der 37 zur Be-handlung war; ein Zeitpunkt allerdings, zu dem er auch sonst typischerweise keine Arzneimittelzubereitungen herstellte.
1956Damit bestand für den Angeklagten zu mehreren Zeiten die Gelegenheit, die fraglichen Zubereitungen herzustellen:
1957Zur üblichen Arbeitszeit in den frühen Morgenstunden von 06:00 Uhr bis 06:45 Uhr am
195828.11.2016; die Behauptung gegenüber Prof. S , er habe ausschließlich für dieAuslieferung am gleichen Tag produziert, ist insoweit als Schutzbehauptung anzusehen. Dafür spricht Folgendes: Der Angeklagte selbst gab gegenüber dem Sachver-
1959ständigen Prof. S bei der Darstellung seines gewöhnlichen Tagesablaufs an,dass er zwar regelmäßig frühmorgens zwischen 6.00 Uhr und 6.45 Uhr parenterale
1960Arzneimittelzubereitungen hergestellt habe. Die Fahrer der Apotheke hätten aber
1961![]()
![]()
![]()
![]()
![]()

![]()
![]()
![]()
![]()


![]()
![]()
781
1964gelieferten Daten. Die Kammer hat daran keine Zweifel. Überdies ist es von keinem Verfahrensbeteiligten dargetan worden noch ist es sonst ersichtlich, dass die Daten vor oder gar in Obhut der Ermittlungsbehörden nach Übergabe des Speichermediums (einer CD-ROM) in irgendeiner Weise manipuliert oder verfälscht wurden.
1965Zu den Abrechnungen gegenüber den gesetzlichen Krankenkassen, den dortigen Abläufen bzw. Prüfungen und den Auszahlungen beruhen die Feststellungen auf den
1966überzeugenden Ausführungen der Zeugen W und H :
1967Die Zeugin W ist bei der T als Sachbearbeiterin für die Prü-
1968fung von Arzneimittelabrechnungen tätig. Der Zeuge H leitet als Apotheker bei
1969der A den Bereich Arzneimittel. Beide Zeugen haben die Abläufe bei den
1970 ![]()
![]()
![]()
![]()
Übereinstimmung mit den Ausführungen des Zeugen T als Abrechnungsdienstleister entsprechend der Feststellungen der Kammer geschildert. Insbesondere haben es
1972W und H übereinstimmend als Selbstverständlichkeit bezeichnet, dass die
1973Auskehrung von Geldmitteln an den Abrechnungsdienstleister nicht auto-matisiert „durch einen Computer“ erfolgt, sondern durch „menschliche Mitarbeiter“ im Vier-Augen-Prinzip, was angesichts der enormen Geldbeträge ohnehin auf der Hand
1974![]() liegt: Allein die T gibt monatlich nur für Arzneimittel ihrer Versi-
liegt: Allein die T gibt monatlich nur für Arzneimittel ihrer Versi-
cherten rund 4 Mio. Euro aus. W und H haben auf Nachfrage weiter angege-
1976ben, dass einer Auszahlung stets die Annahme zugrunde liege, die abgerechneten Leistungen seien ordnungsgemäß erbracht worden.
1977Die Kammer folgt diesen überzeugenden und ausgesprochen naheliegenden Ausführungen. Sie hat davon abgesehen, weitere Mitarbeiter anderer Krankenkassen oder sonstiger Kostenträger zur Frage der Abläufe im Abrechnungswesen zu laden.
1978Die Zeugen W und H haben übereinstimmend geschildert, dass dieModalitäten der Abrechnung weitgehend vereinheitlicht sind.
1979Schadensbeträge
1980Die festgestellten monatlichen Schadensbeträge der unberechtigten Abrechnungen beruhen auf einer Schätzung:
1981Da die Kammer keine konkreten Feststellungen treffen konnte, welche einzelnen pa-
1982782
1983renteralen Arzneimittelzubereitungen unterdosiert waren, konnte sie konkrete monatliche Abrechnungsvorgänge und -beträge für unterdosierte Zubereitungen nicht fest-
1984stellen. Die Kammer hat aus diesem Grund anhand der Daten der für dieGesamtzahl der parenteralen Arzneimittelzubereitungen, gesondert für jeden Wirkstoff, eine Berechnung des Preises pro mg des Wirkstoffs vorgenommen. Auf Grundlage der abgerechneten mg-Mengen und der Überlegung, dass für die fehlende Wirk-stoffmenge ein Auszahlungsanspruch nicht bestand, hat die Kammer für jeden Wirkstoff den Abrechnungsbetrag errechnet, der nicht durch eine ordnungsgemäß dosierte Zubereitung gedeckt war.
1985Zugunsten des Angeklagten ist die Kammer dabei von den oben festgestellten Mindestzahlen der unterdosierten Zubereitungen ausgegangen und hat unterstellt, dass die übrigen Zubereitungen ordnungsgemäß waren. Sie hat mithin zugunsten des Angeklagten außer Acht gelassen, dass es möglicherweise (weitere) Zubereitungen gab, die zwar einen Teil der verschriebenen Wirkstoffmenge enthielten, aber - da eben unterdosiert – insgesamt nicht hätten abgerechnet werden dürfen.
1986Mögliche Retaxierungsbeträge, Schwankungen der mg-Mengen und Preisschwankungen hat die Kammer durch einen pauschalen Sicherheitsabschlag von 5 % berücksichtigt, den sie bei jedem einzelnen Wirkstoff angesetzt hat. Auf den Gesamtbetrag hat die Kammer erneut im Wege des Sicherheitsabschlages eine Abrundung vorgenommen. Der Gesamtschadensbetrag von 17.943.846 Euro setzt sich wie folgt zusammen:
1987Bevacizumab
1988Die Kammer hat für den Wirkstoff Bevacizumab 3.006 Taten und eine Durchschnittsgröße von 488 mg zugrunde gelegt. Insoweit rechnete der Angeklagte zu Unrecht eine Gesamtmenge von 1.466.928 mg ab. Hinsichtlich des Wirkstoff Bevacizumab erfolgte die Abrechnung durchschnittlich mit 4,00 Euro/mg, mithin legte die Kammer für diesen Wirkstoff einen Betrag von 5.867.712 Euro zugrunde. Abzüglich des Sicherheitsabschlages von 5 % ergibt sich eine Schadenssumme von 5.574.326 Euro (abgerundet).
1989Bortezomib
1990783
1991Die Kammer hat für den Wirkstoff Bortezomib 498 Taten und eine Durchschnittsgröße von 1,65 mg zugrunde gelegt. Insoweit rechnete der Angeklagte zu Unrecht eine Gesamtmenge von 821 mg (abgerundet) ab. Hinsichtlich des Wirkstoff Bortezomib erfolgte die Abrechnung durchschnittlich mit 480 Euro/mg, mithin legte die Kammer für diesen Wirkstoff einen Betrag von 394.080 Euro zugrunde. Abzüglich des Sicherheitsabschlages von 5 % ergibt sich eine Schadenssumme von 374.376 Euro.
1992Brentuximab
1993Die Kammer hat für den Wirkstoff Brentuximab acht Taten und eine Durchschnittsgröße von 89 mg zugrunde gelegt. Insoweit rechnete der Angeklagte zu Unrecht eine Gesamtmenge von 712 mg ab. Hinsichtlich des Wirkstoff Brentuximab erfolgte die Abrechnung durchschnittlich mit 80 Euro/mg (abgerundet), mithin legte die Kammer für diesen Wirkstoff einen Betrag von 56.960 Euro zugrunde. Abzüglich des Sicherheitsabschlages von 5 % ergibt sich eine Schadenssumme von 54.112 Euro.
1994Cetuximab
1995Die Kammer hat für den Wirkstoff Cetuximab 736 Taten und eine Durchschnittsgröße von 354 mg zugrunde gelegt. Insoweit rechnete der Angeklagte zu Unrecht eine Gesamtmenge von 260.544 mg ab. Hinsichtlich des Wirkstoff Cetuximab erfolgte die Abrechnung durchschnittlich mit 2,80 Euro/mg, mithin legte die Kammer für diesen Wirkstoff einen Betrag von 729.523 Euro (abgerundet) zugrunde. Abzüglich des Sicherheitsabschlages von 5 % ergibt sich eine Schadenssumme von 693.046 Euro (abgerundet).
1996Daratumumab
1997Die Kammer hat für den Wirkstoff Daratumumab eine Tat und eine Durchschnittsgröße von 792 mg zugrunde gelegt. Hinsichtlich des Wirkstoff Daratumumab erfolgte die Abrechnung durchschnittlich mit 6,90 Euro/mg, mithin legte die Kammer für diesen Wirkstoff einen Betrag von 5.464 Euro (abgerundet) zugrunde. Abzüglich des Sicherheitsabschlages von 5 % ergibt sich eine Schadenssumme von 5.190 Euro (abgerundet).
1998784
1999Decitabin
2000Die Kammer hat für den Wirkstoff Decitabin 19 Taten und eine Durchschnittsgröße von 26 mg zugrunde gelegt. Insoweit rechnete der Angeklagte zu Unrecht eine Gesamtmenge von 399 mg ab. Hinsichtlich des Wirkstoff Decitabin erfolgte die Abrechnung durchschnittlich mit 31 Euro/mg (abgerundet), mithin legte die Kammer für diesen Wirkstoff einen Betrag von 12.369 Euro (abgerundet) zugrunde. Abzüglich des Sicherheitsabschlages von 5 % ergibt sich eine Schadenssumme von 11.750 Euro (abgerundet).
2001Denosumab
2002Die Kammer hat für den Wirkstoff Denosumab 2.101 Taten und eine Durchschnittsgröße von 96 mg zugrunde gelegt. Insoweit rechnete der Angeklagte zu Unrecht eine Gesamtmenge von 201.696 mg ab. Hinsichtlich des Wirkstoff Denosumab erfolgte die Abrechnung durchschnittlich mit 3,60 Euro/mg, mithin legte die Kammer für diesen Wirkstoff einen Betrag von 726.105 Euro (abgerundet) zugrunde. Abzüglich des Sicherheitsabschlages von 5 % ergibt sich eine Schadenssumme von 689.799 Euro (abgerundet).
2003Eribulin
2004Die Kammer hat für den Wirkstoff Eribulin 258 Taten und eine Durchschnittsgröße von 1,58 mg zugrunde gelegt. Insoweit rechnete der Angeklagte zu Unrecht eine Gesamtmenge von 407 mg ab. Hinsichtlich des Wirkstoff Eribulin erfolgte die Abrechnung durchschnittlich mit 432 Euro/mg, mithin legte die Kammer für diesen Wirkstoff einen Betrag von 175.824 Euro (abgerundet) zugrunde. Abzüglich des Sicherheitsabschlages von 5 % ergibt sich eine Schadenssumme von 167.032 Euro (abgerundet).
2005Nab-Paclitaxel
2006Die Kammer hat für den Wirkstoff Nab-Paclitaxel 254 Taten und eine Durchschnittsgröße von 181 mg zugrunde gelegt. Insoweit rechnete der Angeklagte zu Unrecht eine Gesamtmenge von 45.974 mg ab. Hinsichtlich des Wirkstoff Nab-Paclitaxel erfolgte die Abrechnung durchschnittlich mit 4,70 Euro/mg, mithin legte die Kammer für diesen
2007785
2008Wirkstoff einen Betrag von 216.077 Euro (abgerundet) zugrunde. Abzüglich des Sicherheitsabschlages von 5 % ergibt sich eine Schadenssumme von 205.273 Euro (abgerundet).
2009Nivolumab
2010Die Kammer hat für den Wirkstoff Nivolumab 208 Taten und eine Durchschnittsgröße von 178 mg zugrunde gelegt. Insoweit rechnete der Angeklagte zu Unrecht eine Gesamtmenge von 37.024 mg ab. Hinsichtlich des Wirkstoff Nivolumab erfolgte die Abrechnung durchschnittlich mit 16,30 Euro/mg (abgerundet), mithin legte die Kammer für diesen Wirkstoff einen Betrag von 603.491 Euro (abgerundet) zugrunde. Abzüglich des Sicherheitsabschlages von 5 % ergibt sich eine Schadenssumme von 573.316 Euro (abgerundet).
2011Obinutuzumab
2012Die Kammer hat für den Wirkstoff Obinutuzumab dreizehn Taten und eine Durchschnittsgröße von 617 mg zugrunde gelegt. Insoweit rechnete der Angeklagte zu Unrecht eine Gesamtmenge von 8.021 mg ab. Hinsichtlich des Wirkstoff Obinutuzumab erfolgte die Abrechnung durchschnittlich mit 3,90 Euro/mg (abgerundet), mithin legte die Kammer für diesen Wirkstoff einen Betrag von 31.281 Euro (abgerundet) zugrunde. Abzüglich des Sicherheitsabschlages von 5 % ergibt sich eine Schadens-summe von 29.716 Euro (abgerundet).
2013Ofatumumab
2014Die Kammer hat für den Wirkstoff Ofatumumab 30 Taten und eine Durchschnittsgröße von 1.280 mg zugrunde gelegt. Insoweit rechnete der Angeklagte zu Unrecht eine Gesamtmenge von 38.400 mg ab. Hinsichtlich des Wirkstoff Ofatumumab erfolgte die Abrechnung durchschnittlich mit 3,10 Euro/mg, mithin legte die Kammer für diesen Wirkstoff einen Betrag von 119.040 Euro zugrunde. Abzüglich des Sicherheitsabschlages von 5 % ergibt sich eine Schadenssumme von 113.088 Euro.
2015786
2016Panitumumab
2017Die Kammer hat für den Wirkstoff Panitumumab 219 Taten und eine Durchschnittsgröße von 331 mg zugrunde gelegt. Insoweit rechnete der Angeklagte zu Unrecht eine Gesamtmenge von 72.489 mg ab. Hinsichtlich des Wirkstoff Panitumumab erfolgte die Abrechnung durchschnittlich mit 6,00 Euro/mg, mithin legte die Kammer für diesen Wirkstoff einen Betrag von 434.934 Euro zugrunde. Abzüglich des Sicherheitsabschlages von 5 % ergibt sich eine Schadenssumme von 413.187 Euro (abgerundet).
2018Pembrolizumab
2019Die Kammer hat für den Wirkstoff Pembrolizumab zwei Taten und eine Durchschnittsgröße von 119 mg zugrunde gelegt. Insoweit rechnete der Angeklagte zu Unrecht eine Gesamtmenge von 238 mg ab. Hinsichtlich des Wirkstoff Pembrolizumab erfolgte die Abrechnung durchschnittlich mit 43,00 Euro/mg, mithin legte die Kammer für diesen Wirkstoff einen Betrag von 10.234 Euro zugrunde. Abzüglich des Sicherheitsabschlages von 5 % ergibt sich eine Schadenssumme von 9.722 Euro (abgerundet).
2020Pemetrexed
2021Die Kammer hat für den Wirkstoff Pemetrexed 142 Taten und eine Durchschnittsgröße von 660 mg zugrunde gelegt. Insoweit rechnete der Angeklagte zu Unrecht eine Gesamtmenge von 93.720 mg ab. Hinsichtlich des Wirkstoff Pemetrexed erfolgte die Abrechnung durchschnittlich mit 4,30 Euro/mg, mithin legte die Kammer für diesen Wirkstoff einen Betrag von 402.996 Euro zugrunde. Abzüglich des Sicherheitsabschlages von 5 % ergibt sich eine Schadenssumme von 382.846 Euro.
2022Pertuzumab
2023Die Kammer hat für den Wirkstoff Pertuzumab 579 Taten und eine Durchschnittsgröße von 338 mg zugrunde gelegt. Insoweit rechnete der Angeklagte zu Unrecht eine Gesamtmenge von 195.702 mg ab. Hinsichtlich des Wirkstoff Pertuzumab erfolgte die Abrechnung durchschnittlich mit 6,80 Euro/mg, mithin legte die Kammer für diesen Wirkstoff einen Betrag von 1.330.773 Euro (abgerundet) zugrunde. Abzüglich des Sicherheitsabschlages von 5 % ergibt sich eine Schadenssumme von 1.264.234 Euro
2024787
2025(abgerundet).
2026Ramucirumab
2027Die Kammer hat für den Wirkstoff Ramucirumab 49 Taten und eine Durchschnittsgröße von 408 mg zugrunde gelegt. Insoweit rechnete der Angeklagte zu Unrecht eine Gesamtmenge von 19.992 mg ab. Hinsichtlich des Wirkstoff Ramucirumab erfolgte die Abrechnung durchschnittlich mit 6,10 Euro/mg, mithin legte die Kammer für diesen Wirkstoff einen Betrag von 121.951 Euro (abgerundet) zugrunde. Abzüglich des Sicherheitsabschlages von 5 % ergibt sich eine Schadenssumme von 115.853 Euro (abgerundet).
2028Rituximab
2029Die Kammer hat für den Wirkstoff Rituximab 684 Taten und eine Durchschnittsgröße von 524 mg zugrunde gelegt. Insoweit rechnete der Angeklagte zu Unrecht eine Gesamtmenge von 358.416 mg ab. Hinsichtlich des Wirkstoff Rituximab erfolgte die Abrechnung durchschnittlich mit 2,00 Euro/mg, mithin legte die Kammer für diesen Wirkstoff einen Betrag von 716.832 Euro zugrunde. Abzüglich des Sicherheitsabschlages von 5 % ergibt sich eine Schadenssumme von 680.990 Euro (abgerundet).
2030Temsirolimus
2031Die Kammer hat für den Wirkstoff Temsirolimus 222 Taten und eine Durchschnittsgröße von 46 mg zugrunde gelegt. Insoweit rechnete der Angeklagte zu Unrecht eine Gesamtmenge von 10.212 mg ab. Hinsichtlich des Wirkstoff Temsirolimus erfolgte die Abrechnung durchschnittlich mit 38 Euro/mg, mithin legte die Kammer für diesen Wirkstoff einen Betrag von 388.056 Euro zugrunde. Abzüglich des Sicherheitsabschlages von 5 % ergibt sich eine Schadenssumme von 368.653 Euro (abgerundet).
2032Trabectedin
2033Die Kammer hat für den Wirkstoff Trabectedin 21 Taten und eine Durchschnittsgröße
2034788
2035von 1,42 mg zugrunde gelegt. Insoweit rechnete der Angeklagte zu Unrecht eine Gesamtmenge von 29 mg (abgerundet) ab. Hinsichtlich des Wirkstoff Trabectedin erfolgte die Abrechnung durchschnittlich mit 2.500 Euro/mg, mithin legte die Kammer für diesen Wirkstoff einen Betrag von 72.500 Euro zugrunde. Abzüglich des Sicherheitsabschlages von 5 % ergibt sich eine Schadenssumme von 68.875 Euro.
2036Trastuzumab
2037Die Kammer hat für den Wirkstoff Trastuzumab 5.286 Taten und eine Durchschnittsgröße von 270 mg zugrunde gelegt. Insoweit rechnete der Angeklagte zu Unrecht eine Gesamtmenge von 1.427.220 mg ab. Hinsichtlich des Wirkstoff Trastuzumab erfolgte die Abrechnung durchschnittlich mit 4,20 Euro/mg, mithin legte die Kammer für diesen Wirkstoff einen Betrag von 5.994.324 Euro zugrunde. Abzüglich des Sicherheitsabschlages von 5 % ergibt sich eine Schadenssumme von 5.694.607 Euro (abgerundet).
2038Trastuzumab Emtansine
2039Die Kammer hat für den Wirkstoff Trastuzumab Emtansine 99 Taten und eine Durchschnittsgröße von 187 mg zugrunde gelegt. Insoweit rechnete der Angeklagte zu Unrecht eine Gesamtmenge von 18.513 mg ab. Hinsichtlich des Wirkstoff Trastuzumab Emtansine erfolgte die Abrechnung durchschnittlich mit 19,50 Euro/mg, mithin legte die Kammer für diesen Wirkstoff einen Betrag von 361.003 Euro (abgerundet) zugrunde. Abzüglich des Sicherheitsabschlages von 5 % ergibt sich eine Schadens-summe von 342.952 Euro (abgerundet).
2040Treosulfan
2041Die Kammer hat für den Wirkstoff Treosulfan 19 Taten und eine Durchschnittsgröße von 5.278 mg zugrunde gelegt. Insoweit rechnete der Angeklagte zu Unrecht eine Gesamtmenge von 100.282 mg ab. Hinsichtlich des Wirkstoff Treosulfan erfolgte die Abrechnung durchschnittlich mit 0,12 Euro/mg, mithin legte die Kammer für diesen Wirkstoff einen Betrag von 12.033 Euro (abgerundet) zugrunde. Abzüglich des Sicherheitsabschlages von 5 % ergibt sich eine Schadenssumme von 11.431 Euro (abgerundet).
2042789
2043Vinblastin
2044Die Kammer hat für den Wirkstoff Vinblastin sieben Taten und eine Durchschnittsgröße von 7,4 mg zugrunde gelegt. Insoweit rechnete der Angeklagte zu Unrecht eine Gesamtmenge von 51 mg (abgerundet) ab. Hinsichtlich des Wirkstoff Vinblastin erfolgte die Abrechnung durchschnittlich mit 20 Euro/mg, mithin legte die Kammer für diesen Wirkstoff einen Betrag von 1.020 Euro zugrunde. Abzüglich des Sicherheitsabschlages von 5 % ergibt sich eine Schadenssumme von 969 Euro.
2045Vinflunin
2046Die Kammer hat für den Wirkstoff Vinflunin 37 Taten und eine Durchschnittsgröße von 452 mg zugrunde gelegt. Insoweit rechnete der Angeklagte zu Unrecht eine Gesamtmenge von 16.724 mg ab. Hinsichtlich des Wirkstoff Vinflunin erfolgte die Abrechnung durchschnittlich mit 6,20 Euro/mg, mithin legte die Kammer für diesen Wirkstoff einen Betrag von 103.688 Euro (abgerundet) zugrunde. Abzüglich des Sicherheitsabschlages von 5 % ergibt sich eine Schadenssumme von 98.503 Euro (abgerundet).
2047Gesamtschaden
2048Insgesamt ergibt sich mithin ein Gesamtschaden von 17.943.846 Euro, den die Kammer pauschal durch einen weiteren Sicherheitsabschlag auf einen Betrag von 17,3 Mio. Euro abgerundet hat.
2049Differenzierung nach Kostenträgern
2050Die Kammer hat im Hinblick auf den Betrag von 17,3 Mio. Euro einen weiteren Abschlag im Hinblick auf eine erforderliche Differenzierung zwischen den gesetzlichen Krankenkassen und sonstigen öffentlich-rechtlichen Kostenträgern mit Sachleistungsprinzip einerseits und privat versicherten Patienten - insoweit war der Betrugsvorwurf gemäß § 154a Abs. 1 StPO auf die gesetzlichen Krankenkassen und sonstigen Kostenträger beschränkt - andererseits vorgenommen. Im Hinblick auf die Berechnungen zum Verhältnis von gesetzlichen Krankenkassen und Kostenträgern zu privat versicherten Patienten ist die Kammer von folgendem Ausgangspunkt ausgegangen:
2051790
2052Der Zeuge KHK H hatte in einem Vermerk vom 24.03.2017, den die Kammer
2053durch Verlesung gemäß § 256 Abs. 1 Nr. 5 StPO in die Hauptverhandlung eingeführt hat, erläutert, dass er 61.934 parenteralen Arzneimittelzubereitungen – dies bezog sich noch auf 36 Wirkstoffe – eine Anzahl von 50.435 Abrechnungspositionen gegenüber gesetzlichen Krankenkassen und Kostenträgern gegenübergestellt habe. Im Rahmen der Schätzung ging die Kammer insoweit davon aus, dass abgerundet 80 % des Wertes der parenteralen Arzneimittelzubereitungen auf die Abrechnungen gegenüber den gesetzlichen Krankenkassen und Kostenträgern entfielen. Ausgehend von dem Gesamtschaden von 17,3 Mio. Euro ergibt sich insoweit bei Zugrundelegung des Anteils der gesetzlichen Krankenkassen und sonstigen Kostenträger von 80 % ein Wert von 13,84 Mio. Euro. Diesen Betrag hat die Kammer gleichmäßig auf die 59 Tatmonate verteilt und für die Betrugstaten einen monatlichen Schadensbetrag von 234.576 Euro (abgerundet) zugrunde gelegt.
2054Für den Monat November 2016 hat die Kammer den Schadensbetrag bei der Gesamt-schadenssumme in Abzug gebracht, so dass sich der gesamte Betrugsschaden auf den Betrag von 13.605.408 Euro addiert.
2055Die Feststellung der Kammer, dass für den Monat November 2016 eine Auszahlung
2056des Abrechnungsbetrages von rund 3 Mio. Euro an die Apotheke nicht erfolgte,beruht wiederum auf den glaubhaften Angaben des Zeugen T , der dies ausführte.
2057Ergänzend hat die Kammer das Schreiben des Steuerberaters des Angeklagten
2058vom 14.02.2017 an den Verteidiger S , welches dieser an die Ermittlungsbehör-
2059den weitergab, durch Verlesung gemäß § 249 Abs. 1 StPO in die Hauptverhandlung eingeführt. In diesem Schreiben wird die Einbehaltung des Abrechnungsbetrages für den Monat November 2016 und die beiden Folgemonate ebenfalls beschrieben.
2060e) Feststellungen zum Vorstellungsbild des Angeklagten und zur Schuldfähigkeit
2061Die Feststellungen zum Vorstellungsbild des Angeklagten und zu seiner Fähigkeit, das Unrecht seiner Taten einzusehen und danach zu handeln, beruht auf einer Gesamtwürdigung der objektiven Umstände, ergänzt durch die Vernehmung der Sachverstän-
2062digen Prof. S und Prof. F .
2063791
2064Vorstellungsbild zu den Unterdosierungen
2065Der Angeklagte verfügte über Kenntnisse und Erfahrungen aus seiner langjährigen beruflichen Praxis als approbierter Apotheker und Fachapotheker für Onkologie. Er war mit den einschlägigen rechtlichen Vorschriften vertraut. Als Fachmann wusste er selbstverständlich, dass die von den Ärzten angeforderten onkologischen Zubereitungen nicht mit einer beliebigen Menge an Wirkstoff (oder womöglich ganz ohne Wirkstoff) herzustellen waren. Die einschlägigen rechtlichen Vorschriften über die Herstellung von Rezepturarzneimitteln waren ihm als Grundlage des traditionell rechtlich stark regulierten Berufs des Apothekers bekannt.
2066Als Fachmann wusste er weiter, dass er jede parenterale Arzneimittelzubereitung anhand der Vorgaben des ärztlichen Therapieprotokolls, die im „Etikett“ wiedergegeben waren, herzustellen hatte. Er wusste, dass er allein entsprechend den Verordnungen dosierte parenterale Arzneimittelzubereitungen herstellen und in Verkehr bringen durfte.
2067Die eigenhändigen Unterdosierungen fertigte er absichtlich in dieser Weise an. Es ist völlig ausgeschlossen, dass es sich beim Handeln des Angeklagten um ein massenhaftes Versehen handeln könnte. Die Vielzahl der objektiv unterdosierten Zubereitungen über Jahre hinweg und die enormen finanziellen Vorteile, die er damit erzielte, lassen die Kammer darauf schließen, dass es sich bei dem Tun des Angeklagten um ein bewusstes, systematisches Vorgehen zur dauerhaften Erzielung erheblicher Gewinne handelte. Dies gilt umso mehr, als sich das Produzieren der Zubereitungen nach
2068den Aussagen der Zeugen K , E und Dr. M nicht etwa als hochanspruchs-volle manuelle Tätigkeit mit entsprechend hoher Fehlerquote darstellt, sondern letztlich als banale, etwas stupide Verrichtung, die Apotheker in aller Regel ihren Hilfskräften überlassen.
2069Hinzu kommt, dass nach den Gutachten der Sachverständigen L und Dr. G stets nur unterdosiert wurde und es bei oft verwendeten Wirkstoffen wie Trastuzumab über die Jahre zu eklatanten Abweichungen von Einkaufsmenge und vermeintlicher Herstellungsmenge kam. So stand bei Trastuzumab im Tatzeitraum für 7.323 Zubereitungen Wirkstoff nur für 1.758 Zubereitungen zur Verfügung; überdies großzügig zu-
2070792
2071gunsten des Angeklagten berechnet mit einem 15 %-igen Zuschlag auf die Einkaufsmenge und der Annahme, dass eine Zubereitung mit nur 80 % der vorgesehen Wirk-stoffmenge noch den Anforderungen genügt (vgl. oben). Bei einem bloßen „Versehen“ wäre doch wohl anzunehmen, dass sich Unter- und Überdosierungen einigermaßen die Waage halten und es dementsprechend auch diese Diskrepanzen nicht geben würde. - In gleicher Weise veranlasste der Angeklagte auch Mitarbeiter bewusst und gewollt (und nicht etwa „versehentlich“) zu Unterdosierungen.
2072Vorstellungen zu den Abrechnungen
2073Dem Angeklagten war als Apotheker selbstverständlich bekannt, dass er nur tatsächlich erbrachte Leistungen abrechnen durfte, andernfalls er aufgrund von Fehlvorstellungen der Mitarbeiter der Kostenträger zu Unrecht Geldzahlungen erhalten würde. Vor dem Hintergrund des soeben dargestellten systematischen Vorgehens kam es ihm gerade darauf an, diese unberechtigten Geldzahlungen zu erlangen, um sich dauerhaft eine erhebliche Einnahmequelle zu erschließen.
2074Finanzielles Motiv des Angeklagten bei Unterdosierung und Abrechnung
2075Das finanzielle Motiv für die Unterdosierungen und die folgenden Falschabrechnungen folgert die Kammer ebenfalls aus den objektiven Umständen: Zeugen, die dem Ange-
2076
![]()
![]()
![]()
![]()
![]() klagten nahestanden, etwa die Mitarbeiterin K - sie bezeichnete sich selbst alseine Freundin des Angeklagten - haben anschaulich dargestellt, dass das Leben des Angeklagten vom Streben nach materiellem Besitz, aber auch dem Präsentieren dieses Besitzes geprägt war. Dies betrifft den Bau der luxuriös ausgestatteten Villa ebenso wie hohe Ausgaben für Alltagsgüter (z. B. Kleidung) und großzügige Geschenke sowie hohe Spenden an gemeinnützige Einrichtungen.
klagten nahestanden, etwa die Mitarbeiterin K - sie bezeichnete sich selbst alseine Freundin des Angeklagten - haben anschaulich dargestellt, dass das Leben des Angeklagten vom Streben nach materiellem Besitz, aber auch dem Präsentieren dieses Besitzes geprägt war. Dies betrifft den Bau der luxuriös ausgestatteten Villa ebenso wie hohe Ausgaben für Alltagsgüter (z. B. Kleidung) und großzügige Geschenke sowie hohe Spenden an gemeinnützige Einrichtungen.
823
2078
![]()
![]()
![]()
![]()
![]()
![]() f) Feststellungen zum weiteren Geschehen und zu den Vermögensverhältnissen des Angeklagten
f) Feststellungen zum weiteren Geschehen und zu den Vermögensverhältnissen des Angeklagten
Die Feststellungen der Kammer zu dem früheren Ermittlungsverfahren gegen den An-
2080geklagten beruhen auf den Angaben des Zeugen U , der schilderte, dass er eineStrafanzeige gegen den Angeklagten gestellt hat. Die Kammer hat das Schreiben des
2081Verteidigers des Angeklagten, Rechtsanwalt S , vom 08.10.2014, mit dem dieser
2082für den Angeklagten zu den Vorwürfen der Strafanzeige des Zeugen U des Jah-
2083res 2013 Stellung nahm, durch Verlesung gemäß § 249 Abs. 1 StPO in die Hauptverhandlung eingeführt.
2084Die Feststellungen zur Strafanzeige des Zeugen P und zu den weiteren Ermitt-
2085lungen beruhen auf den Angaben des Zeugen P und der Zeugin K sowie den
2086Angaben der ermittelnden Polizeibeamten KHK H und KK´in G . Die Zeugenhaben den Ablauf übereinstimmend geschildert. Die Kammer hat keine Zweifel an der Glaubhaftigkeit der Aussagen.
2087Die weiteren Feststellungen zum Tag der Durchsuchung beruhen auf den glaubhaften
2088Angaben der ermittelnden Polizeibeamten KHK H und KK´in G sowie ergän-
2089zend den Angaben des Sachverständigen und Zeugen L , der die sichergestelltenparenteralen Arzneimittelzubereitungen verpackt und transportiert hat. Sie beruhen
2090weiter auf den Angaben der Amtsapothekerin L , die bei der Durchsuchung eben-falls zugegen war. Ergänzend hat die Kammer den Durchsuchungsbericht der Zeugin
2091KK´in G vom 30.11.2016 zu den Räumen in der 37 sowie ein exemp-larisches Sicherstellungsprotokoll durch Verlesen in die Hauptverhandlung eingeführt.
2092Die Feststellungen zu den Vermögensverhältnissen des Angeklagten beruhen vorwie-
2093gend auf den glaubhaften Ausführungen des Finanzermittlers des Zeugen KHK J
2094![]() n. Dieser hat der Kammer plausibel und nachvollziehbar erläutert, dass er anhand
n. Dieser hat der Kammer plausibel und nachvollziehbar erläutert, dass er anhand
824
2096einer Abfrage bei der Bundesanstalt für Finanzdienstleistungsaufsicht die Konten und Depots ermittelt und bei den jeweiligen Finanzunternehmen sodann die Kontostände abgefragt habe. Weitergehend habe er die Grundstücke und entsprechenden Belastungen ermittelt und im Rahmen von Vermerken niedergelegt. Diese Vermerke vom 01.12.2016, 20.12.2016 und vom 05.05.2017 hat die Kammer ergänzend durch Verlesen in die Hauptverhandlung eingeführt. Weiter hat die Kammer - wie bereits zum Geschäftsbetrieb der Apotheke ausgeführt - die Notarverträge zwischen dem Angeklag-
2097ten und seiner Mutter, die das Gebäude 32 und den Apothekenbetriebbetreffen, durch Verlesen in die Hauptverhandlung eingeführt. Die Feststellung, dass
2098der Angeklagte auch Eigentümer des Gebäudes 37 ist, beruht ergänzendauf den verlesenen Notarverträgen vom 07.12.2011 und vom 18.01.2012.
2099g) Keine mikrobielle Kontamination von Zubereitungen
2100Die Feststellung der Kammer, dass für keine einzige in der Anklageschrift aufgeführte Zubereitung eine mikrobielle Kontamination feststellbar war, beruht auf folgender Würdigung:
2101Keine der 117 am 29.11.2016 sichergestellten Zubereitungen ist im Ermittlungsverfahren sachverständig auf mikrobielle oder sonstige Verunreinigungen untersucht worden. Eine nachträgliche Untersuchung während des Zwischen- oder Hauptverfahrens war wegen des Zeitablaufs nicht mehr sinnvoll, zumal die Zubereitungen inzwischen
2102durch die Sachverständigen L und Dr. G auftragsgemäß auf ihren Wirkstoff-gehalt untersucht und dabei geöffnet und teilweise auch verbraucht worden waren.
2103Bei einer Sichtkontrolle der 117 Zubereitungen stellten L und Dr. G keine
2104Verunreinigungen fest. Sichtbare „Fusseln“ wurden von den Sachverständigen als Abbauprodukte von Wirkstoffen oder Wirkstoffklümpchen identifiziert, nicht als von außen eingetragene Schmutzpartikel.
2105Die übrigen, bis einschließlich zum 28.11.2016 hergestellten und ausgelieferten Zubereitungen konnten selbstverständlich nicht sachverständig untersucht werden.
2106Eine Untersuchung des Reinraumlabors auf mikrobielle Verunreinigungen am Tag der Durchsuchung oder im Ermittlungsverfahren wurde nicht durchgeführt. Eine nachträg-
2107825
2108liche Untersuchung während des Zwischen- oder Hauptverfahrens war ebenfalls wegen Zeitablaufs nicht mehr sinnvoll, wobei allerdings der Schluss von einer Verunreinigung des Labors auf eine nicht nur unerhebliche Qualitätsminderung einer Zubereitung im Einzelfall ohnehin kaum mit der für eine Verurteilung erforderlichen Gewissheit gezogen werden kann.
2109Für eine frühere mikrobielle Kontamination des Labors gibt es aber ohnehin keine tragfähigen Anhaltpunkte:
2110![]()
![]()
![]()
![]() Die Kammer hat Prüfberichte der Laborbetriebsgesellschaft vom 18.06.2015, vom 11.03.2015, vom 16.09.2013, vom 04.03.2013, vom 06.09.2012 und vom 24.02.2012 über routinemäßige mikrobiologische Prüfungen der Werkbank des Reinraumlabors verlesen. Danach waren keine signifikanten Keimbelastungen festzustellen. Den Prüfberichten zufolge waren alle Untersuchungsergebnisse aus hygienisch-bakteriologischer Sicht nicht zu beanstanden.
Die Kammer hat Prüfberichte der Laborbetriebsgesellschaft vom 18.06.2015, vom 11.03.2015, vom 16.09.2013, vom 04.03.2013, vom 06.09.2012 und vom 24.02.2012 über routinemäßige mikrobiologische Prüfungen der Werkbank des Reinraumlabors verlesen. Danach waren keine signifikanten Keimbelastungen festzustellen. Den Prüfberichten zufolge waren alle Untersuchungsergebnisse aus hygienisch-bakteriologischer Sicht nicht zu beanstanden.
Daran ändert es nichts, dass die Beweisaufnahme - namentlich die Vernehmung der
2112Mitarbeiter der Apotheke - unzweifelhaft ergeben hat, dass der Angeklagte zu-mindest gelegentlich in Straßenschuhen und ohne Schutzkleidung das Reinraumlabor betrat. Daraus kann allerdings nicht der sichere Schluss gezogen werden, die von ihm - gegebenenfalls - hergestellten Zubereitungen seien mikrobiell kontaminiert gewesen.
2113826
2114IV. Rechtliche Würdigung
2115Der Angeklagte ist strafbar wegen des vorsätzlichen Verstoßes gegen das Arzneimittelgesetz in 14.537 tateinheitlich zusammentreffenden Fällen (uneigentliches Organisationsdelikt), davon in 14.498 Fällen durch das Herstellen und Inverkehrbringen von Arzneimitteln, die durch Abweichung von den anerkannten pharmazeutischen Regeln in ihrer Qualität nicht unerheblich gemindert und die gefälscht waren, und in 39 Fällen durch das Herstellen von Arzneimitteln, die durch Abweichung von den anerkannten pharmazeutischen Regeln in ihrer Qualität nicht unerheblich gemindert und die gefälscht waren, des vorsätzlichen Verstoßes gegen das Arzneimittelgesetz in 27 weiteren (tatmehrheitlichen) Fällen durch das Herstellen von Arzneimitteln, die durch Abweichung von den anerkannten pharmazeutischen Regeln in ihrer Qualität nicht unerheblich gemindert und die gefälscht waren, sowie wegen Betruges in 59 Fällen, wobei es in einem Fall beim Versuch blieb.
21161. Verstöße gegen §§ 95 Abs. 1 Nr. 3a), 8 Abs. 1, 2 AMG
2117Die Kammer hat den Angeklagten wegen insgesamt 14.564 Verstößen gegen das Arzneimittelgesetz verurteilt, davon wegen 14.537 Verstößen, die zu einem (uneigentli-chen) Organisationsdelikt zusammengefasst wurden und wegen weiterer 27 (tatmehrheitlicher) Verstöße.
2118Herstellung oder Inverkehrbringen von Arzneimitteln
2119Bei allen vorliegenden parenteralen Zubereitungen handelt es sich um Arzneimittel im Sinne des § 8 AMG. Arzneimittel im Sinne des Arzneimittelgesetzes sind nach der Legaldefinition des § 2 Abs. 1 Nr. 1 AMG Stoffe oder Zubereitungen aus Stoffen, die zur Anwendung im oder am menschlichen Körper bestimmt sind und als Mittel mit Eigenschaften zur Heilung oder Linderung oder zur Verhütung menschlicher Krankheiten oder krankhafter Beschwerden bestimmt sind. Bei den vom Angeklagten oder seinen Mitarbeitern hergestellten parenteralen Arzneimittelzubereitungen handelt es sich durchweg um solche Arzneimittel, die zur Anwendung im menschlichen Körper bestimmt sind und zur Heilung oder palliativen Behandlung (Linderung) einer onkologi-schen Erkrankung bestimmt sind.
2120827
2121Der Angeklagte hat solche Arzneimittel auch hergestellt. Herstellen umfasst nach der Legaldefinition des § 4 Abs. 14 AMG das Gewinnen, das Anfertigen, das Zubereiten, das Be- oder Verarbeiten, das Umfüllen einschließlich Abfüllen, das Abpacken, das Kennzeichnen und die Freigabe. Die Verbindung einer Trägerlösung mit dem entsprechenden Wirkstoff fällt unter das Tatbestandsmerkmals des Zubereitens. Bei der Fertigung von Spritzen ist ebenfalls das Tatbestandsmerkmal des Zubereitens, jedenfalls das Merkmal des Um- bzw. Abfüllens erfasst. Ein Herstellen ist bei allen Fällen der Verstöße gegen das Arzneimittelgesetz erfolgt.
2122Des Weiteren hat der Angeklagte bei den Taten 1 bis 61.863 der Anklage (also den bis einschließlich am 28.11.2016 hergestellten und ausgelieferten Zubereitungen), soweit er verurteilt worden ist, auch die Variante des Inverkehrbringens erfüllt. Gemäß § 4 Abs. 17 AMG umfasst der Fall des Inverkehrbringens das Vorrätighalten zum Verkauf oder die sonstige Abgabe, das Feilhalten, das Feilbieten und die Abgabe an andere. Die Auslieferung an die behandelnden Ärzte erfasst jedenfalls die Variante der Abgabe.
2123Abweichung von den anerkannten pharmazeutischen Regeln
2124Die der Verurteilung zugrunde liegenden parenteralen Zubereitungen wichen von den anerkannten pharmazeutischen Regeln ab. Abweichungen in diesem Sinne liegen vor, wenn einem Arzneimittel absichtlich nicht die quantitativ ausreichende Menge an Wirk-
2125stoffe beigemischt wird (Nickel in Kügel/M /Hofmann, Arzneimittelgesetz, 2. Aufl.2016, § 8 AMG Rn. 10). Das ist hier bei allen 14.564 Taten der Fall.
2126Nicht unerhebliche Qualitätsminderung
2127Durch die Abweichung von den anerkannten pharmazeutischen Regeln ist auch bei allen 14.564 der Verurteilung zugrunde liegenden parenteralen Arzneimittelzubereitungen eine nicht unerhebliche Minderung der Qualität eingetreten. Gemäß § 4 Abs. 15 AMG erfasst der Begriff der Qualität die Beschaffenheit eines Arzneimittels, die wiederum nach Identität, Gehalt, Reinheit, sonstigen chemischen, physikalischen, biologischen Eigenschaften oder durch das Herstellungsverfahren bestimmt wird. eine
2128Gesundheitsschädlichkeit ist insoweit nicht erforderlich (Nickel in Kügel/M /Hof-mann, AMG, 2. Aufl. 2016, § 8 AMG Rn. 11).
2129828
2130Für den hier maßgeblichen Wirkstoffgehalt gelten dabei Toleranzen, so dass nicht jede noch so geringe Abweichung von der ärztlichen Verschreibung und Deklaration den Tatbestand erfüllt. Bei Fertigarzneimitteln liegt die Toleranz bei 5 %, bei den - hier vorliegenden Rezepturarzneimitteln - liegt die Toleranz bei 10 %.
2131Bei den 14.498 Fällen, die sich auf die bis einschließlich am 28.11.2016 hergestellten und ausgelieferten Zubereitungen beziehen, war für keine der Zubereitungen ein exakter Wirkstoffgehalt zu ermitteln. Für diese 14.498 Zubereitungen stand dem Angeklagten jedenfalls keinerlei Wirkstoff zur Verfügung. Zugunsten des Angeklagten hat die Kammer festgestellt, dass diese Zubereitungen jedenfalls weniger als 80 % des erforderlichen Wirkstoffs enthielten und sich damit deutlich außerhalb der Toleranz bewegten.
2132Zu den weiteren 66 parenteralen Arzneimittelzubereitungen, die am Tag der Durchsuchung, dem 29.11.2016, sichergestellt wurden, ergibt sich die Abweichung aus den exakt nach Prozentzahlen festgestellten Minderdosierungen. Der Wirkstoffgehalt lag jeweils bei mindestens unter 90 %.
2133Eine nicht unerhebliche Qualitätsminderung ist bei keiner Zubereitung durch mikrobielle Kontamination eingetreten. Solche Kontaminationen waren nicht feststellbar.
2134Fälschung im Sinne des § 8 Abs. 2 AMG
2135Der Angeklagte oder einer seiner Mitarbeiter hat zudem in 14.564 Fällen gefälschte Arzneimittel hergestellt und davon in 14.498 Fällen auch in den Verkehr gebracht. Gemäß § 4 Abs. 40 Nr. 1 AMG ist ein gefälschtes Arzneimittel ein Arzneimittel mit falschen Angaben über die Identität, einschließlich seiner Zusammensetzung in Bezug auf einen oder mehrere seiner Bestandteile, einschließlich des Gehalts dieser Bestandteile. Erfasst ist insoweit auch der Fall der Verwendung keines oder eines abwei-
2136chend dosierten Wirkstoffes (vgl. Kügel/Krüger, in Kügel/M /Hofmann, Komm. z.AMG, 2. Aufl. 2016, § 4 Rn. 328).
2137Hinsichtlich der 14.498 Fälle, die die Kammer im Rahmen der gleichartigen Wahlfeststellung festgestellt hat, liegt eine Fälschung durch die Angabe vor, dass die parente-rale Zubereitung einen Wirkstoff in einer konkret auf dem angegeben Menge enthalte, während dies tatsächlich nicht zutraf. Bei den weiteren 66 parenteralen Zubereitungen vom Tag der Durchsuchung ergab sich die Fälschung ebenfalls aus der fehlerhaften
2138829
2139Angabe über den Gehalt eines Wirkstoffs, soweit ein Wirkstoff überhaupt enthalten war, im Übrigen durch die Angabe des Wirkstoffs, der tatsächlich völlig fehlte. Bei den Zubereitungen, die anstelle des Wirkstoffs Trastuzumab den Wirkstoff Pertuzumab enthielten (Fälle 61.866, 61.876, 61.882, 61.884, 61.886, 61.889 der Anklage) lag die Fälschung zudem in der Angabe des fehlerhaften Wirkstoffs. Auf eine gesundheitliche Gefährdung kommt es insoweit nicht an (vgl. Kügel/Krüger, AMG, a.a.O.).
2140Gleichartige Wahlfeststellung
2141Die Kammer hat die Anzahl der 14.498 Verstöße gegen das Arzneimittelgesetz durch das Herstellen und Inverkehrbringen von Arzneimitteln, die durch Abweichung von den anerkannten pharmazeutischen Regeln in ihrer Qualität nicht unerheblich gemindert und die gefälscht waren, im Wege der unechten oder gleichartigen Wahlfeststellung festgestellt.
2142Die gleichartige Wahlfeststellung ist zulässig. Die Kammer hat eine Gesamtzahl von 28.285 Fällen nach laufender Nummer der Anklageschrift, Datum sowie Name und Geburtsdatum des Patienten eindeutig identifiziert. Diese 28.285 Fälle sind unter Punkt II. 2. a) (1) aufgeführt, und zwar aufgeschlüsselt nach Wirkstoffen. Es steht fest, dass der Angeklagte (oder in einzelnen Fällen auf seiner Veranlassung einer seiner Mitarbeiter) in 14.498 dieser 28.285 Fälle unterdosierte parenterale Arzneimittelzubereitungen hergestellt und in Verkehr gebracht hat. In den übrigen Fällen hat die Kammer den Angeklagten freigesprochen (siehe unten).
2143Konkurrenzen
2144Die Kammer hat die im Rahmen der gleichartigen Wahlfeststellung als verwirklicht angesehenen Verstöße gegen das Arzneimittelgesetz, die vor dem Tag der Sicherstellung begangen wurden, zu einer Tat als uneigentliches Organisationsdelikt zusammengefasst. In der Rechtsprechung des Bundesgerichtshofes ist anerkannt, dass einzelne Beiträge eines Täters zur Errichtung, zur Aufrechterhaltung und zum Ablauf eines auf Straftaten ausgerichteten Geschäftsbetriebes zu einer Tat im Rechtssinne zusammengefasst werden können, indem die aus der Unternehmensstruktur heraus begangenen Straftaten in der Person des betreffenden Tatbeteiligten zu einer einheitlichen Tat oder wenigen einheitlichen Taten i. S. d. § 52 Abs. 1 StGB zusammengeführt
2145830
2146werden (vgl. BGH, Beschluss vom 29.7.2009, Az.: 2 StR 160/09 m.w.N.). Das kann namentlich auch für wiederkehrende gleichartige Einzeltaten im Rahmen einer betrieblichen Organisation gelten, die auf diese Weise zu einer einheitlichen Handlung verknüpft werden (vgl. BGH a.a.O. für Betrugstaten).
2147Diese Voraussetzungen sind vorliegend erfüllt: Der Angeklagte hat durch Errichtung
2148des Reinraumlabors und Aufrechterhaltung seines Geschäftsbetriebs der Apo-theke, der hinsichtlich des Laborbetriebes und der parenteralen Zubereitungen maßgeblich auf der Begehung von Verstößen gegen das Arzneimittelgesetz (und Betrugstaten) aufbaute, die erforderliche Unternehmensstruktur geschaffen.
2149Da die Kammer bei den Taten der 14.498 Zubereitungen, die bis einschließlich am 28.11.2016 hergestellt und ausgeliefert wurden, nicht konkret feststellen konnte, welche parenteralen Zubereitungen einerseits von dem Angeklagten eigenhändig oder (in Einzelfällen) auf seine Veranlassung von einem seiner Mitarbeiter hergestellt wurden, hat sie die für erwiesen erachteten Verstöße gegen das Arzneimittelgesetz im Rahmen des uneigentlichen Organisationsdeliktes zusammengefasst. Hierzu hat sie auch 39 Taten der am 29.11.2016 sichergestellten, noch nicht in den Verkehr gebrachten unterdosierten Zubereitungen gefasst, die ausweislich der Herstellungsdokumentation nicht dem Angeklagten als eigenhändigem Hersteller zugeordnet werden konnten.
2150Bei den Taten der 27 am Tag der Durchsuchung sichergestellten unterdosierten pa-renteralen Zubereitungen, die der Angeklagte eigenhändig hergestellt hat, hat die Kammer in Tatmehrheit stehende weitere 27 Einzeltaten des vorsätzlichen Verstoßes gegen das Arzneimittelgesetz angenommen, § 53 StGB.
2151In den 14.498 Fällen, in den sowohl die Tatbestandsvarianten des Herstellens als auch des Inverkehrbringens erfüllt sind, geht die Kammer insoweit von Tateinheit aus, 52 StGB. Das Gleiche gilt in allen Fällen hinsichtlich der Varianten der nicht unerheblichen Qualitätsminderung und der Fälschung.
21522. Keine tateinheitliche Verurteilung wegen Straftaten gegen die körperliche
2153Unversehrtheit
2154Eine Verurteilung des Angeklagten wegen Straftaten gegen die körperliche Unversehrtheit hat die Kammer geprüft, im Ergebnis aber verneint. Im Einzelnen:
2155![]() a) Körperverletzung, § 223 StGB
a) Körperverletzung, § 223 StGB
Der Angeklagte hat sich hinsichtlich der genannten 14.564 Verstöße gegen das Arzneimittelgesetz nicht tateinheitlich der (versuchten) Körperverletzung gemäß § 223 StGB schuldig gemacht.
2157(1) Herstellen und Inverkehrbringen bis einschließlich 28.11.2016
2158Der Angeklagte hat sich nicht durch das Herstellen und Inverkehrbringen der 14.498 unterdosierten Zubereitungen einer tateinheitlich begangenen (versuchten) Körperverletzung gemäß § 223 Abs. 1 StGB strafbar gemacht.
2159Allerdings stellt das Verabreichen unterdosierter onkologischer Medikamente durch einen insoweit gutgläubigen Arzt für den Angeklagten eine tatbestandliche Körperverletzung in mittelbarer Täterschaft im Sinne der § 223 Abs. 1, 25 Abs. 1 Var. 2 StGB dar. Onkologische Medikamente sind hoch toxisch, ihre Einnahme stellt eine nicht nur unerhebliche Beeinträchtigung der körperlichen Unversehrtheit dar, was sich auch anhand der gewöhnlich auftretenden Nebenwirkungen zeigt. Die Einwilligung eines Patienten in die Gabe des Arzneimittels bezieht sich nur auf die Gabe der ärztlich verordneten Dosis. Sofern eine Zubereitung ganz ohne Wirkstoff verabreicht wurde, ist jedenfalls davon auszugehen, dass die Verabreichung über Spritze, Infusion oder Su-refuser, die ebenfalls mit Schmerzen und dem Einbringen der (dann wirkstofffreien) Trägerflüssigkeit in den Körper verbunden ist, ebenfalls nicht von einer wirksamen Einwilligung des unwissenden Patienten gedeckt ist.
2160Hinsichtlich der 14.498 genannten Zubereitungen sind die Voraussetzungen des § 230 StGB jedoch nicht erfüllt:
2161Voraussetzung einer Verurteilung wegen (versuchter) Körperverletzung gemäß § 223 StGB ist gemäß § 230 StGB die Bejahung des besonderen öffentlichen Interesses an der Strafverfolgung durch die Staatsanwaltschaft oder ein Strafantrag des Geschädigten oder eines Angehörigen eines Verstorbenen binnen der gesetzlich vorgesehenen Fristen. Die Staatsanwaltschaft Essen hat das besondere öffentliche Interesse an der Strafverfolgung ausdrücklich nur für die unterdosierten Zubereitungen der Taten 61.864 bis 61.930 der Anklage (dazu sogleich) bejaht und insoweit auch nur 27 Taten
2162832
2163der (versuchten) Körperverletzung zur Anklage gebracht.
2164Verfolgbar ist eine (versuchte) Körperverletzung also nur in denjenigen der 14.498 Fälle, in denen ein (mutmaßlich) Geschädigter einen Strafantrag gestellt hat. Strafanträge sind zwar von einigen Patienten wirksam gestellt worden. Doch da die 14.498 Fälle im Wege der gleichartigen Wahlfeststellung bestimmt worden sind, ist zugunsten des Angeklagten davon auszugehen, dass sich die Anträge auf diejenigen Fälle bezieht, hinsichtlich derer ein Strafantrag nicht gestellt wurde und hinsichtlich derer auch eine Verurteilung im Rahmen der gleichartigen Wahlfeststellung nicht erfolgt ist. Dazu im Einzelnen:
2165Wirksame, insbesondere nicht ausschließbar innerhalb der Frist des § 77b StGB eingereichte Strafanträge, haben folgende Patienten gestellt:
2166![]() -
-


![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() Bevacizumab
Bevacizumab
Für Fälle mit Zubereitungen mit dem Wirkstoff Bevacizumab liegen von den Patienten
2170
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() elf Taten der Anklage, insgesamt gibt es mithin für 41 Fälle der Anklage mit dem Wirkstoff Bevacizumab einen Strafantrag. Im Rahmen der gleichartigen Wahlfeststellung hat die Kammer hinsichtlich des Wirkstoffs Bevacizumab einen Verstoß festgestellt für 3.006 Fälle der Anklage und den Angeklagten im Übrigen hinsichtlich der 1.437 weiteren Fälle nicht verurteilt. Die Kammer nimmt zugunsten des Angeklagten an, dass sich die Strafanträge für 41 Fälle auf die 1.437 Fälle beziehen, hinsichtlich derer der Angeklagte nicht verurteilt wurde.
elf Taten der Anklage, insgesamt gibt es mithin für 41 Fälle der Anklage mit dem Wirkstoff Bevacizumab einen Strafantrag. Im Rahmen der gleichartigen Wahlfeststellung hat die Kammer hinsichtlich des Wirkstoffs Bevacizumab einen Verstoß festgestellt für 3.006 Fälle der Anklage und den Angeklagten im Übrigen hinsichtlich der 1.437 weiteren Fälle nicht verurteilt. Die Kammer nimmt zugunsten des Angeklagten an, dass sich die Strafanträge für 41 Fälle auf die 1.437 Fälle beziehen, hinsichtlich derer der Angeklagte nicht verurteilt wurde.
Bortezomib
2172![]() Für Fälle mit Zubereitungen mit dem Wirkstoff Bortezomib liegt nur von der Patientin ein wirksamer Strafantrag vor, dies betrifft insgesamt 43 Taten der Anklage. Im Rahmen der gleichartigen Wahlfeststellung hat die Kammer hinsichtlich des Wirkstoffs Bortezomib einen Verstoß festgestellt für 498 Fälle der Anklage und den Angeklagten im Übrigen hinsichtlich der 1.959 weiteren Fälle nicht verurteilt. Die Kammer nimmt zugunsten des Angeklagten an, dass sich der Strafantrag für 43 Fälle auf die 1.959 Fälle bezieht hinsichtlich derer der Angeklagte nicht verurteilt wurde.
Für Fälle mit Zubereitungen mit dem Wirkstoff Bortezomib liegt nur von der Patientin ein wirksamer Strafantrag vor, dies betrifft insgesamt 43 Taten der Anklage. Im Rahmen der gleichartigen Wahlfeststellung hat die Kammer hinsichtlich des Wirkstoffs Bortezomib einen Verstoß festgestellt für 498 Fälle der Anklage und den Angeklagten im Übrigen hinsichtlich der 1.959 weiteren Fälle nicht verurteilt. Die Kammer nimmt zugunsten des Angeklagten an, dass sich der Strafantrag für 43 Fälle auf die 1.959 Fälle bezieht hinsichtlich derer der Angeklagte nicht verurteilt wurde.
Cetuximab
2174![]() 834
834
Für Fälle mit Zubereitungen mit dem Wirkstoff Cetuximab liegt nur von dem Patienten
2176ein wirksamer Strafantrag vor, dies betrifft insgesamt 13 Taten der Anklage. Im Rahmen der gleichartigen Wahlfeststellung hat die Kammer hinsichtlich des Wirkstoffs Cetuximab einen Verstoß festgestellt für 736 Fälle der Anklage und den Angeklagten im Übrigen hinsichtlich der 577 weiteren Fälle nicht verurteilt. Die Kammer nimmt zugunsten des Angeklagten an, dass sich der Strafantrag für 13 Fälle auf die 577 Fälle bezieht, hinsichtlich derer der Angeklagte nicht verurteilt wurde.
2177Denosumab
2178Für Fälle mit Zubereitungen mit dem Wirkstoff Denosumab liegen von den Patienten
2179Strafanträge vor. Dies betrifft für den Patienten 25 Fälle
2180der Anklage, die Patientin zwei Fälle, die Patientin • 27 Fälle der Anklage, die
2181Patientin 32 Fälle der Anklage, die Patientin 27 Fälle der
2182Anklage und für den Patienten 17 Taten der Anklage, insgesamt gibt es mithinfür 130 Fälle der Anklage mit dem Wirkstoff Denosumab einen Strafantrag. Im Rahmen der gleichartigen Wahlfeststellung hat die Kammer hinsichtlich des Wirkstoffs Deno-sumab einen Verstoß festgestellt für 2.101 Fälle der Anklage und den Angeklagten im Übrigen hinsichtlich der 3.014 weiteren Fälle nicht verurteilt. Die Kammer nimmt zugunsten des Angeklagten an, dass sich die Strafanträge für 130 Fälle auf die 3.014 Fälle beziehen, hinsichtlich derer der Angeklagte nicht verurteilt wurde.
2183Nab-Paclitaxel
2184Für Fälle mit Zubereitungen mit dem Wirkstoff Nab-Paclitaxel liegt nur von der Patien-
2185tin ein wirksamer Strafantrag vor, dies betrifft insgesamt zwei Taten derAnklage. Im Rahmen der gleichartigen Wahlfeststellung hat die Kammer hinsichtlich des Wirkstoffs Nab-Paclitaxel einen Verstoß festgestellt für 254 Fälle der Anklage und den Angeklagten im Übrigen hinsichtlich der 699 weiteren Fälle nicht verurteilt. Die Kammer nimmt zugunsten des Angeklagten an, dass sich der Strafantrag für zwei Fälle auf die 699 Fälle bezieht hinsichtlich derer der Angeklagte nicht verurteilt wurde.
2186835
2187Pembrolizumab
2188Für Fälle mit Zubereitungen mit dem Wirkstoff Pembrolizumab liegt nur von der Pati-
2189entin ein wirksamer Strafantrag vor, dies betrifftnur die Tat 61.358 der Anklage. Im Rahmen der gleichartigen Wahlfeststellung hat die Kammer hinsichtlich des Wirkstoffs Pembrolizumab einen Verstoß festgestellt für zwei Fälle der Anklage und den Angeklagten im Übrigen hinsichtlich der 17 weiteren Fälle nicht verurteilt. Die Kammer nimmt zugunsten des Angeklagten an, dass sich der Strafantrag für einen Fall auf die 17 Fälle bezieht, hinsichtlich derer der Angeklagte nicht verurteilt wurde.
2190Pemetrexed
2191![]() Für Fälle mit Zubereitungen mit dem Wirkstoff Pemetrexed liegt nur von dem Patienten ein wirksamer Strafantrag vor, dies betrifft vier Taten der Anklage. Im Rahmen der gleichartigen Wahlfeststellung hat die Kammer hinsichtlich des Wirkstoffs Pemetrexed einen Verstoß festgestellt für 142 Fälle der Anklage und den Angeklagten im Übrigen hinsichtlich der 276 weiteren Fälle nicht verurteilt. Die Kammer nimmt zugunsten des Angeklagten an, dass sich der Strafantrag für vier Fälle auf die 276 Fälle bezieht hinsichtlich derer der Angeklagte nicht verurteilt wurde.
Für Fälle mit Zubereitungen mit dem Wirkstoff Pemetrexed liegt nur von dem Patienten ein wirksamer Strafantrag vor, dies betrifft vier Taten der Anklage. Im Rahmen der gleichartigen Wahlfeststellung hat die Kammer hinsichtlich des Wirkstoffs Pemetrexed einen Verstoß festgestellt für 142 Fälle der Anklage und den Angeklagten im Übrigen hinsichtlich der 276 weiteren Fälle nicht verurteilt. Die Kammer nimmt zugunsten des Angeklagten an, dass sich der Strafantrag für vier Fälle auf die 276 Fälle bezieht hinsichtlich derer der Angeklagte nicht verurteilt wurde.
Pertuzumab
2193Für Fälle mit Zubereitungen mit dem Wirkstoff Pertuzumab liegen von den Patienten
2194
|
, |
, |
, |
, |
S r, |
, und Strafanträge vor. Dies betrifft für
2196die Patientin M vier Fälle der Anklage, die Patientin 26 Fälle, die Patientin
2197sechs Fälle der Anklage, die Patientin einen Fall der Anklage, die
2198![]()
![]()
![]()
![]()
![]() klage, die Patientin eine Tat der Anklage und für die Patientin sechs
klage, die Patientin eine Tat der Anklage und für die Patientin sechs
Taten der Anklage, insgesamt gibt es mithin für 85 Fälle der Anklage mit dem Wirkstoff Pertuzumab einen Strafantrag. Im Rahmen der gleichartigen Wahlfeststellung hat die Kammer hinsichtlich des Wirkstoffs Pertuzumab einen Verstoß festgestellt für 579 Fälle der Anklage und den Angeklagten im Übrigen hinsichtlich der 388 weiteren Fälle
2200836
2201nicht verurteilt. Die Kammer nimmt zugunsten des Angeklagten an, dass sich die Strafanträge für 85 Fälle auf die 388 Fälle beziehen hinsichtlich derer der Angeklagte nicht verurteilt wurde.
2202Trabectedin
2203Für Fälle mit Zubereitungen mit dem Wirkstoff Trabectedin liegt nur von der Patientin
2204ein wirksamer Strafantrag vor, dies betrifft fünf Taten der Anklage. Im Rahmen der gleichartigen Wahlfeststellung hat die Kammer hinsichtlich des Wirkstoffs Trabectedin einen Verstoß festgestellt für 21 Fälle der Anklage und den Angeklagten im Übrigen hinsichtlich der 78 weiteren Fälle nicht verurteilt. Die Kammer nimmt zugunsten des Angeklagten an, dass sich der Strafantrag für fünf Fälle auf die 78 Fälle bezieht hinsichtlich derer der Angeklagte nicht verurteilt wurde.
2205Trastuzumab
2206Für Fälle mit Zubereitungen mit dem Wirkstoff Trastuzumab liegen von den Patienten
2207n ![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() und ■ Strafanträge vor. Dies betrifft für die Patientin ■■
und ■ Strafanträge vor. Dies betrifft für die Patientin ■■
13 Fälle der Anklage, die Patientin 26 Fälle, die Patientin 19 Fälle der
2209Anklage, die Patientin einen Fall der Anklage, die Patientin ■ 85 Taten
2210der Anklage, die Patientin zwölf Taten der Anklage, die Patientin 36
2211Fälle der Anklage, die Patientin 22 Taten der Anklage, die Patientin 17
2212Fälle der Anklage, die Patientin 18 Taten der Anklage und für die Patientin
2213acht Taten der Anklage, insgesamt gibt es mithin für 264 Fälle der Anklage mit dem Wirkstoff Trastuzumab einen Strafantrag. Im Rahmen der gleichartigen Wahlfeststellung hat die Kammer hinsichtlich des Wirkstoffs Trastuzumab einen Verstoß festgestellt für 5.286 Fälle der Anklage und den Angeklagten im Übrigen hinsichtlich der 2.037 weiteren Fälle nicht verurteilt. Die Kammer nimmt zugunsten des Angeklagten an, dass sich die Strafanträge für 264 Fälle auf die 2.037 Fälle beziehen hinsichtlich derer der Angeklagte nicht verurteilt wurde.
2214837
2215(2) Am 29.11.2016 sichergestellte Zubereitungen
2216Bei den Taten 61.864, 61.865, 61.867 bis 61.874, 61.877 bis 61.881, 61.883, 61.888, 61.890, 61.892 bis 61.896, 61.902, 61.903, 61.912 und 61.928 der Anklage hat die Staatsanwaltschaft ausweislich des ausdrücklichen Wortlauts der Anklage das besondere öffentliche Interesse an der Strafverfolgung bejaht. Hinsichtlich dieser und aller anderen am 29.11.2016 sichergestellten Zubereitungen liegen die Voraussetzungen weder für eine vollendete noch für eine versuchte Körperverletzung gemäß § 223 Abs. 1StGB vor.
2217In diesen Fällen wurden die unterdosierten Zubereitungen sichergestellt und daher nicht an die behandelnden Ärzte ausgeliefert und nicht den Patienten verabreicht, so dass eine vollendete Körperverletzung mangels Taterfolgs ausscheidet.
2218In diesen Fällen liegt aber auch keine versuchte Körperverletzung gemäß §§ 223 Abs. 1, 2, 22, 23 StGB vor. Der Angeklagte hat nach seiner Vorstellung von der Tat zur Verwirklichung des Tatbestands nicht unmittelbar angesetzt. Ein unmittelbares Ansetzen ist nach ständiger Rechtsprechung nicht erst dann gegeben, wenn der Täter ein Tatbestandsmerkmal verwirklicht, sondern schon dann, wenn er Handlungen vornimmt, die nach seinem Tatplan der Erfüllung eines Tatbestandsmerkmals vorgelagert sind und in die Tatbestandshandlung unmittelbar einmünden. Das Versuchsstadium erstreckt sich dementsprechend auf Handlungen, die im ungestörten Fortgang unmittelbar zur Tatbestandserfüllung führen sollen oder die im unmittelbaren räumlichen und zeitlichen Zusammenhang mit ihr stehen; der Täter muss subjektiv die Schwelle zum „jetzt geht es los“ überschreiten und objektiv zur tatbestandsmäßigen Angriffshandlung ansetzen, so dass sein Tun ohne Zwischenakte in die Tatbestandserfüllung übergeht (vgl. BGH, Beschluss vom 08.05.2018, Az.: 5 StR 108/18 m.w.N.).
2219Die Voraussetzungen eines unmittelbaren Ansetzens liegen nicht vor: Entsprechend der Feststellungen der Kammer bedurfte es einer morgendlichen Freigabe der auszuliefernden parenteralen Arzneimittelzubereitungen durch den Angeklagten oder einen seiner Mitarbeiter gegenüber dem Fahrer, der die jeweilige Auslieferung durchzuführen hatte. Diese Freigabe war am Morgen der Durchsuchung am 29.11.2016 im Zeitpunkt der Sicherstellung noch nicht erfolgt. Weder ein Fahrer noch der Angeklagte oder ein Mitarbeiter des Reinraumlabors waren im Zeitpunkt des Eintreffens der Polizeibeamten anwesend. Aus Sicht des Angeklagten gab es im Zeitpunkt seiner letzten
2220838
2221Handlung am Vortag der Durchsuchung noch den Zwischenakt der Freigabe durch ihn selbst oder einen seiner Mitarbeiter. Dieser Zwischenakt der Freigabe hindert die Annahme, dass der Angeklagte bereits am Vortag annahm, dass sein Handeln des Her-stellens ohne weitere Zwischenakte in die Vollendung übergehen würde. So bestand für den Angeklagten insbesondere noch die Möglichkeit, alle oder einzelne parenterale Arzneimittelzubereitungen zu entnehmen, ggf. neu herzustellen oder auszutauschen.
2222b) Gefährliche Körperverletzung, § 224 StGB
2223Der Angeklagte hat sich in keinem Fall der 14.564 Verstöße gegen das Arzneimittelgesetz einer tateinheitlich dazu begangenen (versuchten) gefährlichen Körperverletzung gemäß § 224 Abs. 1 StGB strafbar gemacht.
2224Bei den am Tag der Durchsuchung sichergestellten 66 Zubereitungen fehlt es wiederum am unmittelbaren Ansetzen der Tatbestandsverwirklichung. Die Kammer nimmt Bezug auf ihre Ausführungen zur einfachen Körperverletzung gemäß § 223 StGB. Hinsichtlich der weiteren 14.498 Taten des Organisationsdeliktes liegen die Qualifikationsmerkmale des § 224 Abs. 1 StGB nicht vor:
2225§ 224 Abs. 1 Nr. 1 StGB: Beibringung von Gift oder eines anderen gesundheitsschädlichen Stoffes
2226Die Tatbestandsvariante des § 224 Abs. 1 Nr. 1 StGB ist weder vollendet noch versucht. Unter den Begriff des Giftes fällt jeder organische oder anorganische Stoff, der durch chemische oder chemisch-physikalische Wirkung nach seiner Art und der vom Täter eingesetzten Menge im konkreten Fall geeignet ist, ernsthafte Gesundheitsschäden hervorzurufen. Ein anderer gesundheitsschädlicher Stoff liegt bei solchen Stoffen vor, die sich von selbst auf mechanische oder thermische Weise nachteilig auf die Gesundheit des Menschen auswirken. Eine Beibringung liegt vor, wenn der Täter eine Verbindung des Giftes bzw. des Stoffes mit dem Körper derart herstellt, dass das Gift oder der Stoff dort seine gesundheitsschädliche Wirkung entfaltet.
2227Die verabreichten unterdosierten Medikamente sind bei bestimmungsgemäßer Verwendung weder Gifte noch andere gesundheitsschädliche Stoffe, da sie mit dem Ziel der Gesundheitsförderung und -verbesserung verabreicht werden. Mit Blick auf die
2228839
2229Unterdosierungen kann auch nicht auf ein Unterlassen abgestellt werden. Der Qualifikationstatbestand soll die besondere Gefährlichkeit einer Körperverletzung erfassen, die durch die Verwendung der genannten Tatmittel eintritt. Ein Unterlassen entspricht hier nicht im Sinne des § 13 Abs. 1 StGB der Verwirklichung des gesetzlichen Tatbestands.
2230§ 224 Abs. 1 Nr. 4 StGB: Mit einem anderen Beteiligten gemeinschaftlich
2231Die Tatbestandvariante des § 224 Abs. 1 Nr. 4 StGB ist weder vollendet noch versucht. Eine gemeinschaftliche Beteiligung des Angeklagten mit einem seiner Mitarbeiter ist für keinen konkreten Fall festzustellen. Die Kammer nimmt zwar an, dass in Einzelfällen Mitarbeiter auf Veranlassung des Angeklagten unterdosierte Zubereitungen herstellten. Da jedoch weder eine bestimmte Tat zu identifizieren noch eine Mindestzahl derartiger Unterdosierungen oder ein Wirkstoff, auf den sie sich bezogen haben, zu bestimmen war, scheidet eine Verurteilung aus
2232§ 224 Abs. 1 Nr. 5 StGB: Mittels einer das Leben gefährdenden Behandlung
2233Die Tatbestandsvariante des § 224 Abs. 1 Nr. 5 StGB ist ebenfalls weder vollendet noch versucht. Eine lebensgefährdende Behandlung setzt voraus, dass die Behandlung objektiv generell geeignet ist, ein Opfer in Lebensgefahr zu bringen. Dies hat die Kammer nicht festgestellt.
2234c) Totschlag/Mord, §§ 211, 212 StGB
2235Der Angeklagte hat sich auch nicht des (versuchten) Totschlags oder Mordes, auch nicht durch Unterlassen, strafbar gemacht. Die Kammer konnte insoweit keine hinreichenden Feststellungen mit dem für eine Verurteilung erforderlichen Grad an Wahrscheinlichkeit treffen.
2236Bei den am Tag der Durchsuchung sichergestellten 66 Zubereitungen fehlt es bereits am unmittelbaren Ansetzen der Tatbestandsverwirklichung. Die Kammer nimmt insoweit Bezug auf ihre Ausführungen zur Körperverletzung gemäß § 223 StGB.
2237Bei den 14.498 Fällen des Organisationsdeliktes konnte die Kammer nicht feststellen,
2238840
2239dass ein Patient aufgrund einer unterdosierten Zubereitung des Angeklagten (früher) verstorben ist. Dies scheiterte bereits daran, dass wegen der Wahlfeststellung letztlich offen blieb, welche Zubereitungen im Einzelnen betroffen waren.
2240Eine Strafbarkeit des Angeklagten wegen eines versuchten Tötungsdeliktes hat die Kammer nicht angenommen: Es fehlt bereits am Tatentschluss, da der der Angeklagte nicht feststellbar damit rechnete, dass einer der betroffenen Patienten aufgrund einer bestimmten unterdosierten Zubereitungen zu Tode kommen oder zu einem früheren Zeitpunkt sterben würde.
22413. Betrug, § 263 Abs. 1 StGB
2242Der Angeklagte hat sich durch die monatlichen Abrechnungen gegenüber den Kostenträgern jeweils des Betruges in 59 tatmehrheitlichen Fällen, davon in einem Fall des Versuchs, gemäß § 263 Abs. 1 StGB bzw. §§ 263 Abs. 1, 2, 22, 23 StGB strafbar gemacht.
2243Täuschung
2244Der Angeklagte hat die Kostenträger getäuscht. Eine Täuschungshandlung ist jede Einwirkung des Täters auf die Vorstellung des Getäuschten, die geeignet und dazu bestimmt ist, beim Adressaten der Erklärung eine Fehlvorstellung über tatsächliche Umstände hervorzurufen. Sie besteht in der Vorspiegelung falscher oder in der Entstellung oder Unterdrückung wahrer Tatsachen. Welchen Erklärungswert eine konklu-dent abgegebene Äußerung besitzt, beurteilt sich nach dem Empfängerhorizont und der Verkehrsanschauung. Ein Apotheker, der am Abrechnungssystem der Krankenkassen teilnimmt, erklärt bei den Abrechnungen stillschweigend, dass er bestehende sozialrechtliche Erstattungsansprüche für tatsächlich durchgeführte Apothekengeschäfte geltend macht (vgl. BGH, Urteil vom 12.02.2015, Az.: 2 StR 109/14 m.w.N.).
2245Die entsprechende Erklärung des Angeklagten war in den Fällen, die seiner Verurteilung zu Grunde liegen, falsch: Der Angeklagte hat durch das Einreichen taxierter Re-
2246zepte bei der die Kostenträger über die Tatsache der Unterdosierungengetäuscht und die Erbringung ordnungsgemäßer abrechenbarer Leistungen vorge-
2247spiegelt. Die Einschaltung der deren Mitarbeiter gutgläubig waren, führt
2248841
2249zu einer mittelbaren Täterschaft des Angeklagten. Sie ändert nichts am Erklärungswert der an die Kostenträger weitergereichten Abrechnungen (vgl. BGH, Urteil vom 12.02.2015, Az.: 2 StR 109/14). Mit jeder monatlichen Sammelabrechnung des Ange-
2250klagten über die lag eine Täuschungshandlung vor.
2251Irrtum
2252Die Mitarbeiter der Kostenträger unterlagen im Hinblick auf die Erklärungen des Angeklagten einem Irrtum: Die Täuschung durch den Angeklagten führte auf Seiten der Mitarbeiter der Kostenträger, die davon ausgingen, dass die abgerechneten parenter-alen Arzneimittelzubereitungen ordnungsgemäß dosiert waren, zu einem Irrtum über den Erstattungsanspruch des Angeklagten. Eine Überprüfung und Feststellung der Mitarbeiter der Kostenträger, dass die parenteralen Arzneimittelzubereitungen unterdosiert waren, war faktisch nicht möglich. Wäre den Mitarbeitern bekannt gewesen, dass der Angeklagte tatsächlich unterdosierte parenterale Arzneimittelzubereitungen abrechnete, die nicht abrechnungsfähig waren, so wäre eine Retaxation jeweils auf Null erfolgt, da dem Angeklagten tatsächlich kein Erstattungsanspruch zustand.
2253Die Mitarbeiter hatten an der ordnungsgemäßen Dosierung der abgerechneten Zubereitungen und an dem Erstattungsanspruch des Angeklagten keine Zweifel, die geeignet gewesen wären, einen Irrtum auszuschließen. Aus den Rezepten selbst ergaben sich keine Anhaltspunkte für die Unterdosierung.
2254Bei Betrugsvorwürfen im Zusammenhang mit standardisierten, auf Massenerledigung angelegten Abrechnungsverfahren ist es nicht erforderlich, dass der jeweilige Mitarbeiter hinsichtlich jeder einzelnen geltend gemachten Position die positive Vorstellung hatte, sie sei nach Grund und Höhe berechtigt; vielmehr genügt die stillschweigende Annahme, die ihm vorliegende Abrechnung sei insgesamt in Ordnung. Daher setzt ein Irrtum auch nicht voraus, dass tatsächlich eine Überprüfung der Abrechnungen im Einzelfall durchgeführt wurde (vgl. BGH, Urteil vom 12.02.2015, Az.: 2 StR 109/14 m.w.N.). Ausreichend ist insoweit ein sachgedankliches Mitbewusstsein der Mitarbeiter der Kostenträger, das die Annahme einschloss, allen Abrechnungen des Angeklagten hätten ordnungsgemäß dosierte Arzneimittelabgaben in der Apotheke zu Grunde gelegen. Das Abrechnungssystem ist auf das Vertrauen gestützt, dass die Apotheker keine Rezepte zur Abrechnung tatsächlich unterdosierter Arzneimittelzubereitungen
2255842
2256einreichen. Insoweit entspricht es dem normativen Vorstellungsbildes des jeweiligen Mitarbeiters des Kostenträgers, dass einer Rezeptabrechnung auch die abgerechnete Leistung zugrunde liegt.
2257Weil es um das grundsätzliche Mitbewusstsein der Geltendmachung eines tatsächlich bestehenden sozialrechtlichen Erstattungsanspruchs ging, bedurfte es weder einer Individualisierung des jeweils handelnden Mitarbeiters der Krankenkassen und Kostenträger noch der Feststellung seiner individuellen Vorstellungen (vgl. BGH, Urteil vom 12.02.2015, Az.: 2 StR 109/14 m.w.N.). Daher bedurfte es auch nicht der Vernehmung der Mitarbeiter aller Kostenträger durch die Kammer.
2258Vermögensverfügung/Vermögensschaden
2259Die Kostenträger zahlten auf die Sammelabrechnungen jeweils den Betrag, der für ordnungsgemäß dosierte parenterale Arzneimittelzubereitung ausgewiesen war, in der Annahme aus, dass die abgerechnete Leistung tatsächlich erbracht war. Soweit für den Monat November 2016 die Auszahlung durch die Kostenträger nicht erfolgt ist, hat die Kammer eine Versuchsstrafbarkeit des Angeklagten, der die Taxierungen entsprechend der Vormonate für ordnungsgemäß dosierte Zubereitungen vorgenommen hatte, angenommen.
2260Durch diese Vermögensfügung ist dem Vermögen der Kostenträger ein Schaden entstanden, weil eine Vergütung von Zubereitungen erfolgte, die nicht ordnungsgemäß dosiert und damit wertlos waren. Die Kammer nimmt dabei an, dass eine unterdosierte Zubereitung unabhängig vom Grad der Unterdosierung vollständig wertlos war, also nicht etwa eine Zubereitung, die 50 % des deklarierten Wirkstoffs enthielt, noch einen Wert von 50 % hatte. Denn sobald eine Zubereitung nicht die erforderliche Menge an Wirkstoff enthielt, konnte sie nicht mehr verwendet werden (vgl. BGH, Urteil vom 04.09.2012, Az.: 1 StR 534/11).
2261Die so genannte "Stoffgleichheit" zwischen der Vermögensverfügung und dem Vermö-
2262gensschaden ist gegeben. Unerheblich ist, dass die als Verrechnungs-stelle zwischengeschaltet war, diese hat nur eine Botenfunktion ausgeübt.
2263Die Kammer war befugt, den entstandenen Schaden zu schätzen, da sie - mit Blick auf die Wahlfeststellung - die konkreten Abrechnungsbeträge nicht heranziehen konnte. Die Grundlagen der Schätzung sind in der Beweiswürdigung dargelegt.
2264843
2265Den Gesamtschaden hat die Kammer auf die einzelnen Monate gleichmäßig verteilt.
2266Vermögensschädigungsabsicht/Vorsatz
2267Dem Angeklagten waren sämtliche objektiven Umstände bekannt. Ihm kam es auf die Schädigung des Vermögens der Kostenträger zur Erhöhung des eigenen Gewinns an.
2268Rechtswidrigkeit und Schuld
2269Der Angeklagte handelte rechtswidrig und schuldhaft. Anhaltspunkte für einen Rücktritt vom Versuch (Betrugstat hinsichtlich der Abrechnung für den Monat November 2016) sind nicht ersichtlich, die Auszahlung des Schadensbetrages wurde von den Kostenträgern aufgrund der Kenntnis von der Inhaftierung des Angeklagten zurückgehalten, mithin ohne ein Zutun des Angeklagten.
2270Konkurrenzen
2271Die 58 Taten des vollendeten Betruges und die Tat des versuchten Betruges, die jeweils den Zeitraum eines Monats umfassen, stehen zueinander im Verhältnis der Tatmehrheit, § 53 StGB.
22724. Konkurrenzen
2273Die Taten der Verstöße gegen das Arzneimittelgesetz stehen zu den Taten des Betruges in Tatmehrheit, § 53 StGB.
2274844
2275V. Strafzumessung
22761. Verstöße gegen das Arzneimittelgesetz
2277a) Strafrahmen
2278Die Kammer hat für jede der 28 Taten (Organisationsdelikt und 27 weitere Taten des Verstoßes gegen das Arzneimittelgesetz) den Strafrahmen des besonderen schweren Falles nach § 95 Abs. 3 AMG von einem Jahr bis zu zehn Jahren zugrunde gelegt:
2279Der Angeklagte hat durch den als Organisationsdelikt zusammengefassten Verstoß gegen das Arzneimittelgesetz [Tenor zu I. 1. a)] das Regelbeispiel des § 95 Abs. 3 S. 2 Nr. 1 c) AMG, Erlangen eines Vermögensvorteils großen Ausmaßes für sich aus grobem Eigennutz, erfüllt:
2280Ein Vermögensvorteil großen Ausmaßes liegt vor. Dieser ist ab einer Summe von
228150.000 Euro anzunehmen (vgl. Raum in Kügel/M /Hofmann, AMG, 2. Aufl. 2016,§ 95 AMG Rn. 51). Da sich der festgestellte Gesamtschaden des Organisationsdeliktes von rund 17 Mio. Euro, der deutlich über dieser Wertgrenze liegt, auf die Wirkstoff-menge bezieht, die der Angeklagte zwar abgerechnet hat, der aber keine Einkäufe an Wirkstoff gegenüberstehen, stellt dies auch den Vorteil des Angeklagten dar.
2282Der Angeklagte handelte für sich aus grobem Eigennutz. Grob eigennützig handelt, wer sich bei seinem Verhalten von dem Streben nach Vorteil in besonders anstößigem Maße leiten lässt. Dabei muss das Gewinnstreben des Täters das bei jedem Straftäter vorhandene Gewinnstreben deutlich übersteigen (vgl. BGH, Beschluss vom 13.06.2013, Az.: 1 StR 226/13 zu § 370 AO a.F.). Diese Voraussetzungen sind erfüllt. Das Organisationsdelikt umfasst 14.537 tateinheitlich zusammentreffende Verstöße gegen das Arzneimittelgesetz über einen Zeitraum von fünf Jahren mit einem Gesamtschaden von rund 17 Mio. Euro und einem entsprechenden finanziellen Vorteil des Angeklagten. Allein dieser enorme Umfang zeigt den groben Eigennutz.
2283Der Angeklagte hat weiterhin für alle 28 Taten des Verstoßes gegen das Arzneimittelgesetz das Regelbeispiel der Gewerbsmäßigkeit gemäß § 95 Abs. 3 S. 2 Nr. 2 b) AMG erfüllt: Der Angeklagte hat in allen Fällen gefälschte Arzneimittel hergestellt und in 14.498 Fällen in Verkehr gebracht. Er hat gewerbsmäßig gehandelt, da er in der Absicht handelte, sich eine Einnahmequelle von großem Umfang und einiger Dauer zu verschaffen. Ausreichend ist, dass die Tätigkeit des Angeklagten darauf gerichtet war,
2284845
2285eine Einnahmequelle für sich selbst zu schaffen. Dass die am 29.11.2016 sichergestellten parenteralen Arzneimittelzubereitungen letztlich nicht in den Verkehr gelangt sind, steht also nicht entgegen.
2286Bei einer Abwägung aller Strafzumessungsgesichtspunkte (siehe sogleich) ist die In-dizwirkung der Regelbeispiele nicht widerlegt. Für den Angeklagten liegt in allen Fällen ein besonders schwerer Fall des Verstoßes gegen das Arzneimittelgesetz vor, so dass der Strafrahmen von einem Jahr bis zu zehn Jahren Freiheitsstrafe reicht.
2287b) Strafzumessung im engeren Sinn
2288Die Kammer hat bei jeder einzelnen Tat folgende Umstände im Sinne des § 46 StGB gegeneinander abgewogen:
2289Für den Angeklagten spricht zunächst sein einwandfreies Vorleben: Der Angeklagte ist nicht vorbestraft und war bislang ein respektierter Bürger seiner Heimatstadt. Die Taten selbst sind ihm durch mangelnde Aufsicht der Behörden leicht gemacht worden. Im Laufe einer Tatserie entsteht überdies regelmäßig ein Gewöhnungseffekt, der die Hemmschwelle für das Fortsetzen des Tuns senkt. Für die Zubereitungen, die am 29.11.2016 sichergestellt wurden und nicht ausgeliefert worden sind, ist strafmildernd berücksichtigt, dass hier allein die Tatbestandsvariante des Herstellens erfüllt ist.
2290Weiter zugunsten des Angeklagten sind einige Umstände des Strafverfahrens anzusetzen: Durch die lange Verfahrensdauer von mehr als 1 1/2 Jahren von der Inhaftierung bis zur Urteilsverkündung, namentlich durch insgesamt 44 Hauptverhandlungstermine waren er und seine Familie einer besonderen Belastung ausgesetzt. Diese Belastung wurde intensiviert durch eine umfangreiche, teilweise vorverurteilende Medienberichterstattung, nicht selten unter voller Namensnennung und/oder mit unverpi-xelten Fotos, dies in einigen Fällen bundesweit. Eine weitere Kompensation für die lange Verfahrensdauer ist indes nicht angezeigt, da sie dem Umfang und der Schwierigkeit der Sache geschuldet war und nicht auf (der Justiz vorwerfbaren) sonstigen Verzögerungen beruhte.
2291Bestimmte Folgen der Verurteilung sind ebenfalls zugunsten des Angeklagten zu berücksichtigen: Mit dem ausgesprochenen Berufsverbot "für immer" wird er seine berufliche und wirtschaftliche Lebensgrundlage verlieren. Wirtschaftlich einschneidend ist
2292846
2293außerdem die angeordnete Einziehung in Höhe von 17 Mio. Euro, die aller Wahrscheinlichkeit nach in eine Insolvenz münden wird.
2294Der Angeklagte ist in geringem Maße gesteigert haftempfindlich, und zwar wegen seiner kardialen Beschwerden, der regelmäßigen Kopfschmerzen und dem verlorenen Geruchssinn. Außerdem ist er im Vergleich zu anderen Inhaftierten fortgeschrittenen
2295Alters. Dass der Angeklagte gegenüber dem Sachverständigen Prof. S wörtlich
2296angegeben hat, er fühle sich in der Haft in der JVA wie in einer
2297„Kloster-Reha-Maßnahme“, hat die Kammer in diesem Zusammenhang ganz außer Acht gelassen: Dabei handelt es sich selbstverständlich nur um eine Momentauf-
2298nahme. Die Haftbedingungen in der JVA , wo der Angeklagte zunächst inhaftiertwar, hat er denn auch als weniger günstig empfunden.
2299Strafschärfend hingegen wirkt sich bei jeder einzelnen Tat aus, dass der Angeklagte die Unterdosierungen systematisch und über einen langen Zeitraum begangen hat. Der aufgewendete Wille war erheblich: Nahezu jeder Tag innerhalb von fünf Jahren war von seinem kriminellen Tun geprägt; das Unterdosieren von Arzneimitteln war buchstäblich das erste, was der Angeklagte morgens noch vor dem Frühstück tat. Dabei ließ sich der Angeklagte auch nicht von dem Strafverfahren gegen ihn beeindrucken, dass zwischenzeitlich gegen ihn geführt wurde. Für das Organisationsdelikt wirkt sich dabei auch die außerordentlich hohe Zahl an Einzelfällen strafschärfend aus.
2300Zu Lasten des Angeklagten geht weiter die Art der Ausführung der Taten: Objekt der Taten waren nämlich onkologische Präparate, also Arzneimittel, die eine potentiell tödliche Krankheit heilen bzw. lindern sollen und daher an besonders schutzwürdige Patienten verabreicht werden. Dies ist erheblich strafschärfend anzusetzen. Die Verwicklung gerade von Mitarbeitern als seinen Untergebenen in seine Machenschaften - soweit festgestellt - ist ebenfalls ein schärfender Gesichtspunkt.
2301Bei einer Gesamtschau der für und gegen den Angeklagten sprechenden Gesichtspunkte überwiegen die strafschärfenden Momente erheblich. Die Kammer erachtet daher empfindliche Freiheitsstrafen als erforderlich: Unter Abwägung aller, insbesondere der vorgenannten Strafzumessungsgesichtspunkte, hat die Kammer auf folgende Einzelstrafen erkannt:
2302Für den Verstoß gegen das Arzneimittelgesetz in 14.537 Fällen [Tenor zu I. 1. a)] auf eine Freiheitsstrafe von
2303847
2304acht Jahren,
2305für jeden einzelnen der 27 weiteren Verstöße gegen das Arzneimittelgesetz [Tenor zu I. 1. b)] jeweils eine Freiheitsstrafe von
2306einem Jahr und neun Monaten.
23072. Betrug bzw. versuchter Betrug
2308a) Strafrahmen
2309Die Vorschrift des § 263 Abs. 1 StGB sieht Freiheitsstrafe bis zu fünf Jahren oder Geldstrafe vor. Die Kammer hat für jede der 58 vollendeten Taten des Betruges den Strafrahmen des besonderen schweren Falles nach § 263 Abs. 3 S. 1 StGB von sechs Monaten bis zu zehn Jahren zugrunde gelegt. Erfüllt ist das Regelbeispiel der Ge-werbsmäßigkeit gemäß § 263 Abs. 3 S. 2 Nr. 1 Alt. 1 StGB, da der Angeklagte in der Absicht handelte, sich eine Einnahmequelle von einigem Umfang und einiger Dauer zu verschaffen.
2310Bei einer Abwägung aller Strafzumessungsgesichtspunkte (siehe sogleich) ist die In-dizwirkung der Regelbeispiele nicht widerlegt.
2311Für die Tat des versuchten Betruges (November 2016) hat die Kammer im Hinblick auf die Gewerbsmäßigkeit ebenfalls einen besonders schweren Fall angenommen - auch insoweit ist bei einer Abwägung aller Strafzumessungsgesichtspunkte (siehe sogleich) die Indizwirkung der Regelbeispiele nicht widerlegt - und die Strafe dem gemilderten Strafrahmen gemäß §§ 263 Abs. 2, 3 S. 2 Nr. 1 Alt. 1, 49 Abs. 1 StGB von einem Monat bis zu sieben Jahren und sechs Monaten entnommen. Die (fakultative) Strafmilderung rechtfertigt sich aus dem Umstand, dass der Schaden der Kostenträger für diesen Monat durch die Zurückbehaltung des Auszahlungsbetrages tatsächlich nicht entstanden ist.
2312b) Strafzumessung im engeren Sinn
2313Die Kammer hat bei jeder einzelnen Tat folgende Umstände im Sinne des § 46 StGB gegeneinander abgewogen:
2314Zu Gunsten des Angeklagten gelten im Wesentlichen die gleichen Gesichtspunkte wie
2315848
2316bei den Verstößen gegen das Arzneimittelgesetz: Das einwandfreie Vorleben des Angeklagten, der einsetzende Gewöhnungseffekt, das belastende Verfahren nebst Medienberichterstattung und die genannten Folgen der Verurteilung einschließlich der Haftempfindlichkeit. Auch die Krankenkassen haben es dem Angeklagten leicht gemacht: Mechanismen zur Überprüfung, ob die abgerechneten Leistungen tatsächlich erbracht sind, existieren im Bereich der Rezepturarzneimittel offenbar nicht.
2317Strafschärfend wirkt sich auch hier insbesondere das systematische Vorgehen über einen langen Zeitraum aus.
2318Die Kammer erachtet bei einer Gesamtabwägung auch für die Betrugstaten empfindliche Freiheitsstrafen als erforderlich: Unter Abwägung aller, insbesondere der vorgenannten Strafzumessungsgesichtspunkte, hat die Kammer auf folgende Einzelstrafen erkannt:
2319Für jede der 58 Taten des vollendeten Betruges auf eine Freiheitsstrafe von
2320zwei Jahren und sechs Monaten,
2321für die Tat des versuchten Betruges auf eine Freiheitsstrafe von
2322einem Jahr und neun Monaten.
23233. Gesamtstrafe
2324Aus den Einzelstrafen war gemäß §§ 53, 54 Abs. 1 StGB eine Gesamtstrafe zu bilden. Die Gesamtstrafe wird nach § 54 Abs. 1 Satz 2 StGB durch Erhöhung der verwirkten höchste Strafe gebildet, hier also der Einzelfreiheitsstrafe von acht Jahren für die Tat des Organisationsdelikts mit 14.537 tateinheitlich zusammentreffenden Verstößen gegen das Arzneimittelgesetz.
2325Für eine nur mäßige Erhöhung sprechen der enge zeitliche und sachliche Zusammenhang der einzelnen Taten: Der Angeklagte hat die Taten innerhalb einer Serie mit weitgehend identischer Motivlage und im gleichen beruflichen Umfeld begangen. Auf der anderen Seite sind unterschiedliche Rechtsgüter betroffen, was für eine stärkere Erhöhung spricht: Das Arzneimittelgesetz schützt die Arzneimittelsicherheit und dient dem Patientenschutz, der Betrugstatbestand schützt das Vermögen (hier) der öffentlichen Krankenkassen und anderer öffentlicher Kostenträger.
2326849
2327Unter abermaliger Berücksichtigung aller maßgeblichen, insbesondere der aufgezeigten Strafzumessungsgesichtspunkte, hat die Kammer aus den genannten Einzelstrafen unter Erhöhung der Einsatzstrafe auf eine
2328Gesamtfreiheitsstrafe von zwölf Jahren
2329erkannt.
2330VI. Einziehung
2331Gemäß §§ 73 Abs. 1, 73c S. 1 StGB war gegen den Angeklagten die Einziehung von Wertersatz in Höhe eines Betrages von 17 Mio. Euro anzuordnen. Der Angeklagte hat durch Verstöße gegen das Arzneimittelgesetz und die Betrugstaten Gelder in Höhe eines Betrages von 17 Mio. Euro erlangt.
2332Die Kammer hat sich bei der Bestimmung des Einziehungsbetrages gemäß § 73d Abs. 2 StGB an der Berechnung des Gesamtschadens orientiert (vgl. im Einzelnen in der Beweiswürdigung zu den Abrechnungen) und diesen Betrag zugrunde gelegt. Die Berechnungen der Kammer ergaben einen Gesamtschaden von rund 17,3 Mio. Euro. Die Kammer hat insoweit neben den durch die Betrugstaten erlangten Geldern auch die weiteren Einnahmen von den privat versicherten Patienten zugrunde gelegt, da der Angeklagte durch das Inverkehrbringen der unterdosierten parenteralen Zubereitungen, mithin durch den Verstoß gegen das Arzneimittelgesetz, die Einnahmen aus Zubereitungen für privat versicherte Patienten ebenfalls erlangt hat.
2333Von diesem Gesamtschaden hat die Kammer für den Monat November 2016, in dem die Auszahlung durch die gesetzlichen Krankenkassen und Kostenträger nicht erfolgte, einen Abzug von aufgerundet 293.221 Euro (= 17,3 Mio. Euro/59; der monatliche Schadensbetrag bei Berücksichtigung der Abrechnungen der privat versicherten Patienten) vorgenommen und den Betrag auf 17 Mio. Euro abgerundet.
2334Ein Abzug gemäß § 73d Abs. 1 S. 1 StGB war nicht vorzunehmen. Ankaufskosten für die Wirkstoffe waren nicht zu berücksichtigen, da die Kammer die Berechnung ohnehin daran ausgerichtet hat, dass für die verurteilten Fälle gar kein Wirkstoff vorhanden war. Auch die weiteren Kosten für die Herstellung der onkologischen (parenteralen) Zubereitungen (Kochsalzlösung, Laborkosten, Mitarbeiter) unterfallen dem Ausschlusstatbestand des § 73d Abs. 1 S. 2 StGB. Es handelt sich jeweils um Kosten, die für die
2335![]() Begehung der Taten angefallen sind.
Begehung der Taten angefallen sind.
851
2337VII. Berufsverbot für immer, § 70 Abs. 1 StGB
2338Gegen den Angeklagten war ein Berufsverbot für die Tätigkeit als Apotheker gemäß § 70 Abs.1 StGB für immer zu verhängen:
2339Der Angeklagte hat alle der Verurteilung zugrunde liegenden rechtswidrigen Taten unter Missbrauch seiner selbstständigen Tätigkeit als Apotheker und im Rahmen seines Apothekenbetriebes begangen. Sowohl die 14.564 Straftaten des Verstoßes gegen das Arzneimittelgesetz durch das Herstellen und Inverkehrbringen unterdosierter und gefälschter Arzneimittel, die die Kammer teilweise konkurrenzrechtlich zu einem Organisationsdelikt zusammengefasst hat, als auch die Taten des (Abrechnungs-) Betruges gegenüber den Kostenträgern rühren aus der Tätigkeit des Angeklagten als
2340Apotheker und als Inhaber der Apotheke. Dies stellt eine grobe Verletzung dermit der Ausübung des Apothekenberufes verbunden Pflichten im Sinne des § 70 Abs. 1 StGB sowie eine Ausnutzung des Vertrauensverhältnisses dar, welches dem
2341Angeklagten von den Patienten bzw. Kunden der Apotheke entgegengebrachtwurde.
2342Es besteht auch die Gefahr weiterer erheblicher Rechtsverletzungen durch den Angeklagten. Im Hinblick auf die Vielzahl der dem Angeklagten vorgeworfenen Straftaten, sein systematisches Vorgehen und den langen Tatzeitraum ist die Kammer von der Gefahr weiterer erheblicher Rechtsverletzungen durch den Angeklagten überzeugt.
2343Der Angeklagte hat durch die Taten gezeigt, dass er für die Befriedigung seiner persönlichen Bedürfnisse nicht davor zurückschreckt, die Gesundheit anderer Menschen in Gefahr zu bringen, für die er aufgrund des besonderen Vertrauensverhältnisses zwischen Apotheker und Patient eine besondere Fürsorgepflicht hatte.
2344Bei einer weiteren Ausübung des Apothekerberufs - ob im Rahmen einer selbstständigen oder unselbstständigen Tätigkeit - würde die Gefahr erneuter Verstöße gegen das Arzneimittelgesetz oder weiterer Taten des Abrechnungsbetruges bestehen. Aufgrund des finanziellen Motivs des Angeklagten besteht eine hohe Wahrscheinlichkeit, dass er erneut seine berufliche Tätigkeit zum Erlangen unrechtmäßiger finanzieller Vorteile missbrauchen würde. Dies gilt insbesondere vor dem Hintergrund der mit diesem Urteil angeordneten Einziehung des Wertersatzbetrages von 17 Mio. Euro, der sein derzeitiges Vermögen wohl übersteigt und damit seine finanzielle Lebensgrundlage beeinträchtigt. Um seinen gewohnten Lebensstil fortzusetzen zu können, bedürfte
2345852
2346der Angeklagte dringend weiterer finanzieller Mittel.
2347Die Kammer verkennt nicht, dass ein Berufsverbot mit Blick auf Art. 12 Grundgesetz ein schwerwiegender Eingriff in die Rechte des Angeklagten ist. Schutzzweck des Berufsverbots ist die Allgemeinheit, die vor weiterer Gefährdung durch den Angeklagten geschützt werden soll. Bei einer Gesamtwürdigung der Taten des Angeklagten und seiner Persönlichkeit wäre ein Absehen vom Berufsverbot nicht angezeigt. Die Schwere der Straftaten des Angeklagten, verbunden mit dem jahrelangen Missbrauch seiner Vertrauensstellung als Apotheker, rechtfertigt den Eingriff in seine Berufsfreiheit.
2348Dabei hat die Kammer berücksichtigt, dass der Angeklagte erstmalig strafrechtlich in Erscheinung getreten ist. Aufgrund des langen Tatzeitraumes von fast fünf Jahren, des hohen Schadens und des Umstandes, dass der Angeklagte im besonders sensiblen Bereich der onkologischen Medikation Straftaten zur Erlangung finanzieller Vorteile begangen hat, war zum Schutz der Allgemeinheit die Verhängung des Berufsverbots jedoch unerlässlich. Insoweit ist die Kammer überzeugt, dass nicht bereits die Verurteilung zu einer Freiheitsstrafe von zwölf Jahren und der damit einhergehende Vollzug ausreichend sind, um hinreichend auf die Gefährlichkeit des Angeklagten zu reagieren.
2349Von einem Berufsverbot kann nicht deshalb abgesehen werden, weil aufgrund der Einziehung von Wertersatz in Höhe von 17 Mio. Euro eine wirtschaftliche Grundlage für den Aufbau eines neuen Apothekenbetriebes nicht ohne weiteres bestehen dürfte. Denn das Apothekengebäude nebst der vollausgestatteten Apotheke befindet sich nach wie vor in Familienbesitz, so dass nicht auszuschließen ist, dass der Angeklagte durch eine bloße Verpachtung oder sonstige Überlassung, durch eine Übertragung des Gebäudes oder einen Erbfall - der Angeklagte ist das einzige Kind seiner Eltern - erneut in die Position des Inhabers einer Apotheke gelangen könnte. Außerdem wäre eine Position als angestellter Apotheker denkbar.
2350Von einem Berufsverbot kann nicht wegen möglicher berufsrechtlicher bzw. verwaltungsrechtlicher Konsequenzen - Entzug der Approbation, Schließung des Reinraum-labors - abgesehen werden. Denn solche Maßnahmen bisher nicht (endgültig) erfolgt; vorläufige Maßnahmen sind unbeachtlich.
2351Nicht ausreichend wäre ein nur auf die selbständige Tätigkeit eines Apothekers beschränktes Berufsverbot. Zwar hat der Angeklagte die abgeurteilten Straftaten als
2352853
2353Selbständiger begangen. Dennoch sind selbstverständlich - in anderer Form - auch Straftaten eines angestellten Apothekers mit finanzieller Motivlage denkbar.
2354Die Voraussetzungen der Verhängung eines lebenslangen Berufsverbotes gemäß § 70 Abs. 1 S. 2 StGB liegen vor. Ein lebenslanges Berufsverbot setzt die Wahrscheinlichkeit voraus, dass der Maßregelzweck mit einem befristeten Verbot nicht erreicht werden kann. Unter Berücksichtigung des Grundsatzes der Verhältnismäßigkeit ist ein lebenslanges Berufsverbot auf schwerwiegende Ausnahmefälle zu beschränken. Ein solcher Ausnahmefall liegt hier vor:
2355Die Straftaten des Angeklagten lassen auf eine besonders verwerfliche Gesinnung des Angeklagten schließen. Er hat sich bei seinen Straftaten, motiviert durch Profitgier, nicht von möglichen gesundheitlichen Auswirkungen auf mitunter schwerstkranke Patienten abhalten lassen. Dies lässt die Begehung weiterer Straftaten nach Ablauf der Inhaftierung erwarten. Dabei zeigt seine Reaktion (besser Nicht-Reaktion) auf das Strafverfahren im Jahr 2013/2014, dass er auch von der drohenden Entdeckung seiner Straftaten vollkommen unbeeindruckt war und ihn dies insbesondere nicht von einer Fortsetzung seines Tuns abgehalten hat.
2356Die Kammer hat bei der Prüfung der Erforderlichkeit auch berücksichtigt, dass Weisungen zur beruflichen Tätigkeit sowohl im Rahmen des § 56c StGB als auch des § 68b Abs. 1 S. 1 Nr. 4 StGB nach Verbüßung der Haftzeit und in Kenntnis des Haftverlaufes nicht ausreichend erscheinen. Insoweit spricht auch der Gedanke der Resozialisierung nicht gegen die Verhängung eines lebenslangen Berufsverbotes.
2357Die Kammer hat bei der Verhängung des lebenslangen Berufsverbotes schließlich nicht unberücksichtigt gelassen, dass der Angeklagte bei Vollverbüßung im Zeitpunkt der Entlassung noch einige Jahre im arbeitsfähigen Alter sein wird, jedoch hebt dies seine Gefährlichkeit gerade nicht auf, sondern begründet sie. Dabei hat die Kammer insbesondere erneut berücksichtigt, dass der Angeklagte über einen langen Zeitraum von fast fünf Jahren ab 2012 in einem enormen Umfang Straftaten begangen und sich auch von einem ersten Strafverfahren gegen ihn vollkommen unbeeindruckt gezeigt hat.
2358854
2359VIII. Teilfreispruch
2360Die Kammer hat den Angeklagten im Übrigen aus tatsächlichen Gründen freigesprochen.
2361Der Freispruch betrifft insgesamt 47.416 Taten des Verstoßes gegen das Arzneimittelgesetz, nämlich
2362– 13.787 Taten, die im Rahmen der gleichartigen Wahlfeststellung nicht vom Organisationsdelikt erfasst sind und bei denen keine mikrobielle Kontamination festgestellt wurde, dazu die Ausführungen unter II. 2. a) (1),
2363– 9 Taten, bei denen die Anklage unvollständige oder doppelte Angaben aus Zenzy übernommen hat, aufgeführt im Folgenden unter Ziffer 1),
2364– 51 Taten der am 29.11.2018 sichergestellten Zubereitungen, bei denen die Kammer weder eine Unterdosierung noch eine mikrobielle Kontamination festgestellt hat, aufgeführt im Folgenden unter Ziffer 2),
2365– 970 Taten, bei denen die Zubereitung mit so genannter „Studienware“ erfolgte, bei denen die Kammer weder eine Unterdosierung noch eine mikrobielle Kontamination festgestellt hat, aufgeführt im Folgenden unter Ziffer 3),
2366– 30.282 Taten, die Zubereitungen mit Wirkstoffen betreffen, deren Unterdosierung insgesamt oder für bestimmte Zeiträume nicht festgestellt werden konnte und bei denen die Kammer auch keine mikrobielle Kontamination festgestellt hat, aufgeführt im Folgenden unter Ziffer 4),
2367– 2.317 Taten, die die Zubereitung so genannter „Augenspritzen“ im Rahmen eines Off-Label-Use des Wirkstoffs Bevacizumab betreffen und bei denen die Kammer weder eine Unterdosierung noch eine mikrobielle Kontamination festgestellt hat, aufgeführt im Folgenden unter Ziffer 5).
23681. Teilfreispruch wegen Fehlangaben der Anklage
2369In den folgenden neun Fällen der Anklage fehlten Mengenangaben der Zubereitungen, so dass keine Unterdosierung festgestellt werden konnte; teils handelte es sich außerdem um Dopplungen. Dies beruht darauf, dass bereits die zugrunde liegenden Daten
2370
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()

![]()


856
2372nicht sachverständig untersucht werden konnten, da nach Ablauf des so genannten „Stabilitätsfensters“ Auskristallisationen zu beobachten waren.
2373Insgesamt handelt es sich um folgende Fälle:
2374
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()


![]() Patient
Patient
857
2376
Die Etiketten dieser Zubereitungen verfügten über eine Datumsangabe für den 29.11.2016, ein Verwendbarkeitsdatum sowie weitere Angaben zu Patient, Wirkstoff, Wirkstoffmenge und Lagerung.
2378Die Kammer konnte nicht feststellen, dass diese Arzneimittelzubereitungen wegen eines Verstoßes des Angeklagten oder eines seiner Mitarbeiter gegen Hygienevorschriften aufgrund mikrobieller Verunreinigung in ihrer Qualität nicht nur unerheblich gemindert waren.
2379Keine der 117 sichergestellten Zubereitungen ist im Ermittlungsverfahren sachverständig auf mikrobielle oder sonstige Verunreinigungen untersucht worden. Eine nachträgliche Untersuchung während des Zwischen- oder Hauptverfahrens war wegen des Zeitablaufs nicht mehr sinnvoll, zumal die Zubereitungen inzwischen durch die Sachver-
2380ständigen L und Dr. G auftragsgemäß auf ihren Wirkstoffgehalt untersuchtund dabei geöffnet und teilweise auch verbraucht worden waren.
2381Bei einer Sichtkontrolle der 117 Zubereitungen stellten L und Dr. G keine
2382Verunreinigungen fest. Sichtbare „Fusseln“ wurden von den Sachverständigen als Abbauprodukte von Wirkstoffen oder Wirkstoffklümpchen identifiziert, nicht als von außen eingetragene Schmutzpartikel.
2383Eine Untersuchung des Reinraumlabors auf mikrobielle Verunreinigungen am Tag der Durchsuchung oder im Ermittlungsverfahren wurde nicht durchgeführt. Eine nachträgliche Untersuchung während des Zwischen- oder Hauptverfahrens war ebenfalls wegen Zeitablaufs nicht mehr sinnvoll, wobei allerdings der Schluss von einer Verunreinigung des Labors auf eine nicht nur unerhebliche Qualitätsminderung einer Zubereitung im Einzelfall ohnehin kaum mit der für eine Verurteilung erforderlichen Gewissheit gezogen werden kann.
2384Die Feststellungen der Kammer begründen keine Strafbarkeit nach §§ 95 Abs. 1 Nr. 3a), 8 Abs. 1 Nr. 1 AMG. Die Kammer konnte für keinen Fall eine nicht unerhebliche Qualitätsminderung feststellen.
2385858
23863. Teilfreispruch bei „Studienware“
2387Die Anklageschrift enthält 970 Fälle, in denen die Zubereitung unter Verwendung so genannter „Studienware“ hergestellt worden ist. Die Kammer spricht den Angeklagten frei, weil in diesen Fällen weder eine Unterdosierung noch eine mikrobielle Verunreinigung festzustellen ist.
2388Die Kammer hat folgende Feststellungen getroffen:
2389In der Apotheke wurden gelegentlich parenterale Arzneimittelzubereitungen für
2390die Krebstherapie hergestellt, die - gesondert angefordert - im Rahmen wissenschaftlicher Studien verwendet wurden. Für diese besonderen Zubereitungen für konkret benannte Patienten - den Studienteilnehmern - wurde der benötigte Wirkstoff vom Hersteller oder einer die Studie durchführenden Einrichtung zur Verfügung gestellt, und zwar kostenfrei. Die Lieferung der Wirkstoffe, eben der „Studienware“, erfolgte zumeist außerhalb der üblichen Lieferwege. Bei Studienware konnte es sich um Placebos, also wirkstofffreie Ware, um neuartige Wirkstoffe, die sich noch in der Testphase befanden, oder um Studienwirkstoffe zur Erforschung der Erweiterung des Anwendungsbereichs eines Wirkstoffs handeln.
2391Die gelieferte Studienware war von dem Apotheker zwingend zu markieren und von den übrigen Wirkstoffen gesondert zu lagern. Entnahmen waren ebenfalls zu notieren. Die Herstellung der Zubereitung mit der Studienware sollte gesondert erfolgen.
2392Insgesamt wurden 970 Zubereitungen der Anklageschrift mit Studienware hergestellt. Eine mikrobielle Kontamination war im Nachhinein nicht feststellbar.
2393Die vorstehenden Feststellungen zur Studienware beruhen auf den glaubhaften Angaben des Zeugen E , der entsprechende Kenntnisse aus seiner eigenen Tätigkeit im
2394Reinraumlabor der Apotheke und aus seiner weiteren Tätigkeit als Apotheker
2395erworben hat. Weiter hat auch die Zeugin K die Angaben des Zeugen E bestä-tigt.
2396Die Fälle der Anklage, die Studienware betreffen, hat die Kammer anhand der Daten aus Zenzy, die bei Studienware eine entsprechende Markierung ausweisen, ermittelt.
2397Die Kammer ist nicht überzeugt, dass der Angeklagte oder im Einzelfall auf seine Veranlassung einer seiner Mitarbeiter diese parenteralen Arzneimittelzubereitungen
2398859
2399ebenfalls unterdosierten. Nicht auszuschließen ist, dass diese Zubereitungen stets ordnungsgemäß mit vollständigem Wirkstoffinhalt hergestellt wurden. Dies beruht auf folgenden Überlegungen:
2400Die gesonderte Anlieferung der Studienware, deren gesonderte Lagerung und die Pro-tokollierung der Entnahmen hätten eine Unterdosierung, die mit einer nicht Verwendung der gelieferten Wirkstoffe einhergegangen wäre, auffällig gemacht. Außerdem wurden die Zubereitungen mit Studienware Patienten appliziert, deren Krankheitsverlauf unter besonderer wissenschaftlicher Beobachtung stand. Dadurch stieg das Entdeckungsrisiko für Unterdosierungen. Und schließlich fehlte dem Angeklagten der finanzielle Anreiz: Er hatte keine finanziellen Ausgaben für die verwendeten Wirkstoffe, so dass eine Einsparung ihm keinen wirtschaftlichen Vorteil verschafft hätte.
2401Die Annahme, dass der Angeklagte oder einer seiner Mitarbeiter bei Studienware keine Unterdosierungen vorgenommen hat, stützt sich indiziell auf eine Zubereitung
2402![]() für die Patientin (Tat 61.891 der Anklage), die am Tag der Durchsuchungsichergestellt wurde. Sie war mit Studienware zubereitet. Die Untersuchung dieser Zu-
für die Patientin (Tat 61.891 der Anklage), die am Tag der Durchsuchungsichergestellt wurde. Sie war mit Studienware zubereitet. Die Untersuchung dieser Zu-
bereitung durch den Sachverständigen Dr. G vom PEI ergab, dass der Wirkstoff-gehalt mit einem Wirkstoffmehrgehalt von 0,8 % als ordnungsgemäß zu qualifizieren war (siehe bereits vorstehend). Dabei handelte es sich um die einzige Zubereitung, die
2404von dem Sachverständigen Dr. G untersucht wurde, die einen ordnungsgemäßenWirkstoffgehalt auswies.
2405Zur nicht feststellbaren mikrobiellen Kontamination siehe bereits oben.
2406Studienware fand sich bei den folgenden Wirkstoffen der Taten 1 bis 61.863 der Anklage, bei denen im Übrigen eine Verurteilung im Rahmen der gleichartigen Wahlfeststellung erfolgte: Eribulin, Nab-Paclitaxel, Panitumumab, Pertuzumab, Trastuzumab und Trastuzumab Emtansine.
2407Im Einzelnen handelte es sich um folgende 970 Taten der Anklage hinsichtlich derer die Kammer den Angeklagten aus tatsächlichen Gründen freigesprochen hat:
2408


![]()
![]()

![]()


![]()
![]()

![]()

![]()

![]()
![]()

![]()
![]()
![]()
![]()
![]()
![]()
![]()

![]()
![]()
![]()
![]()
![]()

![]()

![]()


![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()



![]()
![]()

![]()
![]()
![]()

![]()















![]()
![]()

![]()
![]()

![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()

![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()


![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()







![]()
![]()

![]()
![]()










![]()

![]()



![]()

![]()

![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()


![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
880
24174. Teilfreispruch bei bestimmten Wirkstoffen
2418Bei verschiedenen Wirkstoffen der Anklage hat die Kammer auf Grundlage einer Würdigung der Einkaufszahlen der Apotheke des Angeklagten sowie fehlender finanzieller Anreize den Angeklagten aus tatsächlichen Gründen vom Vorwurf des Herstellens oder Inverkehrbringens unterdosierter Arzneimittel in 30.282 Fällen freigesprochen. Eine mikrobielle Kontamination war ebenfalls nicht feststellbar.
2419Zu den Wirkstoffen im Einzelnen (in alphabetischer Reihenfolge):
2420a) Aflibercept
2421Für Zubereitungen mit dem Wirkstoff Aflibercept hat die Kammer den Angeklagten vom Vorwurf des Herstellens und Inverkehrbringens unterdosierter bzw. mikrobiell verunreinigter Zubereitungen in elf Fällen aus tatsächlichen Gründen freigesprochen. Die Kammer hat zum Wirkstoff Aflibercept folgende Feststellungen getroffen:
2422Für den Wirkstoff Aflibercept gab es erst ab dem Jahre 2013 Einkäufe und parenterale Arzneimittelzubereitungen: Im Jahr 2013 gab es einen Einkauf von insgesamt 500 mg des Wirkstoffs. Die Verbrauchsmenge lag bei für insgesamt zwei Zubereitungen bei 472 mg. In den Jahren 2014 und 2015 gab es weder Einkäufe noch parenterale Arzneimittelzubereitungen mit diesem Wirkstoff. Im Jahre 2016 stand einem Einkauf von insgesamt 900 mg ein Verbrauch von insgesamt 2.766 mg gegenüber. Hergestellt und in Verkehr gebracht wurden insoweit insgesamt neun parenterale Arzneimittelzubereitungen mit diesem Wirkstoff.
2423Für das Jahr 2013 verfügte der Angeklagte mithin über hinreichend Wirkstoff für die von ihm hergestellten und abgerechneten Zubereitungen. Für die weiteren Zubereitungen des Jahres 2016 konnte die Kammer unter Berücksichtigung der von ihr gewählten Sicherheitszuschläge keine hinreichenden Feststellungen treffen, dass eine bestimmte Anzahl von Zubereitungen zwingend nicht mit dem notwendigen Wirkstoff versetzt war: Die restliche Gesamtmenge der Zubereitungen des Wirkstoffs Aflibercept lag bei 2.766 mg, so dass ein Durchschnittswert einer Zubereitung von 308 mg anzusetzen war, der bei Berücksichtigung des Sicherheitsabschlages von 10 % und der Annahme, dass eine Füllmenge von 80 % als noch ordnungsgemäß anzusetzen ist,
2424auf die Menge von 223 mg herabzusetzen war. Die von dem Zeugen T ermittelteEinkaufsmenge von 1.400 mg war wiederum um einen Sicherheitsaufschlag von 10 %
2425881
2426zu erhöhen, so dass ein Wert von 1.540 mg zu berücksichtigen war. Insoweit war mit der vorhandenen Einkaufsmenge die Herstellung von acht Zubereitungen des Wirkstoffs Aflibercept möglich. Bei weiterer Berücksichtigung eines Sicherheitszuschlags von 5 % war von neun möglichen Zubereitungen auszugehen, so dass auch insoweit ein Freispruch aus tatsächlichen Gründen erfolgte.
2427Der Freispruch betrifft insoweit folgende elf Taten der Anklage im Einzelnen:
2428Anklage Datum Nachname Vorname Geb.-Datum Menge
2429
Die Angaben zur Einkaufsmenge beruhen wiederum auf den glaubhaften Angaben des
2431Zeugen T . Die Kammer nimmt insoweit auf ihre Ausführungen unter III. 3. b) (1.)Bezug. Die Feststellungen zu den weiteren Daten, namentlich zur Anzahl der Zubereitungen des Wirkstoffs Aflibercept und der Wirkstoffmenge, beruhen wiederum auf den Daten des Programms Zenzy, welche die Kammer im Wege des Selbstleseverfahrens gemäß § 249 Abs. 2 StPO in die Hauptverhandlung eingeführt hat. Die Berechnungsweise der Kammer ist unter III. 3. b) (2.) erläutert.
2432882
2433b) Azacitidine
2434Für Zubereitungen mit dem Wirkstoff Azacitidine hat die Kammer den Angeklagten vom Vorwurf des Herstellens und Inverkehrbringens unterdosierter bzw. mikrobiell verunreinigter Zubereitungen in 4.468 Fällen aus tatsächlichen Gründen freigesprochen. Die Kammer hat zum Wirkstoff Azacitidine folgende Feststellungen getroffen:
2435Die Einkaufsmenge des Wirkstoffs Azacitidine lag für die Jahre 2012 bis 2016 bei insgesamt 225.800 mg. Unter Berücksichtigung des Sicherheitszuschlages von 10 % – dazu die Ausführungen der Kammer im Rahmen der Beweiswürdigung zu den Sicherheitszuschlägen auf die Einkaufsmengen der einzelnen Wirkstoffe unter III. 3. b) (1.) – hat die Kammer einen Einkaufswert von 248.380 mg zugrunde gelegt. Zum Wirkstoff Azacitidine gab es im Tatzeitraum 4.468 parenterale Arzneimittelzubereitungen mit einer Gesamtmenge von 333.828 mg. Die durchschnittliche Zubereitung hatte mithin eine Wirkstoffmenge von 74 mg. Abzüglich des Sicherheitsabschlages von 10 % auf die durchschnittliche Herstellungsmenge ergibt sich eine Wirkstoffmenge von 66 mg. Unter der weiteren Annahme der Kammer, dass bereits die Dosierung von 80 % der deklarierten Wirkstoffmenge als noch ordnungsgemäß zu behandeln ist, ergibt sich eine durchschnittliche Wirkstoffmenge von 52 mg. Mit dieser durchschnittlichen Menge hätte eine Anzahl von 4.777 Zubereitungen ordnungsgemäß hergestellt werden können. Die Kammer nimmt insoweit vollumfänglich Bezug auf die Darstellung der Berechnungen unter III. 3. b) (2.). Dieser Wert von 4.777 möglichen Zubereitungen übersteigt die tatsächliche Anzahl der 4.468 Zubereitungen des Wirkstoffs Azacitidine.
2436883
2437Der Freispruch betrifft insoweit folgende 4.468 Taten der Anklage im Einzelnen:
2438Anklage Datum Nachname Vorname Geb.-Datum Menge
2439
969
2441
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() Die Angaben zur Einkaufsmenge beruhen auf den glaubhaften Angaben des Zeugen
Die Angaben zur Einkaufsmenge beruhen auf den glaubhaften Angaben des Zeugen
T . Die Kammer nimmt insoweit auf ihre Ausführungen unter III. 3. b) (1.) Bezug.Die Feststellungen zu den weiteren Daten zur Anzahl der Zubereitungen des Wirkstoffs Azacitidine und der Wirkstoffmenge beruhen wiederum auf den Daten des Programms Zenzy, welche die Kammer im Wege des Selbstleseverfahrens gemäß § 249 Abs. 2 StPO in die Hauptverhandlung eingeführt hat. Die Berechnungsweise der Kammer ist unter III. 3. b) (2.) erläutert.
2443970
2444c) Bendamustin
2445Für Zubereitungen mit dem Wirkstoff Bendamustin hat die Kammer den Angeklagten vom Vorwurf des Herstellens und Inverkehrbringens unterdosierter bzw. mikrobiell verunreinigter Zubereitungen in 1.394 Fällen aus tatsächlichen Gründen freigesprochen. Die Kammer hat zum Wirkstoff Bendamustin folgende Feststellungen getroffen:
2446Hinsichtlich des Wirkstoffes Bendamustin gab es im Jahre 2012 eine Fehlmenge zwischen Einkauf und Herstellungsmenge von 23.737,50 mg. Im Jahr 2013 lag die Fehlmenge bei 41.045,74 mg, im Jahr 2014 bei 32.671,00 mg und im Jahr 2015 bei 15.903 mg. Für das Jahr 2016 verfügte der Angeklagte hingegen über einen Wirkstoffüberschuss von 11.078 mg.
2447Dies führt nach den Berechnungen der Kammer dazu, dass allenfalls für 196 der Zubereitungen dieses Wirkstoffs eine Unterdosierung in Betracht zu ziehen war:
2448Die Einkaufsmenge des Wirkstoffs Bendamustin lag für die Jahre 2012 bis 2016 bei insgesamt 125.125 mg. Unter Berücksichtigung des Sicherheitszuschlages von 10 % – dazu die Ausführungen der Kammer im Rahmen der Beweiswürdigung zu den Sicherheitszuschlägen auf die Einkaufsmengen der einzelnen Wirkstoffe unter III. 3. b) (1.) – hat die Kammer einen Einkaufswert von 137.637,50 mg zugrunde gelegt. Zum Wirkstoff Bendamustin gab es im Tatzeitraum 1.394 parenterale Arzneimittelzubereitungen mit einer Gesamtmenge von 227.264,24 mg. Die durchschnittliche Zubereitung hatte mithin eine Wirkstoffmenge von 163 mg. Abzüglich des Sicherheitsabschlages von 10 % auf die durchschnittliche Herstellungsmenge ergibt sich eine Wirkstoffmenge von 146 mg. Unter der weiteren Annahme der Kammer, dass bereits die Dosierung von 80 % der deklarierten Wirkstoffmenge als noch ordnungsgemäß zu behandeln ist, ergibt sich eine durchschnittliche Wirkstoffmenge von 116 mg. Mit dieser durchschnittlichen Menge hätte eine Anzahl von 1.187 Zubereitungen ordnungsgemäß hergestellt werden können. Die Kammer nimmt insoweit vollumfänglich Bezug auf die Darstellung der Berechnungen unter III. 3. b) (2.).
2449Für das Jahr 2016 verfügte der Angeklagte zudem über hinreichend Wirkstoff für die von ihm hergestellten und abgerechneten Zubereitungen, so dass die Kammer nicht den sicheren Rückschluss auf die Vornahme von Unterdosierungen ziehen konnte.
2450![]()
![]()
![]()
![]()
![]()
![]()
![]()

![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()


![]()
998
2452
Die Angaben zur Einkaufsmenge beruhen wiederum auf den glaubhaften Angaben des
2454Zeugen T . Die Kammer nimmt insoweit auf ihre Ausführungen unter III. 3. b) (1.)Bezug. Die Feststellungen zu den weiteren Daten zur Anzahl der Zubereitungen des Wirkstoffs Bendamustin und der Wirkstoffmenge beruhen wiederum auf den Daten des Programms Zenzy, welche die Kammer im Wege des Selbstleseverfahrens gemäß § 249 Abs. 2 StPO in die Hauptverhandlung eingeführt hat. Die Berechnungsweise der Kammer ist unter III. 3. b) (2.) erläutert.
2455999
2456d) Cabazitaxel
2457Für Zubereitungen mit dem Wirkstoff Cabazitaxel hat die Kammer den Angeklagten vom Vorwurf des Herstellens und Inverkehrbringens unterdosierter bzw. mikrobiell verunreinigter Zubereitungen in 170 Fällen aus tatsächlichen Gründen freigesprochen. Die Kammer hat zum Wirkstoff Cabazitaxel folgende Feststellungen getroffen:
2458Die Einkaufsmenge des Wirkstoffs Cabazitaxel lag für die Jahre 2012 bis 2016 bei insgesamt 5.040 mg. Unter Berücksichtigung des Sicherheitszuschlages von 10 % – dazu die Ausführungen der Kammer im Rahmen der Beweiswürdigung zu den Sicherheitszuschlägen auf die Einkaufsmengen der einzelnen Wirkstoffe unter III. 3. b) (1.) – hat die Kammer einen Einkaufswert von 5.544 mg zugrunde gelegt. Zum Wirkstoff Cabazitaxel gab es im Tatzeitraum 170 parenterale Arzneimittelzubereitungen mit einer Gesamtmenge von 7.708,51 mg. Die durchschnittliche Zubereitung hatte mithin eine Wirkstoffmenge von 45 mg. Abzüglich des Sicherheitsabschlages von 10 % auf die durchschnittliche Herstellungsmenge ergibt sich eine Wirkstoffmenge von (abgerundet) 40 mg. Unter der weiteren Annahme der Kammer, dass bereits die Dosierung von 80 % der deklarierten Wirkstoffmenge als noch ordnungsgemäß zu behandeln ist, ergibt sich eine durchschnittliche Wirkstoffmenge von 32 mg. Mit der zugrunde gelegten Einkaufsmenge hätte eine Anzahl von 174 Zubereitungen ordnungsgemäß hergestellt werden können. Die Kammer nimmt insoweit vollumfänglich Bezug auf die Darstellung der Berechnungen unter III. 3. b) (2.). Dieser Wert von 174 möglichen Zubereitungen übersteigt bereits die tatsächliche Anzahl der 170 Zubereitungen des Wirkstoffs Cabazitaxel.
2459Der Freispruch betrifft insoweit folgende 170 Taten der Anklage im Einzelnen:
2460Anklage Datum Nachname Vorname Geb.-Datum Menge
2461
1003
2463
Die Angaben zur Einkaufsmenge beruhen wiederum auf den glaubhaften Angaben des
2465Zeugen T . Die Kammer nimmt insoweit auf ihre Ausführungen unter III. 3. b) (1.)Bezug. Die Feststellungen zu den weiteren Daten zur Anzahl der Zubereitungen des Wirkstoffs Cabazitaxel und der Wirkstoffmenge beruhen wiederum auf den Daten des Programms Zenzy, welche die Kammer im Wege des Selbstleseverfahrens gemäß § 249 Abs. 2 StPO in die Hauptverhandlung eingeführt hat. Die Berechnungsweise der Kammer ist unter III. 3. b) (2.) erläutert.
2466e) Carfilzomib
2467Für Zubereitungen mit dem Wirkstoff Carfilzomib hat die Kammer den Angeklagten vom Vorwurf des Herstellens und Inverkehrbringens unterdosierter bzw. mikrobiell verunreinigter Zubereitungen in 129 Fällen aus tatsächlichen Gründen freigesprochen. Die Kammer hat zum Wirkstoff Carfilzomib folgende Feststellungen getroffen:
2468Zubereitungen des Wirkstoffs Carfilzomib, der erst 2014 für den europäischen Markt
2469zugelassen wurde, wurden auch erst ab dem Jahre 2014 in der Apotheke her-gestellt. Hinsichtlich des Wirkstoffes Carfilzomib gab es im Jahre 2014 einen Einkauf von insgesamt 1.440 mg des Wirkstoffs. Die Verbrauchsmenge für 15 Zubereitungen des Wirkstoffs Carfilzomib lag bei 583,50 mg. Für das Jahr 2014 verfügte der Angeklagte mithin über hinreichend Wirkstoff für die von ihm hergestellten und abgerechneten Zubereitungen. Im Jahre 2015 stand einem Einkauf von insgesamt 1.200 mg ein Verbrauch von insgesamt 1.320 mg für 34 Zubereitungen gegenüber. Die Fehlmenge des Jahres 2015 von 120 mg erklärt sich mit dem Überschuss des Wirkstoffs Carfilzo-mib aus dem Jahr 2014 von insgesamt 856,5 mg. Für das Jahr 2016 wurde ein Einkauf von 2.760 mg bei einem Verbrauch von 6.394 mg für 80 Zubereitungen festgestellt. Für diese weiteren Zubereitungen des Jahres 2016 konnte die Kammer unter Berücksichtigung der von ihr gewählten Sicherheitszuschläge keine hinreichenden Feststellungen treffen, dass eine bestimmte Anzahl von Zubereitungen zwingend nicht mit dem
24701004
2471notwendigen Wirkstoff versetzt war: Die Einkaufsmenge lag für den gesamten Zeitraum bei 5.520 mg. Bei Berücksichtigung des Sicherheitszuschlages von 5 % – der Wirkstoff war vor dem 1. Januar 2012 noch nicht auf dem Markt, so dass ein unbekannter Anfangsbestand nicht zu berücksichtigen war – ergab sich eine Einkaufsmenge von 5.796 mg. Im Zeitraum von 2014 bis 2016 gab es insgesamt 129 Zubereitungen mit einer Gesamtmenge von 8.022,50 mg. Die durchschnittliche Herstellungsmenge betrug mithin 55 mg und bei einer Dosierung mit 80 % 44 mg. Mit der vorhandenen Wirkstoffmenge konnte (aufgerundet) eine Anzahl von 132 Zubereitungen hergestellt werden. Die Kammer nimmt insoweit vollumfänglich Bezug auf die Darstellung der Berechnungen unter III. 3. b) (2.). Dieser Wert von 132 möglichen Zubereitungen übersteigt bereits die tatsächliche Anzahl der 129 Zubereitungen des Wirkstoffs Car-filzomib.
2472Der Freispruch betrifft insoweit folgende 129 Taten der Anklage im Einzelnen:
2473Datum Nachname Vorname Geb.-Datum
2474
 Datum
Datum
Nachname
2476Vorname
2477Geb.-Datum
24781007
2479Die Angaben zur Einkaufsmenge beruhen wiederum auf den glaubhaften Angaben des
2480Zeugen T . Die Kammer nimmt insoweit auf ihre Ausführungen unter III. 3. b) (1.) Bezug. Die Feststellungen zu den weiteren Daten zur Anzahl der Zubereitungen des Wirkstoffs Carfilzomib und der Wirkstoffmenge beruhen wiederum auf den Daten des Programms Zenzy, welche die Kammer im Wege des Selbstleseverfahrens gemäß § 249 Abs. 2 StPO in die Hauptverhandlung eingeführt hat. Die Berechnungsweise der Kammer ist unter III. 3. b) (2.) erläutert.
2481f) Cyclophosphamid
2482Für Zubereitungen mit dem Wirkstoff Cyclophosphamid hat die Kammer den Angeklagten vom Vorwurf des Herstellens und Inverkehrbringens unterdosierter bzw. mikrobiell verunreinigter Zubereitungen in 4.739 Fällen aus tatsächlichen Gründen freigesprochen. Die Kammer hat zum Wirkstoff Cyclophosphamid folgende Feststellungen getroffen:
2483Die Einkaufsmenge des Wirkstoffs Cyclophosphamid lag für die Jahre 2012 bis 2016 bei insgesamt 3.393.500 mg. Unter Berücksichtigung des Sicherheitszuschlages von 10 % – dazu die Ausführungen der Kammer im Rahmen der Beweiswürdigung zu den Sicherheitszuschlägen auf die Einkaufsmengen der einzelnen Wirkstoffe unter III. 3. b) (1.) – hat die Kammer einen Einkaufswert von 3.732.850 mg zugrunde gelegt. Zum Wirkstoff Cyclophosphamid gab es im Tatzeitraum 4.739 parenterale Arzneimittelzubereitungen mit einer Gesamtmenge von 5.379.462,84 mg. Die durchschnittliche Zubereitung hatte mithin eine Wirkstoffmenge von 1.135 mg. Abzüglich des Sicherheitsabschlages von 10 % auf die durchschnittliche Herstellungsmenge ergibt sich eine Wirkstoffmenge von (abgerundet) 1.021 mg. Unter der weiteren Annahme der Kammer, dass bereits die Dosierung von 80 % der deklarierten Wirkstoffmenge als noch ordnungsgemäß zu behandeln ist, ergibt sich eine durchschnittliche Wirkstoff-menge von 816 mg. Mit der zugrunde gelegten Einkaufsmenge hätte eine Anzahl von 4.575 Zubereitungen ordnungsgemäß hergestellt werden können. Die Differenz zu den tatsächlich hergestellten Zubereitungen liegt bei Berücksichtigung des weiteren Sicherheitsabschlages von 5 % bei 155 parenteralen Arzneimittelzubereitungen. Die Kammer nimmt insoweit vollumfänglich Bezug auf die Darstellung der Berechnungen unter III. 3. b) (2.). Diese geringe Differenz von 155 Zubereitungen macht nur rund 3 %
24841008
2485der Gesamtzahl der Zubereitungen von Cyclophosphamid aus. Unter Berücksichtigung des weiteren Umstandes, dass es sich bei Cyclophosphamid um einen sehr günstigen Wirkstoff handelte – der Einkaufspreis liegt bei rund 0,01 Euro pro mg - der finanzielle Anreiz für Unterdosierungen für den Angeklagten mithin jedenfalls gemindert war, hat sich die Kammer für den Wirkstoff Cyclophosphamid keine hinreichende Überzeugung davon bilden können, dass die 155 parenteralen Arzneimittelzubereitungen sicher unterdosiert waren.
2486Der Freispruch betrifft insoweit folgende 4.739 Taten der Anklage im Einzelnen:
24871100
2488
Die Angaben zur Einkaufsmenge beruhen wiederum auf den glaubhaften Angaben des
2490Zeugen T . Die Kammer nimmt insoweit auf ihre Ausführungen unter III. 3. b) (1.)Bezug. Die Feststellungen zu den weiteren Daten zur Anzahl der Zubereitungen des Wirkstoffs Cyclophosphamid und der Wirkstoffmenge beruhen wiederum auf den Daten des Programms Zenzy, welche die Kammer im Wege des Selbstleseverfahrens gemäß § 249 Abs. 2 StPO in die Hauptverhandlung eingeführt hat. Die Berechnungsweise der Kammer ist unter III. 3. b) (2.) erläutert.
24911101
2492g) Decitabin (für das Jahr 2013)
2493Für Zubereitungen mit dem Wirkstoff Decitabin hat die Kammer den Angeklagten vom Vorwurf des Herstellens und Inverkehrbringens unterdosierter bzw. mikrobiell verunreinigter Zubereitungen für das Jahr 2013 in fünf Fällen aus tatsächlichen Gründen freigesprochen. Die Kammer hat zum Wirkstoff Decitabin folgende Feststellungen getroffen:
2494Der Wirkstoff Decitabin wurde erst ab dem Jahre 2013 von dem Angeklagten verwendet. Hinsichtlich des Wirkstoffes Decitabin gab es im Jahre 2013 einen Einkauf von insgesamt 250 mg des Wirkstoffs. Die Verbrauchsmenge lag bei 184 mg. Hergestellt und in Verkehr gebracht wurden insgesamt fünf parenterale Arzneimittelzubereitungen des Wirkstoffs Decitabin. Für das Jahr 2013 verfügte der Angeklagte mithin über hinreichend Wirkstoff für die von ihm hergestellten und abgerechneten Zubereitungen, so dass insoweit ein Freispruch aus tatsächlichen Gründen erfolgte.
2495Der Freispruch betrifft insoweit folgende fünf Taten der Anklage im Einzelnen:
2496Anklage Datum Nachname Vorname Geb.-Datum Menge
2497
Die Angaben zur Einkaufsmenge beruhen wiederum auf den glaubhaften Angaben des
2499Zeugen T . Die Kammer nimmt insoweit auf ihre Ausführungen unter III. 3. b) (1.)Bezug. Die Feststellungen zu den weiteren Daten zur Anzahl der Zubereitungen des Wirkstoffs Decitabin und der Wirkstoffmenge beruhen wiederum auf den Daten des Programms Zenzy, welche die Kammer im Wege des Selbstleseverfahrens gemäß § 249 Abs. 2 StPO in die Hauptverhandlung eingeführt hat. Die Berechnungsweise der Kammer ist unter III. 3. b) (2.) erläutert. Die Kammer hat zugunsten des Angeklagten die für die fünf Zubereitungen erforderliche Wirkstoffmenge bei der Gesamtberechnung nicht in Abzug gebracht.
2500![]()
![]()
![]()
![]()
![]()
![]()
![]()

![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()

![]()
![]()


![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()


![]()
![]()
![]()

![]()
![]()
![]()
![]()
![]()

![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Die Feststellungen zur Studienware der Wirkstoffe Doxorubicin und Myocet und der Wirkstoffmenge beruhen wiederum auf den Daten des Programms Zenzy, welches die Studienware ebenfalls erfasst, insoweit aber eine gesonderte Markierung vorsieht.
25061113
2507(2) Zubereitungen ohne Studienware
2508Die Kammer hat den Angeklagten für Zubereitungen mit den Wirkstoffen Doxorubicin und Myocet in weiteren 1.026 Fällen der Anklage aus tatsächlichen Gründen freigesprochen. Die Kammer hat insoweit folgende Feststellungen getroffen:
2509Die Anklage führt auf der Wirkstoffliste (S. 5 der Anklage) allein den Wirkstoff „DoxorubicinCaelyx“ mit einer Quote von 53,39 % auf, dessen Zubereitungen vermeintlich unterdosiert worden seien. Gemeint ist insoweit vermeintlich der Wirkstoff „Doxorubicin liposomal caelyx“. In den einzeln aufgeführten Taten 1 bis 61.863 der Anklage finden sich insgesamt (ohne Studienware) 852 Fälle mit einem Wirkstoff, der als „Doxorubicin lipos“ angegeben ist, und 174 Fälle mit einem Wirkstoff, der als „Myocet“ angegeben ist. Bei den Fällen des Wirkstoffs „Doxorubicin lipos“ findet sich als Handelsname des Präparates sowohl der Name „Myocet“ als auch der Name „Caelyx“. Nach den Feststellungen der Kammer findet sich bei den Wirkstoffen
2510![]() parenteraler Arzneimittelzubereitungen der Apotheke zusätzlich auch derWirkstoff „Doxorubicin liposomal myocet“ und der Wirkstoff „Adriamycin-Doxorubicin“. Der Wirkstoff „Adriamycin-Doxorubicin“ hat den Herstellernamen „Doxorubicin Die Wirkstoffe „Doxorubicin liposomal myocet“ und „Adriamycin-Doxorubicin“ sind nicht Gegenstand der Anklage, da die Quote von Einkauf und Herstellung über dem Grenzwert der Staatsanwaltschaft von 80 % lag, namentlich bei 89,31 % bei „Doxorubicin liposomal myocet“ und 98,03 % für „Adriamycin-Doxorubicin“. Da jedenfalls der Handelsname des Präparates Myocet auch den Zubereitungen des Wirkstoffs „Doxorubicin lipos.“ zugeordnet wurde, konnte die Kammer keine hinreichenden Feststellungen treffen, welche Einkaufsmengen sich auf welche Zubereitung der Anklage bezogen. Wegen dieser Unklarheiten konnte die Kammer für die Fälle des Wirkstoffs „Doxorubicin lipos.“ auch nicht die hinreichende Überzeugung erlangen, dass Zubereitungen dieses Wirkstoffs unterdosiert waren.
parenteraler Arzneimittelzubereitungen der Apotheke zusätzlich auch derWirkstoff „Doxorubicin liposomal myocet“ und der Wirkstoff „Adriamycin-Doxorubicin“. Der Wirkstoff „Adriamycin-Doxorubicin“ hat den Herstellernamen „Doxorubicin Die Wirkstoffe „Doxorubicin liposomal myocet“ und „Adriamycin-Doxorubicin“ sind nicht Gegenstand der Anklage, da die Quote von Einkauf und Herstellung über dem Grenzwert der Staatsanwaltschaft von 80 % lag, namentlich bei 89,31 % bei „Doxorubicin liposomal myocet“ und 98,03 % für „Adriamycin-Doxorubicin“. Da jedenfalls der Handelsname des Präparates Myocet auch den Zubereitungen des Wirkstoffs „Doxorubicin lipos.“ zugeordnet wurde, konnte die Kammer keine hinreichenden Feststellungen treffen, welche Einkaufsmengen sich auf welche Zubereitung der Anklage bezogen. Wegen dieser Unklarheiten konnte die Kammer für die Fälle des Wirkstoffs „Doxorubicin lipos.“ auch nicht die hinreichende Überzeugung erlangen, dass Zubereitungen dieses Wirkstoffs unterdosiert waren.
Der Freispruch betrifft insoweit folgende 852 Taten der Anklage für den Wirkstoff Doxorubicin lipos. im Einzelnen:
2512 ![]()
Anklage Datum |
Nachname |
Vorname |
Geb.-Datum |
Menge |
||||||
1130
2515
Aufgrund der vorgenannten Erwägungen konnte die Kammer auch für die Fälle der Anklage, die den Wirkstoff Myocet anführen, keine hinreichende Überzeugung gewinnen, dass diese Fälle unterdosiert waren. Für den Wirkstoff Myocet ergibt sich auch bei einer Gegenüberstellung der Zubereitungen der Anklage mit den Einkaufsmengen für „Doxorubicin liposomal myocet“ nicht, dass es an Wirkstoff zur Herstellung der Zubereitungen fehlte:
2517Die Einkaufsmenge des Wirkstoffs Myocet – die Kammer legt insoweit den Wert für „Doxorubicin liposomal myocet“ zugrunde – lag für die Jahre 2012 bis 2016 bei insgesamt 12.850 mg. Unter Berücksichtigung des Sicherheitszuschlages von 15 % – dazu die Ausführungen der Kammer im Rahmen der Beweiswürdigung zu den Sicherheitszuschlägen auf die Einkaufsmengen der einzelnen Wirkstoffe unter III. 3. b) (1.) – hat die Kammer einen Einkaufswert von 14.777,5 mg zugrunde gelegt. Zum Wirkstoff Myocet gab es im Tatzeitraum 174 parenterale Arzneimittelzubereitungen (die Studienware insoweit ausgenommen) mit einer Gesamtmenge von 14.387,50 mg. Die durchschnittliche Zubereitung hatte mithin eine Wirkstoffmenge von 82 mg. Abzüglich des Sicherheitsabschlages von 10 % auf die
2518

![]()
![]()
![]()
![]() 1131
1131
durchschnittliche Herstellungsmenge ergibt sich eine Wirkstoffmenge von (abgerundet) 73 mg. Unter der weiteren Annahme der Kammer, dass bereits die Dosierung von 80 % der deklarierten Wirkstoffmenge als noch ordnungsgemäß zu behandeln ist, ergibt sich eine durchschnittliche Wirkstoffmenge von 58 mg. Mit der zugrunde gelegten Einkaufsmenge hätte eine Anzahl von 255 Zubereitungen ordnungsgemäß hergestellt werden können. Die Kammer nimmt insoweit vollumfänglich Bezug auf die Darstellung der Berechnungen unter III. 3. b) (2.). Dieser Wert von 255 möglichen Zubereitungen übersteigt bereits die tatsächliche Anzahl der 174 Zubereitungen des Wirkstoffs Myocet.
2520Der Freispruch betrifft weiter folgende 174 Taten der Anklage für den Wirkstoff Myocet im Einzelnen:
2521![]()

![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()

![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()

![]()
![]() Die Angaben zur Einkaufsmenge beruhen wiederum auf den glaubhaften Angaben des
Die Angaben zur Einkaufsmenge beruhen wiederum auf den glaubhaften Angaben des
Zeugen T . Die Kammer nimmt insoweit auf ihre Ausführungen unter III. 3. b) (1.)Bezug. Die Feststellungen zu den weiteren Daten zur Anzahl der Zubereitungen des Wirkstoffe Doxorubicin und Myocet und der Wirkstoffmenge beruhen wiederum auf den Daten des Programms Zenzy, welche die Kammer im Wege des Selbstleseverfahrens gemäß § 249 Abs. 2 StPO in die Hauptverhandlung eingeführt hat. Die Berechnungsweise der Kammer ist unter III. 3. b) (2.) erläutert.
25241135
2525i) Fluorouracil Natriumfolinat
2526Für Zubereitungen mit dem Wirkstoff Fluorouracil Natriumfolinat hat die Kammer den Angeklagten vom Vorwurf des Herstellens und lnverkehrbringens unterdosierter bzw. mikrobiell verunreinigter Zubereitungen in 257 Fällen aus tatsächlichen Gründen freigesprochen. Die Kammer hat zum Wirkstoff Fluorouracil Natriumfolinat folgende Feststellungen getroffen:
2527Zum Wirkstoff Fluorouracil Natriumfolinat lag die Einkaufsmenge für die Jahre 2012 bis 2016 bei einer Gesamtmenge von 54.742.000 mg. Die Gesamtmenge der Zubereitungen mit dem Wirkstoff Fluorouracil Natriumfolinat lag bei 50.601.791 mg. Demzufolge war die Einkaufsmenge höher als die Herstellungsmenge. Aufgrund dieser übersteigenden Einkaufsmenge findet sich der Wirkstoff Fluorouracil Natriumfolinat auch nicht in der Wirkstoffliste der Anklage (dort S. 5), die die Wirkstoffe, hinsichtlich derer die Unterdosierungen angenommen werden, abschließend aufzählen soll. Die Auflistung der Anklage betrifft nur solche Wirkstoffe, bei denen die Differenz zwischen Einkaufsmenge und Herstellungsmenge mindestens 80 % beträgt. Vorliegend liegt der Wert bei 108,18 %. In den einzeln aufgeführten Taten der Anklage fanden sich dennoch vereinzelt insgesamt 257 Zubereitungen des Wirkstoffs Fluorouracil Natriumfolinat. Hinsichtlich dieser Zubereitungen hat die Kammer —ebenso wie auch die Staatsanwaltschaft — keine Ansatzpunkte für Unterdosierungen gesehen und den Angeklagten aus tatsächlichen Gründen freigesprochen.
2528Der Freispruch betrifft insoweit folgende 257 Taten der Anklage im Einzelnen:
2529Anklage |
Datum |
Nachname |
Vorname |
Geb.-Datum |
Menge |
|||||


![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()

![]()

![]()
![]()

1141
2532j) Folinsäure bzw. Folinsäure/Mischung
2533Für Zubereitungen mit dem Wirkstoff Folinsäure/Folinsäure Mischung hat die Kammer den Angeklagten vom Vorwurf des Herstellens und Inverkehrbringens unterdosierter bzw. mikrobiell verunreinigter Zubereitungen in 12.879 Fällen aus tatsächlichen Gründen freigesprochen. Die Kammer hat zum Wirkstoff Folinsäure/Folinsäure Mischung folgende Feststellungen getroffen:
2534Die Einkaufsmenge des Wirkstoffs Folinsäure/Folinsäure Mischung lag für die Jahre 2012 bis 2016 bei insgesamt 6.607.300 mg. Unter Berücksichtigung des Sicherheitszuschlages von 10 % – dazu die Ausführungen der Kammer im Rahmen der Beweiswürdigung zu den Sicherheitszuschlägen auf die Einkaufsmengen der einzelnen Wirkstoffe unter III. 3. b) (1.) – hat die Kammer einen Einkaufswert von 7.268.030 mg zugrunde gelegt. Zum Wirkstoff Folinsäure/Folinsäure Mischung gab es im Tatzeitraum 12.879 parenterale Arzneimittelzubereitungen mit einer Gesamtmenge von 9.531.521 mg. Die durchschnittliche Zubereitung hatte mithin eine Wirkstoffmenge von 740 mg. Abzüglich des Sicherheitsabschlages von 10 % auf die durchschnittliche Herstellungsmenge ergibt sich eine Wirkstoffmenge von (abgerundet) 666 mg. Unter der weiteren Annahme der Kammer, dass bereits die Dosierung von 80 % der deklarierten Wirkstoffmenge als noch ordnungsgemäß zu behandeln ist, ergibt sich eine durchschnittliche Wirkstoffmenge von 532 mg. Mit der zugrunde gelegten Einkaufsmenge hätte eine Anzahl von 13.662 Zubereitungen ordnungsgemäß hergestellt werden können. Die Kammer nimmt insoweit vollumfänglich Bezug auf die Darstellung der Berechnungen unter III. 3. b) (2.). Dieser Wert von 13.662 möglichen Zubereitungen übersteigt bereits die tatsächliche Anzahl der 12.879 Zubereitungen des Wirkstoffs Folinsäure/Folinsäure Mischung.
2535Der Freispruch betrifft insoweit folgende 12.879 Taten der Anklage im Einzelnen:
2536 
Anklage |
Datum |
Nachname |
Vorname |
Geb.-Datum |
Menge |
||||||||||
|
|||||||||||||||
1384
2539
Die Angaben zur Einkaufsmenge beruhen wiederum auf den glaubhaften Angaben des
2541Zeugen T . Die Kammer nimmt insoweit auf ihre Ausführungen unter III. 3. b) (1.)Bezug. Die Feststellungen zu den weiteren Daten zur Anzahl der Zubereitungen des
25421385
2543Wirkstoffs Folinsäure/Folinsäure Mischung und der Wirkstoffmenge beruhen wiederum auf den Daten des Programms Zenzy, welche die Kammer im Wege des Selbstleseverfahrens gemäß § 249 Abs. 2 StPO in die Hauptverhandlung eingeführt hat. Die Berechnungsweise der Kammer ist unter III. 3. b) (2.) erläutert.
25441386
2545k) Temsirolimus (für das Jahr 2012)
2546Für Zubereitungen mit dem Wirkstoff Temsirolimus hat die Kammer den Angeklagten vom Vorwurf des Herstellens und lnverkehrbringens unterdosierter bzw. mikrobiell verunreinigter Zubereitungen für das Jahr 2012 in 64 Fällen aus tatsächlichen Gründen freigesprochen. Die Kammer hat zum Wirkstoff Temsirolimus folgende Feststellungen getroffen:
2547Hinsichtlich des Wirkstoffes Temsirolimus gab es im Jahre 2012 einen Einkauf von insgesamt 1.980 mg des Wirkstoffs. Die Verbrauchsmenge laut Zenzy lag bei 2.080 mg. Hergestellt und in Verkehr gebracht wurden insgesamt fünf parenterale Arzneimittelzubereitungen des Wirkstoffs Temsirolimus. Für das Jahr 2012 verfügte der Angeklagte mithin — unter Berücksichtigung von Sicherheitszuschlägen und der Annahme, dass eine nicht unerhebliche Qualitätsminderung erst ab einer Dosis von unter 80 % vorliegt — über hinreichend Wirkstoff für die von ihm hergestellten und abgerechneten Zubereitungen des Wirkstoffs Temsirolimus, so dass insoweit ein Freispruch aus tatsächlichen Gründen erfolgte.
2548Der Freispruch betrifft insoweit folgende 64 Taten der Anklage im Einzelnen:
2549Anklage |
Datum |
Nachname |
Vorname |
Geb.-Datum |
Menge |
|

![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()

![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()

![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()

![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()

![]()
![]()
1388
2552Wirkstoffs Temsirolimus und der Wirkstoffmenge beruhen wiederum auf den Daten des Programms Zenzy, welche die Kammer im Wege des Selbstleseverfahrens gemäß § 249 Abs. 2 StPO in die Hauptverhandlung eingeführt hat. Die Berechnungsweise der Kammer ist unter III. 3. b) (2.) erläutert.
2553l) Topotecan
2554Für Zubereitungen mit dem Wirkstoff Topotecan hat die Kammer den Angeklagten vom Vorwurf des Herstellens und Inverkehrbringens unterdosierter bzw. mikrobiell verunreinigter Zubereitungen in 644 Fällen aus tatsächlichen Gründen freigesprochen. Die Kammer hat zum Wirkstoff Topotecan folgende Feststellungen getroffen:
2555Die Einkaufsmenge des Wirkstoffs Topotecan lag für die Jahre 2012 bis 2016 bei insgesamt 2.410 mg. Unter Berücksichtigung des Sicherheitszuschlages von 10 % – dazu die Ausführungen der Kammer im Rahmen der Beweiswürdigung zu den Sicherheitszuschlägen auf die Einkaufsmengen der einzelnen Wirkstoffe unter III. 3. b) (1.) – hat die Kammer einen Einkaufswert von 2.651 mg zugrunde gelegt. Zum Wirkstoff Topotecan gab es im Tatzeitraum 644 parenterale Arzneimittelzubereitungen mit einer Gesamtmenge von 4.266,46 mg. Die durchschnittliche Zubereitung hatte mithin eine Wirkstoffmenge von 6,6 mg. Abzüglich des Sicherheitsabschlages von 10 % auf die durchschnittliche Herstellungsmenge ergibt sich eine Wirkstoffmenge von (abgerundet) 5,9 mg. Unter der weiteren Annahme der Kammer, dass bereits die Dosierung von 80 % der deklarierten Wirkstoffmenge als noch ordnungsgemäß zu behandeln ist, ergibt sich eine durchschnittliche Wirkstoffmenge von 4,7 mg. Mit der zugrunde gelegten Einkaufsmenge hätte eine Anzahl von 564 Zubereitungen ordnungsgemäß hergestellt werden können. Die Kammer nimmt insoweit vollumfänglich Bezug auf die Darstellung der Berechnungen unter III. 3. b) (2.). Da der Angeklagte für das Jahr 2016 über einen Überschuss an Wirkstoff verfügte – die Quote zwischen Einkauf und Herstellung lag insoweit bei 104,62 % – konnte die Kammer keine hinreichende Überzeugung bilden, dass die parenteralen Arzneimittelzubereitungen für das Jahr 2016 und die Vorjahre 2012-2015 sicher unterdosiert wurden. Die fehlende Überzeugung der Kammer gründet sich auch darauf, dass der Wirkstoff Topotecan auch im Hinblick auf die Wirkstoffmenge einer Zubereitung vergleichsweise günstig ist – der Einkaufspreis liegt bei rund 27 Euro pro
25561389
2557mg, so dass der finanzielle Anreiz des Angeklagte jedenfalls gemindert ist. Der Freispruch betrifft insoweit folgende 644 Taten der Anklage im Einzelnen:
2558


![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()

![]()
![]()
![]() Nachname
Nachname

![]() Die Angaben zur Einkaufsmenge beruhen wiederum auf den glaubhaften Angaben des
Die Angaben zur Einkaufsmenge beruhen wiederum auf den glaubhaften Angaben des
Zeugen T . Die Kammer nimmt insoweit auf ihre Ausführungen unter III. 3. b) (1.)Bezug. Die Feststellungen zu den weiteren Daten zur Anzahl der Zubereitungen des Wirkstoffs Topotecan und der Wirkstoffmenge beruht wiederum auf den Daten des Programms Zenzy, welche die Kammer im Wege des Selbstleseverfahrens gemäß § 249 Abs. 2 StPO in die Hauptverhandlung eingeführt hat. Die Berechnungsweise der Kammer ist unter III. 3. b) (2.) erläutert.
25611402
2562m) Vinflunin (für das Jahr 2012)
2563Für Zubereitungen mit dem Wirkstoff Vinflunin hat die Kammer den Angeklagten vom Vorwurf des Herstellens und Inverkehrbringens unterdosierter bzw. mikrobiell verunreinigter Zubereitungen für das Jahr 2012 in einem Fällen aus tatsächlichen Gründen freigesprochen. Die Kammer hat zum Wirkstoff Vinflunin insoweit folgende Feststellungen getroffen:
2564Im Jahr 2012 wurde in der Apotheke eine Zubereitung mit dem Wirkstoff Vinflunin mit einer Wirkstoffmenge von 454 mg hergestellt. Eingekauft wurde im Jahr 2012 eine Menge von 500 mg des Wirkstoffs Vinflunin, so dass eine negative Differenz zwischen Einkauf und Herstellung nicht festzustellen war.
2565Der Freispruch betrifft insoweit folgende Tat der Anklage:
2566Anklage Datum Nachname Vorname Geb.-Datum Menge
2567![]()
![]()
![]()
![]()
![]()
![]() Die Angaben zur Einkaufsmenge beruhen wiederum auf den glaubhaften Angaben des
Die Angaben zur Einkaufsmenge beruhen wiederum auf den glaubhaften Angaben des
Zeugen T . Die Kammer nimmt insoweit auf ihre Ausführungen unter III. 3. b) (1.) Bezug. Die weiteren Daten zur Anzahl der Zubereitungen des Wirkstoffs Vinflunin und der Wirkstoffmenge beruht wiederum auf den Daten des Programms Zenzy, welche die Kammer im Wege des Selbstleseverfahrens gemäß § 249 Abs. 2 StPO in die Hauptverhandlung eingeführt hat.
2569n) Vinorelbin
2570Für Zubereitungen mit dem Wirkstoff Vinorelbin hat die Kammer den Angeklagten vom Vorwurf des Herstellens und Inverkehrbringens unterdosierter bzw. mikrobiell verunreinigter Zubereitungen in 3.962 Fällen aus tatsächlichen Gründen freigesprochen. Die Kammer hat zum Wirkstoff Vinorelbin folgende Feststellungen getroffen:
2571Die Einkaufsmenge des Wirkstoffs Vinorelbin lag für die Jahre 2012 bis 2016 bei
25721403
2573insgesamt 84.870 mg. Unter Berücksichtigung des Sicherheitszuschlages von 10 % – dazu die Ausführungen der Kammer im Rahmen der Beweiswürdigung zu den Sicherheitszuschlägen auf die Einkaufsmengen der einzelnen Wirkstoffe unter III. 3. b) (1.) – hat die Kammer einen Einkaufswert von 93.357 mg zugrunde gelegt. Zum Wirkstoff Vinorelbin gab es im Tatzeitraum 3.962 parenterale Arzneimittelzubereitungen mit einer Gesamtmenge von 178.070,90 mg. Die durchschnittliche Zubereitung hatte mithin eine Wirkstoffmenge von 44,9 mg. Abzüglich des Sicherheitsabschlages von 10 % auf die durchschnittliche Herstellungsmenge ergibt sich eine Wirkstoffmenge von (abgerundet) 40 mg. Unter der weiteren Annahme der Kammer, dass bereits die Dosierung von 80 % der deklarierten Wirkstoffmenge als noch ordnungsgemäß zu behandeln ist, ergibt sich eine durchschnittliche Wirkstoffmenge von 32 mg. Mit der zugrunde gelegten Einkaufsmenge hätte eine Anzahl von 2.918 Zubereitungen ordnungsgemäß hergestellt werden können. Die Kammer nimmt insoweit vollumfänglich Bezug auf die Darstellung der Berechnungen unter III. 3. b) (2.). Da der Angeklagte für das Jahr 2016 über einen Überschuss an Wirkstoff verfügte – die Quote zwischen Einkauf und Herstellung lag insoweit bei 119 % – konnte die Kammer keine hinreichende Überzeugung bilden, dass die parenteralen Arzneimittelzubereitungen für das Jahr 2016 und die Vorjahre 2012-2015 sicher unterdosiert wurden. Die fehlende Überzeugung der Kammer gründet sich auch darauf, dass der Wirkstoff Vinorelbin auch im Hinblick auf die Wirkstoffmenge einer Zubereitung vergleichsweise günstig ist – der Einkaufspreis liegt bei rund 1,10 Euro pro mg, so dass der finanzielle Anreiz des Angeklagte jedenfalls gemindert ist.
2574Der Freispruch betrifft insoweit folgende 3.962 Taten der Anklage im Einzelnen:
2575Anklage Datum Nachname Vorname Geb.-Datum Menge
2576
1480
2578Die Angaben zur Einkaufsmenge beruhen wiederum auf den glaubhaften Angaben des
2579Zeugen T . Die Kammer nimmt insoweit auf ihre Ausführungen unter III. 3. b) (1.)Bezug. Die weiteren Daten zur Anzahl der Zubereitungen des Wirkstoffs Vinorelbin und der Wirkstoffmenge beruht wiederum auf den Daten des Programms Zenzy, welche die Kammer im Wege des Selbstleseverfahrens gemäß § 249 Abs. 2 StPO in die Hauptverhandlung eingeführt hat. Die Berechnungsweise der Kammer ist unter III. 3. b) (2.) erläutert.
25801481
25815. Teilfreispruch für „Augenspritzen“
2582Die Anklageschrift enthält 2.317 Fälle, die sich auf die Zubereitung so genannter Augenspritzen mit dem Wirkstoff Bevacizumab beziehen. Die Kammer spricht den Angeklagten frei, weil in diesen Fällen weder eine Unterdosierung noch eine mikrobielle Verunreinigung festzustellen ist.
2583Die Kammer hat folgende Feststellungen getroffen:
2584Der Wirkstoff Bevacizumab (Handelsname: Avastin), ein monoklonaler Antikörper, wird neben dem Einsatz in onkologischer Therapien auch im sog. „Off-Label-Use“ zur Behandlung von Augenkrankheiten eingesetzt, und zwar in Form von Augenspritzen.
2585Die Apotheke hatte es übernommen, Augenärzte und Augenkliniken zu beliefern.Die Augenspritzen enthalten - im Vergleich zu onkologischen Zubereitungen mit Be-vacizumab - nur kleinste Wirkstoffmengen zwischen 1,25 mg und 3,75 mg. Jedenfalls
2586ab März 2015 wurden diese Spritzen weit überwiegend von der Zeugin K herge-stellt. Unterdosierungen und mikrobielle Verunreinigungen waren nicht festzustellen (zu den mikrobiellen Verunreinigungen siehe bereits oben).
2587Die Feststellungen der Kammer beruhen insoweit auf den glaubhaften Angaben der Zeugin K , die ihre entsprechende Tätigkeit zur Überzeugung der Kammer geschildert hat. Die Daten zu den Taten, die sich auf die Spritzen des Wirkstoffs Bevacizumab beziehen, entstammen den Daten des Programms Zenzy.
2588Die Kammer war nicht überzeugt, dass der Angeklagte oder ein Mitarbeiter des Rein-raumlabors auf seine Veranlassung Unterdosierungen dieser Augenspritzen vorgenommen hat. Dies beruht auf folgenden Erwägungen:
2589Die Kammer nimmt zunächst nicht an, dass die Zeugin K im Zeitraum ihrer Tätigkeit
2590in der Apotheke von März 2015 bis zur Durchsuchung Unterdosierungen vorge-
2591nommen hat. Die Zeugin K hat sich neben dem Zeugen P an der Aufdeckungder Unterdosierungen beteiligt und mit den polizeilichen Ermittlungsbeamten kooperiert. Als einzige Mitarbeiterin des Reinraumlabors hat sie in der Hauptverhandlung umfassende Angaben zu den dortigen Abläufen gemacht. Sie gab glaubhaft an, selbst keine Unterdosierungen vorgenommen zu haben. Auch habe sie von Unterdosierungen des Angeklagten oder anderer Mitarbeiter des Reinraumlabors nichts mitbekommen.
2592
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()


![]()
![]()
![]()
![]()

![]()
![]()
1528
2595IX. Adhäsionsverfahren
2596Von einer Entscheidung über die Anträge der Adhäsionsklägerinnen S
2597und S r hat die Kammer gemäß § 406 Abs. 1 S. 3 StPO abgesehen. DieAnträge erscheinen unbegründet.
25981. Adhäsionsantrag der S vom 25.04.2017
2599Die Adhäsionsklägerin S begehrt mit ihrem Antrag vom 25.04.2017 den
2600Ersatz ihres vermeintlichen finanziellen Schadens in Höhe von 7.295,00 Euro sowie Zuerkennung eines angemessen Schmerzensgeldes.
2601Insoweit erscheint der Antrag unbegründet im Sinne des § 406 Abs. 1 S. 3 StPO. Die Kammer konnte eine konkrete Zuordnung der Taten, wegen derer der Angeklagte ver-
2602urteilt wurde, zu einzelnen Patienten bzw. Kunden der Apotheke nicht vorneh-men. Insoweit konnte die Kammer auch nicht feststellen, dass die Adhäsionsklägerin im Rahmen der Taten, die sie betreffen (Taten 40.613, 41.574, 42.550, 43.500, 45.452, 46.743, 47.724, 49.018, 50.185, 51.456, 52.860, 54.314, 55.695 der Anklage) eine minderdosierte Zubereitung des Wirkstoffs Denosumab erhalten hat. Insoweit erscheint weder ein Rückzahlungsanspruch noch ein Schmerzensgeldanspruch aus schadensersatzrechtlichen Gesichtspunkten begründet.
26032. Adhäsionsantrag der S r vom 03.02.2018
2604Die Adhäsionsklägerin S r begehrt mit ihren Antrag vom 03.02.2018 die
2605Zahlung eines Schmerzensgeldes, dessen Höhe in das Ermessen des Gerichts gestellt werde. Zur Begründung wird ausgeführt, dass die Adhäsionsklägerin eine der am 29.11.2016 beschlagnahmten unterdosierten Zubereitungen hätte erhalten sollen. Durch die Information dieses Umstandes habe sie einen starken Schock erlitten.
2606Insoweit erscheint der Antrag unbegründet im Sinne des § 406 Abs. 1 S. 3 StPO. Eine versuchte Körperverletzung zum Nachteil der Adhäsionsklägerin liegt nicht vor. Allein der Vorgang des Herstellens durch den Angeklagten – ein Inverkehrbringen liegt gerade nicht vor – führt nicht zu einer persönlichen Betroffenheit der Adhäsionsklägerin. Die behaupteten Folgen und deren Kausalzusammenhang zum Herstellen der unterdosierten parenteralen Arzneimittelzubereitungen sind nicht offensichtlich begründet.
26071529
2608X. Kostenentscheidung
2609Die Kostenentscheidung beruht auf §§ 465, 467 Abs. 1 StPO.
2610Bei den Kosten der Nebenklage hat die Kammer dem Angeklagten gemäß § 472 Abs.
26111 S. 1 StPO die notwendigen Auslagen derjenigen Nebenkläger auferlegt, die von den konkret feststellbaren unterdosierten Zubereitungen des Tages der Durchsuchung betroffen waren. Insoweit reicht es aus, dass die Taten des 28./29.11.2016 denselben geschichtlichen Vorgang im Sinne des § 264 StPO betreffen, der der Nebenklage zu Grunde liegt, und dass sie sich gegen den Nebenkläger als Träger eines strafrechtlich geschützten Rechtsguts richten Es ist nicht erforderlich, dass es zur Verurteilung wegen des Nebenklagedelikts kommt (vgl. BGH, Beschluss vom 22.12.2005, Az.: 4 StR 347/05). Das Arzneimittelgesetz schützt ausweislich § 1 AMG die Sicherheit im Verkehr mit Arzneimitteln im Interesse einer ordnungsgemäßen Arzneimittelversorgung des Menschen. Damit sind auch die benannten Nebenkläger von diesem gesetzlichen Schutzbereich erfasst.
2612Im Übrigen war eine Entscheidung nicht veranlasst. Eine Auferlegung der notwendigen Auslagen der weiteren Nebenkläger auf den Angeklagten gemäß § 472 Abs. 1 S. 1 StPO kam nicht in Betracht. Zugunsten des Angeklagten hat die Kammer für die Kostenentscheidung insoweit angenommen, dass die minderdosierten onkologischen Zubereitungen nicht für einen der Nebenkläger gefertigt worden sind.
2613Die Kostenentscheidung hinsichtlich des Adhäsionsverfahrens beruht auf § 472a Abs.
26142 S. 1 StPO. Auch insoweit nahm die Kammer für die Kostenentscheidung zugunsten des Angeklagten an, dass die onkologischen Zubereitungen für die Adhäsionsklägerinnen ordnungsgemäß dosiert waren.
26151530
2616XI. Bisher nicht beschiedene Beweisanträge
2617Die Kammer hatte gemäß § 244 Abs. 6 S. 3 StPO Beweisanträge im Urteil zu bescheiden:
26181. Beweisantrag der Rechtsanwälte S und R vom 29.06.2018
2619Der Antrag der Rechtsanwälte S und R vom 29.06.2018 auf Verneh-
2620mung des Zeugen zum Beweis der Tatsache,
2621dass der Angeklagte "als Bauherr beispielsweise Arbeiten stets lediglich delegiert und auch irrationale Entscheidungen getroffen hat, wie beispielsweise für die Elektroinstallation in seinem Privathaus 900.000 Euro zu zahlen, obwohl der Architekt lediglich 400.000 Euro für dasselbe Gewerk für erforderlich hielt oder
2622dass er ohne Rechnung den Stahlbauer der Firma mit der komplettenAngebotssumme in Höhe von ca. 144.000 Euro bevorschusste, obwohl üblicherweise nach Leistungsphasen bezahlt wird",
2623wird zurückgewiesen aus den folgenden Gründen:
2624Die Tatsache, dass der Angeklagte "als Bauherr beispielsweise Arbeiten stets lediglich delegiert" habe, kann gemäß § 244 Abs. 3 S. 2 StPO so behandelt werden, als wäre sie wahr. Die Kammer nimmt ohne weiteres an, dass der viel beschäftigte Angeklagte in seinen verschiedenen Bauprojekten nicht selbst auf der Baustelle Hand angelegt oder Planungsleistungen selbst erbracht hat.
2625Die Modalitäten der Bezahlung der Elektroinstallation bzw. des Stahlbauers sind für die Entscheidung ohne Bedeutung, § 244 Abs. 3 S. 2 StPO. Selbst wenn sie erwiesen wären, würde die Kammer den nur möglichen, nicht zwingenden Schluss auf eine kognitive Beeinträchtigung des Angeklagten nicht ziehen. Der Sachverständige Prof.
2626S hat - auch auf entsprechende Nachfragen von Verfahrensbeteiligten – an meh-reren Beispielen nachvollziehbar erläutert, dass einzelne Handlungen des Angeklagten, die auf Dritte irrational, verwunderlich oder überraschend wirken mögen, keine
2627Rückschlüsse auf die Folgen des zulassen. Dabei
2628hat sich Prof. S beispielsweise auf die kurzfristige Heirat des Angeklagten nebst
26291531
2630nachfolgender Trennung bezogen.
2631![]() Der weitere Antrag auf Vernehmung der Zeugen und zum Beweis der Tatsache,
Der weitere Antrag auf Vernehmung der Zeugen und zum Beweis der Tatsache,
dass der Angeklagte "im Rahmen seines sozialen Engagements keinerlei komplexe organisatorische Dinge erledigte, sondern dies vollständig an eine Marketingagentur delegierte",
2633wird zurückgewiesen aus folgenden Gründen:
2634Der Antrag ist als Beweisermittlungsantrag einzustufen, da die Behauptung, der Angeklagte habe "keinerlei komplexe organisatorische Dinge erledigt", eine Wertung ist; welche "Dinge" der Angeklagte an die Marketingagentur delegiert hat, wird nicht mitgeteilt. Die Aufkärungspflicht des § 244 Abs. 2 StPO gebietet es nicht, dem Antrag nachzugehen:
2635Der Angeklagte selbst hat gegenüber Prof. S ausführlich über seine (auch) or-
2636ganisatorischen Tätigkeiten im Rahmen seines privaten und sozialen Engagements berichtet: "Privat sei er mit den Bauplanungen für das Ärztehaus befasst gewesen, er habe Gespräche mit Architekten und anderen Bauleuten geführt. Weiter habe er mit weiteren Personen ein Hospiz gebaut. Er sei der Vorsitzende des Fördervereins gewesen. Daneben habe es viele Abendveranstaltungen gegeben, so eine Veranstaltungsreihe in Form eines 'Gesundheitstalks', die alle sechs bis acht Wochen stattgefunden habe, oder Marketing-Aktionen der Stadt, wie ein Songcontest oder Laufwettbewerbe, wie den Tetraeder-Lauf. Er sei an zig Stellen tätig gewesen, was im Nachhinein einfach zu viel gewesen sei. Er habe eben immer Schwierigkeiten mit dem Nein-Sagen gehabt."
2637Dass er in diesem Zusammenhang auch Aufgaben in größerem Umfang z. B. an eine Marketingagentur delegiert hat, ist eine Selbstverständlichkeit für Führungskräfte und bestätigt eher das Bild des Angeklagten als eine Person, die in vielen Bereichen en-
2638gagiert war und die - wie der Angeklagte es selbst gegenüber Prof. S ausge-drückt hat - "funktionierte".
26391532
26402. Beweisantrag der Rechtsanwälte R und P vom
264129.06.2018, Beweisantrag des Rechtsanwalts S vom 03.07.2018
2642Die Beweisanträge der Rechtsanwälte R und P auf Vernehmung des
2643Sachverständigen Prof. Dr. F , hilfsweise eines weiteren Sachverständigen,
2644zu den Fragen
2645"1.
26462. – 5.
2647und der "ergänzende" Beweisantrag des Rechtsanwalts S vom 03.07.2018 mit
2648einer Vielzahl weiterer Beweisbehauptungen (ohne Nummerierung)
2649wird zurückgewiesen aus folgenden Gründen:
2650![]()
Erst recht bedarf es keiner "Einvernahme" eines weiteren Sachverständigen. Eine Be-
2652gründung hierfür wird nicht genannt. Durch das frühere Gutachten des Prof. S
2653ist das Gegenteil der behaupteten Tatsachen bereits erwiesen, § 244 Abs. 4 S. 2 StPO.
26541533
2655Seine Sachkunde ist nicht zweifelhaft. Dass sein Gutachten von unzutreffenden tatsächlichen Voraussetzungen ausgeht, ist nicht ersichtlich. Das Gutachten enthält auch keine Widersprüche, es ist plausibel und nachvollziehbar. Auf die vorstehenden Ausführungen in der Beweiswürdigung wird verwiesen.
26563. Beweisantrag der Rechtsanwälte R und S vom 03.07.2018
2657Der Beweisantrag der Rechtsanwälte R und S auf Einholung eines wei-
2658teren pharmazeutischen Sachverständigengutachtens zum Beweis der Tatsache,
2659"dass die von den Sachverständigen L und Dr. G mitgeteilten Analy-
2660seergebnisse zum Wirkstoffgehalt der von ihnen untersuchten und beim Angeklagten am 29.11.2016 sichergestellten Arzneimittelzubereitungen mit den 'Nummern 61.864 bis 61.930' (gemeint sind die entsprechenden Fälle der Anklage) nicht dem aktuellen Stand der pharmazeutischen Wissenschaft entsprechen",
2661wird gemäß § 244 Abs. 4 S. 2 Hs. 1 StPO zurückgewiesen. Das Gegenteil der behaup-
2662teten Tatsache ist durch die Gutachten der Sachverständigen L und Dr. G bereits erwiesen. Die Analyseergebnisse beider Gutachter entsprechen dem aktuellen Stand der pharmazeutischen Wissenschaft. Die Kammer nimmt insoweit Bezug auf ihre Ausführungen im Rahmen der Beweiswürdigung zu den Begutachtungen der bei-
2663den Sachverständigen L und Dr. G . Deren konkrete Analyseergebnisse ha-
2664ben auch die "methodenkritischen" Sachverständigen Prof. Dr. S , Dr. K und
2665Prof. Dr. B nicht in Zweifel gezogen; bemängelt wurden nur einzelne Dokumenta-tionsfehler.
2666Die Voraussetzungen des § 244 Abs. 4 S. 2 Hs. 2 StPO liegen nicht vor. Die Sach-
2667kunde der Sachverständigen L und Dr. G ist nicht zweifelhaft, die Kammernimmt Bezug auf ihre Ausführungen zur Beweiswürdigung. Dass die Gutachten von unzutreffenden tatsächlichen Voraussetzungen ausgehen, ist im Antrag weder vorgetragen noch anderweitig ersichtlich. Die Gutachten enthalten auch keine Widersprüche, sie sind plausibel und nachvollziehbar, die Analyseergebnisse sind in sich schlüssig. Die Kammer nimmt auch insoweit Bezug auf ihre Ausführungen im Rahmen der Beweiswürdigung.
26681534
2669Dass ein (unbenannter) neuer Sachverständiger über Forschungsmittel verfüge, die
2670denen der Sachverständigen L und Dr. G überlegen erscheinen, ist nicht vor-getragen (zu dem Punkt der „Guten Laborpraxis“ sogleich) und auch anderweitig nicht ersichtlich. Beide Sachverständige sind bzw. waren Mitarbeiter renommierter deutscher Untersuchungseinrichtungen, die über umfassende Forschungsmittel und die erforderliche Forschungsausstattung verfügen.
2671Die angewendeten Methoden wurden auch von den Sachverständigen Prof. Dr. S
2672l, Dr. K und Prof. Dr. B nicht beanstandet, sogar im Gegenteil ausdrücklichals sachgerecht und geeignet bezeichnet.
2673Auch unter Berücksichtigung der im Rahmen des Hilfsantrages formulierten Tatsachenbehauptungen und seiner Begründung ist der Antrag gemäß § 244 Abs. 4 S. 2 Hs. 1 StPO zurückzuweisen. Die Nachvollziehbarkeit und Reproduzierbarkeit der Ana-lyseergebnisse ist gewährleistet. Weder die "methodenkritischen" Sachverständigen
2674Prof. Dr. S , Dr. K und Prof. Dr. B noch die Verteidiger in ihrem Antraghaben konkret zu einer der durchgeführten Analysen mitteilen können, dass und ggf. welcher konkrete Arbeitsschritt nicht durchgeführt worden sei. Sie verharren - wie auch die Antragsbegründung - bei der pauschalen Behauptung, nicht alle Analyseschritte seien dokumentiert worden und die Untersuchungen wiesen eine Reihe vermeintlicher Fehler auf. Diese pauschalen Behauptungen können die überzeugenden Aussagen
2675der Sachverständigen L und Dr. G nicht erschüttern. Die Kammer nimmtauch insoweit Bezug auf ihre Ausführungen im Rahmen der Beweiswürdigung. Auf die
2676konkretisierten Kritikpunkte der Sachverständigen Dr. K geht die Kammer dort ein.
2677Ergänzend ist aber auf Folgendes hinzuweisen: Unzutreffend ist die Behauptung in
2678dem Antrag (S. 6 unten), der Sachverständige Dr. G habe eingeräumt, „nicht allesdokumentiert zu haben, was für eine Nachvollziehbarkeit der durchgeführten Analysen
2679hätte dokumentiert werden müssen“. Der Sachverständige Dr. G gab vielmehr an,dass alle Unterlagen, die die Analyseergebnisse der Messverfahren betreffen, auch
2680vorgelegt worden seien. Soweit von der Sachverständigen Dr. K fehlende Unter-lagen moniert worden seien, so lägen diese Unterlagen im Institut vor. Bei den weiteren vermeintlichen Fehlern handele es sich teilweise zwar um Mängel, keiner der Mängel habe aber auf ein Analyseergebnis Auswirkungen. Insoweit sei der Grundsatz „not written, not done“ nicht relevant. Dieser Einschätzung schließt sich die Kammer nach eigener Prüfung an.
26811535
2682Weiter ist die angebliche Aussage des Sachverständigen Dr. GM, dass das PEI von den Grundsätzen der sog. „Guten Laborpraxis" abgewichen sei, in dieser Form nicht zutreffend. Der Sachverständige Dr. (ffl gab vielmehr an, dass die Grundsätze der „Guten Laborpraxis" vorliegend nicht relevant seien, weil diese Praxis auf dem Chemikaliengesetz beruhe und für die Herstellung von Arzneimitteln maßgeblich sei. Der Untersuchungsgegenstand hier betreffe aber gerade nicht die Herstellung von Arzneimitteln, so dass es daher nicht auf die Anwendung der Grundsätze der "Guten Labor-prasxis" ankomme. Beispielsweise spielten für die Herstellung von Arzneimitteln Vorschriften zur Hygiene eine große Rolle, um Patienten nicht mikrobiell zu gefährden. Bei der Analyse von Zubereitungen auf ihren Wirkstoffgehalt sei dieser Gesichtspunkt dagegen zu vernachlässigen, da die untersuchten Zubereitungen nicht an Patienten appliziert würden. Diesen Ausführungen fogt die Kammer.
2683Der weitere Antrag,
2684„die immer noch nicht vorliegenden Rohdaten zu den verfahrensgegenständlichen Analysen der Sachverständigen IM und Dr. CM"
2685beizuziehen, wird ebenfalls zurückgewiesen. Der Antrag ist als Beweisermittlungsan-trag zu werten. Er ist am Maßstab der richterlichen Aufklärungspflicht gemäß § 244 Abs. 2 StPO zu messen. Folglich kommt es auf die Verpflichtung der Kammer an, das Sachverständigengutachten in seinen Grundlagen (Befund- und Zusatztatsachen) und in seinen Schlussfolgerungen auf seine Richtigkeit zu überprüfen (vgl. BGH, Beschluss vom 14.07.1995, Az. 3 StR 355/94 = StV 1995, 566).
2686Auf dieser Grundlage ist die Kammer nicht gehalten, von den Sachverständigen zu verlangen, weitere Arbeitsunterlagen ganz oder teilweise anzufordern:
2687Die Sachverständigen LM und Dr. CM habe ihre mündlichen Gutachten in den Hauptverhandlungsterminen vom 20. und 22.11.2017 (M) sowie 11.01.2018 (Dr. CM) erstattet. Ergänzend wurden die Sachverständigen in Anwesenheit der Sach-
2688verständigen Prof. Dr. Dr. KM und Prof. Dr. IM erneut befragt, der Sach-verständige Dr. CM am 22.03.2018, der Sachverständige LM am 16.05. und 11.06.2018. Es bestand für alle Beteiligten ausreichend Gelegenheit, zu den Unterlagen Fragen zu stellen. Die vorab an die Kammer übersendeten ausführlichen Unterlagen (insgesamt 22 Stehordner des LZG und 14 Stehordner des PEI) zu den einzelnen
26891536
2690Messverfahren, den eingesetzten Geräten, den SOPs und weiteren Bereichen konnten von den Verfahrensbeteiligten eingesehen werden.
2691Daher bedarf es keiner (weiteren) Beiziehung von „Rohdaten“ der Sachverständigen, zumal auch die Antragsteller nicht mitgeteilt haben, welche weitergehenden Erkenntnisse sie sich erhoffen und welche Unterlagen angeblich noch fehlen. Eine Definition ihres Verständnisses des Begriffs der "Rohdaten" enthält der Antrag nicht.
2692Der hilfsweise formulierte Antrag auf Einholung eines pharmazeutischen Sachverständigengutachtens zum Beweis weiterer im Einzelnen benannter Tatsachen wird eben-
2693falls zurückgewiesen. Die Gutachten der Sachverständigen L und Dr. G ent-sprechen dem aktuellen Stand der pharmazeutischen Wissenschaft, wie die Kammer ausführlich im Rahmen der Beweiswürdigung dargelegt hat.
2694Soweit in der Begründung des Antrags (S. 7 unter Punkt 3.) ergänzend die Einholung eines pharmazeutischen Sachverständigengutachtens zum Beweis der Tatsache beantragt wird,
2695"dass der Wirkstoffgehalt der am 29.11.2016 beschlagnahmten Arzneimittelzubereitungen mit den Nummern 61.864 bis 61.930 (auch insoweit sind die Taten der Anklage gemeint) die nach den ärztlichen Verordnungen vorgeschriebenen Wirkstoffe sowohl nach Art als auch nach Menge enthielten",
2696wird dieser Antrag ebenfalls gemäß § 244 Abs. 4 S. 2 Hs. 1 StPO zurückgewiesen.
2697Der Antrag ist im Hinblick auf den Kontext und die Begründung so auszulegen, dass als überlegenes Forschungsmittel im Sinne des § 244 Abs. 4 S. 2 Hs. 2 StPO auf die Einhaltung der Grundsätze der „Guten Laborpraxis“ abgestellt werden soll. Diese Grundsätze sind – wie die Kammer bereits ausgeführt hat, vorliegend nicht relevant, da sie sich auf die Herstellung von Arzneimitteln beziehen, um die es nicht geht. Darüber hinaus hat die Kammer auch durchgreifende Zweifel, dass es sich bei der geforderten Einhaltung der Grundsätze der „Guten Laborpraxis“ um ein überlegenes Forschungsmittel im Sinne der Vorschrift handelt. Forschungsmittel in diesem Sinne sind Hilfsmittel und Verfahren, deren sich der Sachverständige für seine wissenschaftlichen Untersuchungen bedient und deren Anwendung auch den Erstgutachter in entscheidungserheblicher Weise zu einem zuverlässigeren und überzeugenderen Ergebnis hätten gelangen lassen. Gemeint sind nur solche Forschungsmittel, die infolge Ausbil-
2698
![]()
![]()
![]()

![]()
![]() 1537
1537
dung, Forschung, technischer Möglichkeiten, Institutsausstattung und Erkenntnismöglichkeit dem wissenschaftlichen Verfügungskreis eines Sachverständigen zuzurechnen sind (vgl. BGH, Urteil vom 12.02.1998, Az.: 1 StR 588/97). Die Anwendung von Grundsätzen fällt bereits nicht unter diesen Begriff. Die Ausführungen im Antrag, dass
2700die Sachverständigen Dr. G und L „Verfahren ein[gesetzt hätten], die mit ei-nem höheren Fehlerrisiko behaftet sind, als andere ebenfalls verfügbare Verfahren“, stellt sich wiederum als pauschale Behauptung dar, die nicht belegt ist. Eine erhöhte
2701Fehleranfälligkeit haben weder der Sachverständige L noch der Sachverständige
2702Dr. G bestätigt, noch ist diese sonst ersichtlich. Auch unzutreffend ist die weitere
2703pauschale Behauptung, dass die Sachverständigen keine zweite Probe, bezeichnet
2704als „B-Probe“, durchgeführt hätten. Der Sachverständige L hat bei jeder Probeaus dem Labor des Angeklagten mit einem Mindergehalt eine zweite Messung vorgenommen. Insoweit wird auf die Ausführungen zu den einzelnen Messungen im Rahmen der Beweiswürdigung Bezug genommen.
2705Auch sind die weiteren Ausführungen im Antrag unzutreffend, dass die Sachverständigen eine „Fehlerquote“ von 10 % angenommen hätten. Nur der Sachverständige Dr.
2706G hat allein für das Verfahren der Proteinbestimmung bei 280 nm eine Messunsi-cherheit (nicht eine Fehlerquote) von 10 % angenommen. Die Messunsicherheit beschreibt verschiedene Unsicherheitsfaktoren einer Messung und den Bereich der möglichen zutreffenden Ergebnisse. Unzutreffend ist hingegen die Behauptung, dass es sich um eine Fehlerquote handele, insbesondere ist nicht der Schluss zu ziehen, dass 10 % der Messungen unzutreffend sind.
2707Hinsichtlich der weiteren Ausführungen im Antrag zur Frage der Geeignetheit der Methode der Proteinbestimmung bei 280 nm und der Vorgaben des Europäischen Arzneibuches nimmt die Kammer wiederum Bezug auf ihre Ausführungen im Rahmen der Beweiswürdigung.
2708![]()